СОСТАВ ЗЕМНОЙ КОРЫ И ЛИТОСФЕРЫ презентация
Содержание
- 2. По данной теме - минералогии выполняются лабораторные работы: «Физико-диагностические свойства
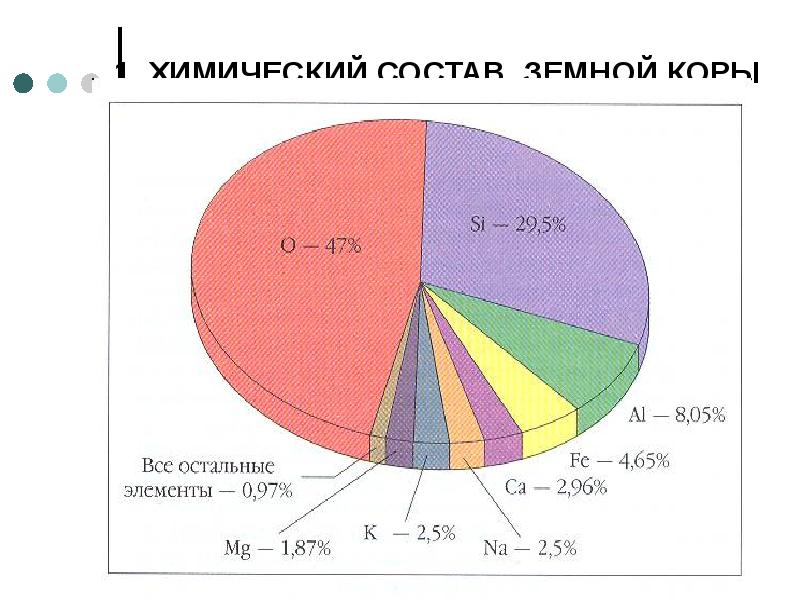
- 3. 1. ХИМИЧЕСКИЙ СОСТАВ ЗЕМНОЙ КОРЫ
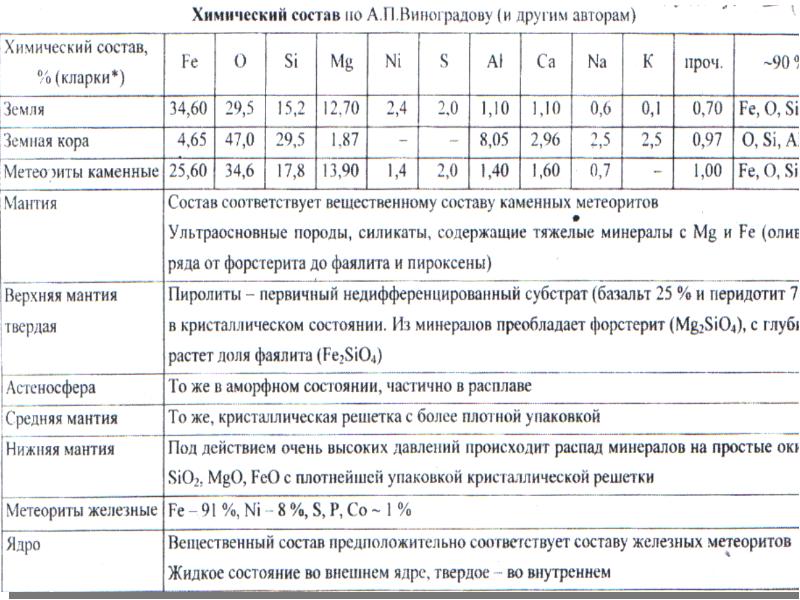
- 4. Содержание химического элемента в земной коре Кларк(А.Е. Ферсман)
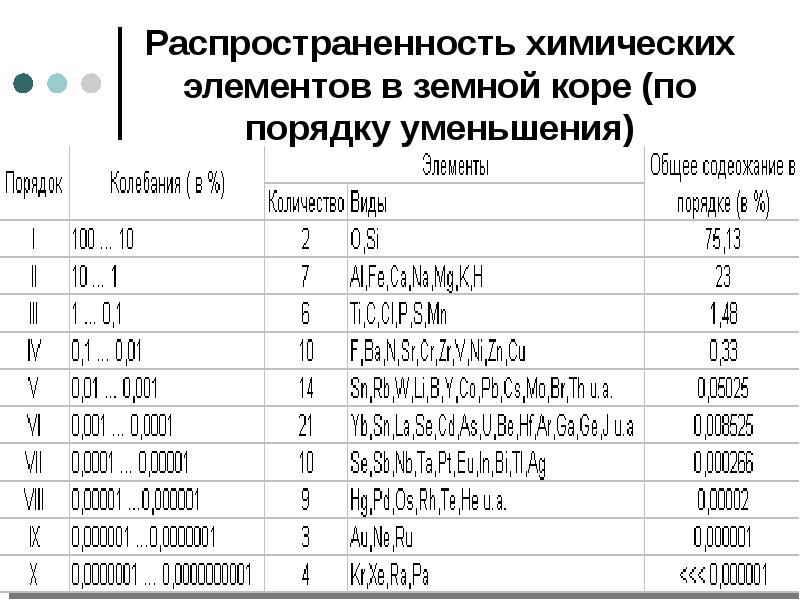
- 6. Распространенность химических элементов в земной коре (по порядку уменьшения)
- 7. В целом, мы видим: В земной коре установлено около
- 8. Химические элементы Встречаются в земной коре и недрах Земли в виде
- 9. 2. Основы минералогии Минералы - составные части горных пород в
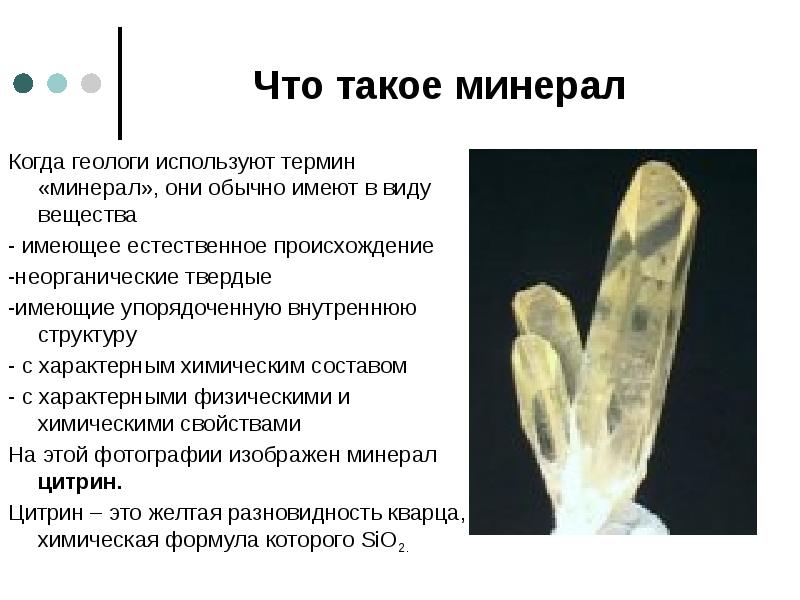
- 10. Что такое минерал Когда геологи используют термин «минерал», они обычно имеют
- 11. Кристаллы Граната в форме ромбододекаэдров Альмандин. Мама, Вост. Сибирь, Россия. Кристаллы
- 12. Что такое минерал Голубой минерал на этой фотографии – кианит –
- 13. 1. Кристалл пирита, 4,5 см. Навахун, Испания. 1. Кристалл пирита, 4,5
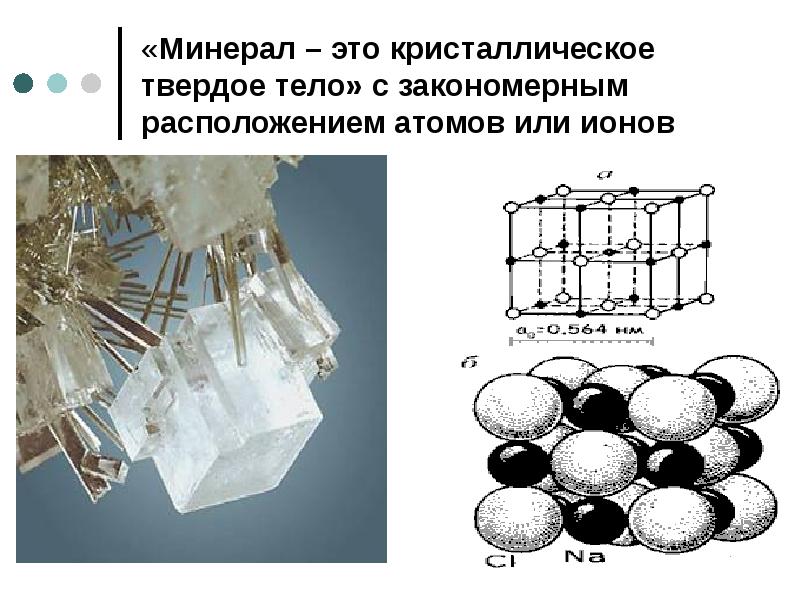
- 14. «Минерал – это кристаллическое твердое тело» с закономерным расположением атомов или
- 15. Образование любого минерала Можно представить как присоединение химических элементов друг ко
- 16. Внутренняя структура минералов Мы можем условно рассматривать ионы в структуре минералов
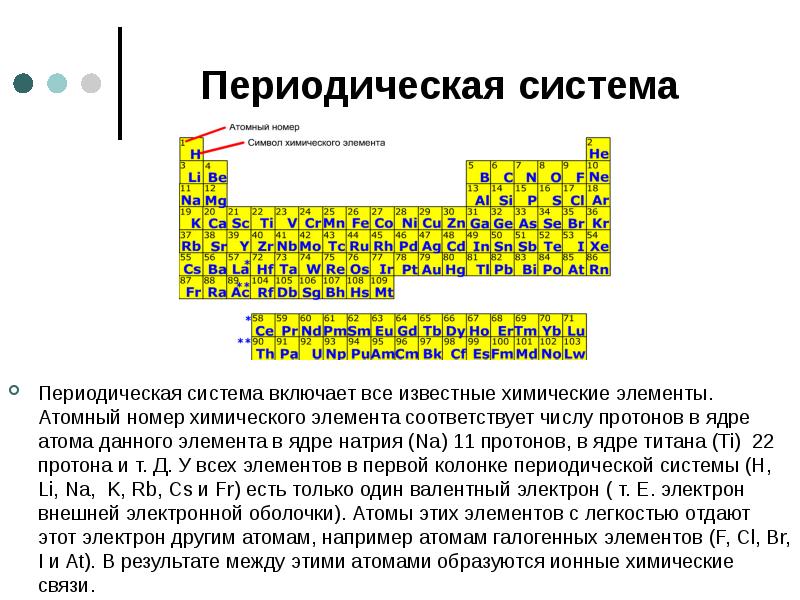
- 17. Периодическая система Периодическая система включает все известные химические элементы. Атомный номер
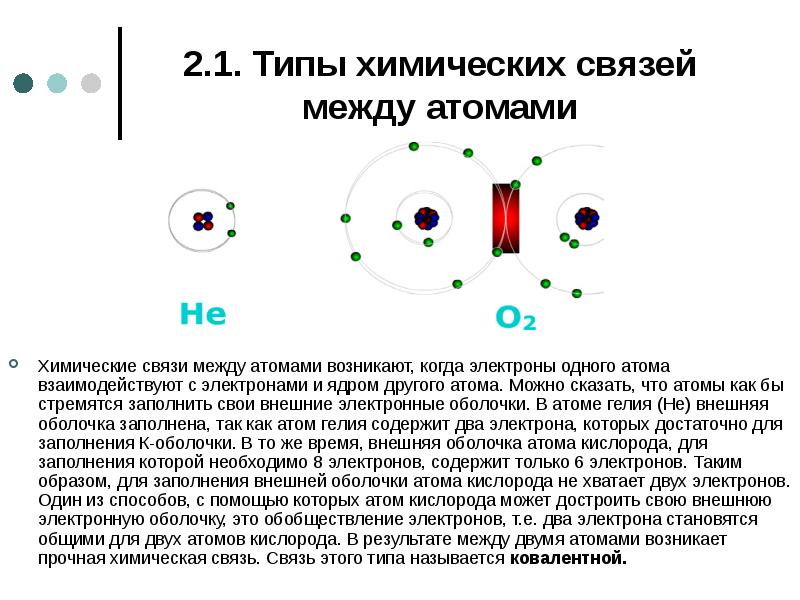
- 18. 2.1. Типы химических связей между атомами Химические связи между атомами возникают,
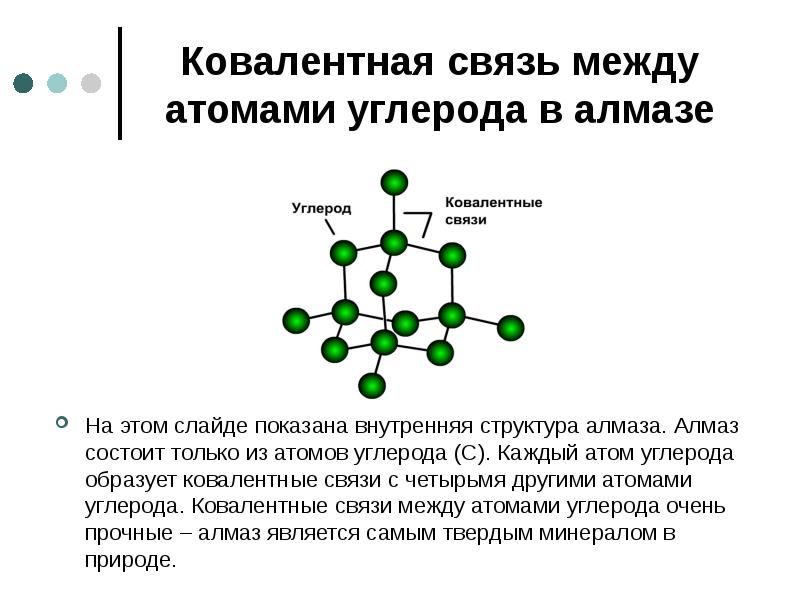
- 19. Ковалентная связь между атомами углерода в алмазе На этом слайде показана
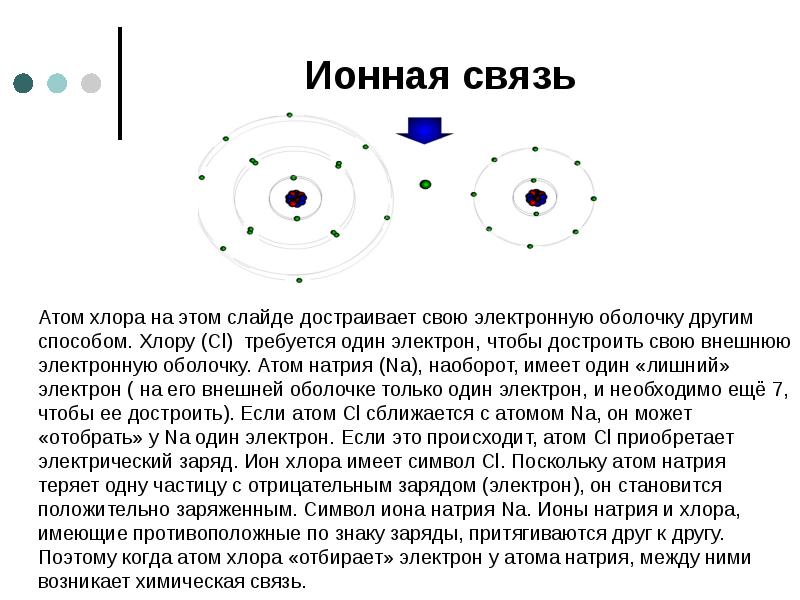
- 20. Ионная связь Атом хлора на этом слайде достраивает свою электронную
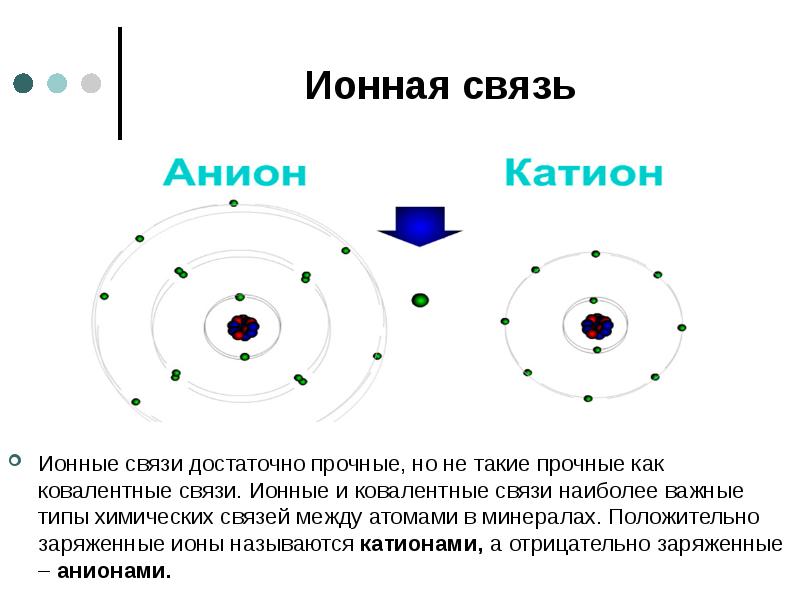
- 21. Ионная связь Ионные связи достаточно прочные, но не такие прочные как
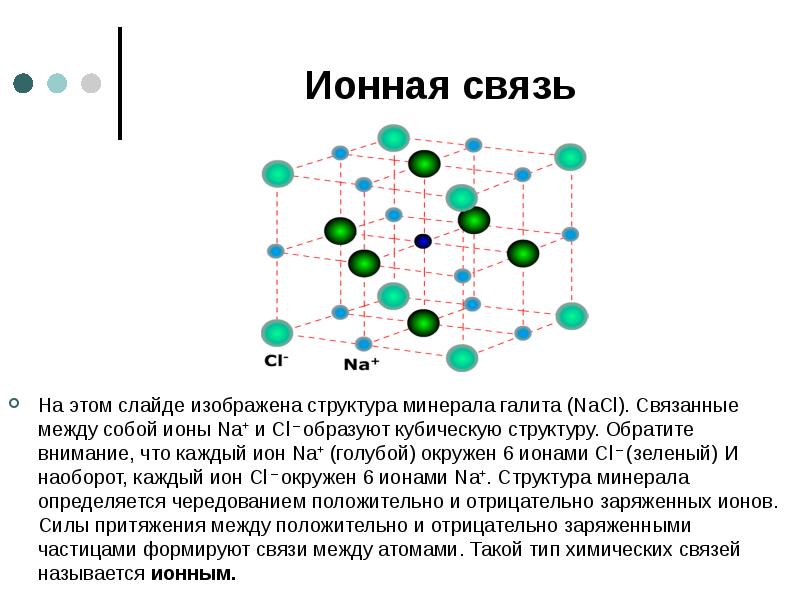
- 22. Ионная связь На этом слайде изображена структура минерала галита (NaCl). Связанные
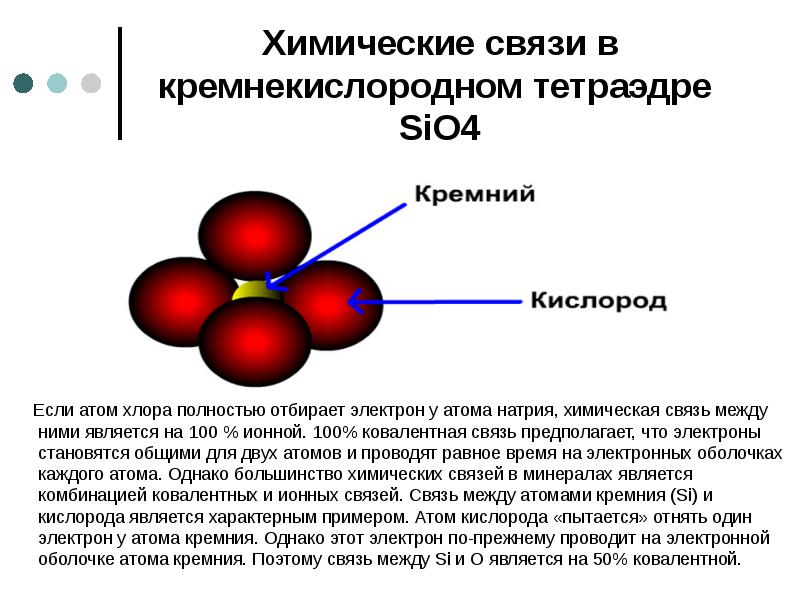
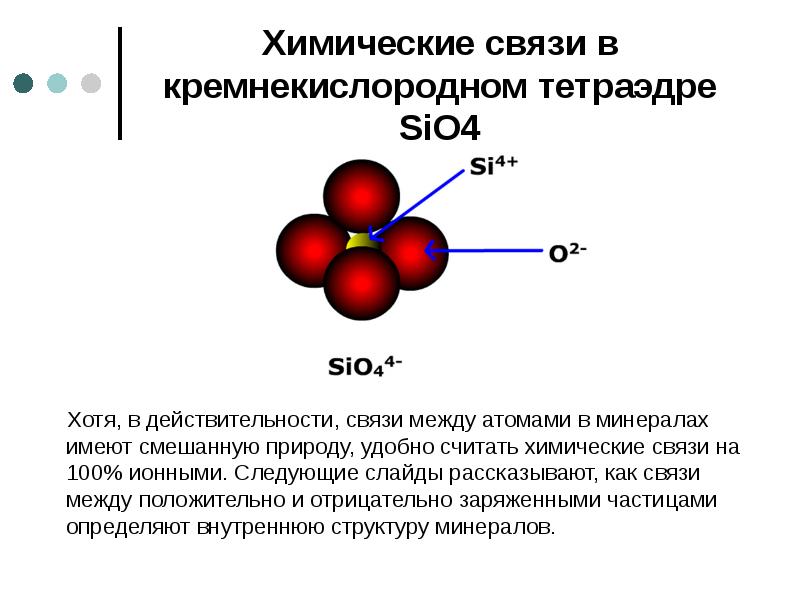
- 23. Химические связи в кремнекислородном тетраэдре SiO4 Если атом хлора полностью
- 24. Химические связи в кремнекислородном тетраэдре SiO4 Хотя, в действительности, связи
- 25. Другие типы химических связей Металлическая связь характерна для атомов металлов,
- 26. Другие типы химических связей Ван дер Ваальсовы связи это
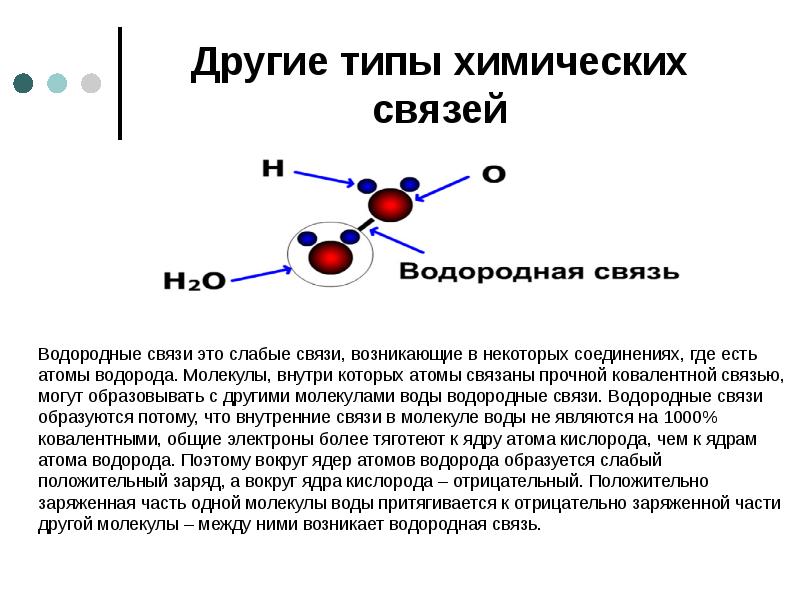
- 27. Другие типы химических связей Водородные связи это слабые связи, возникающие
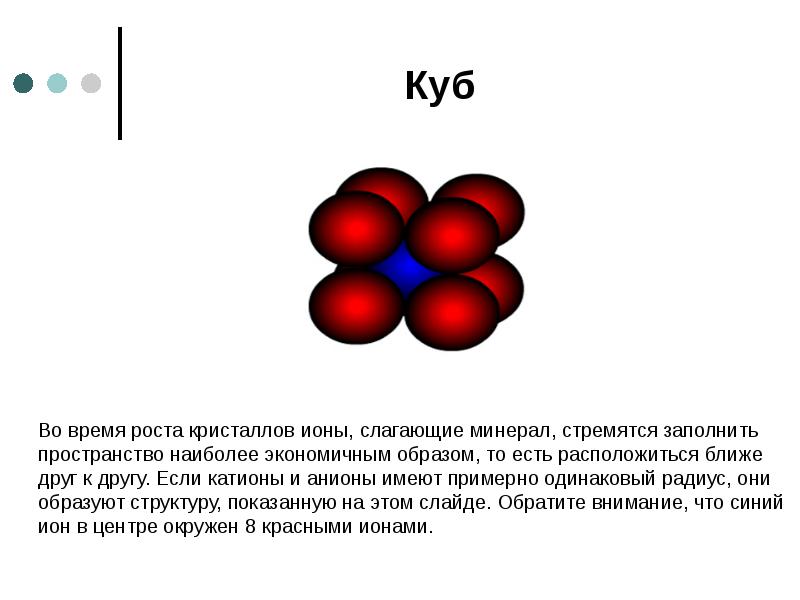
- 28. Куб Во время роста кристаллов ионы, слагающие минерал, стремятся заполнить
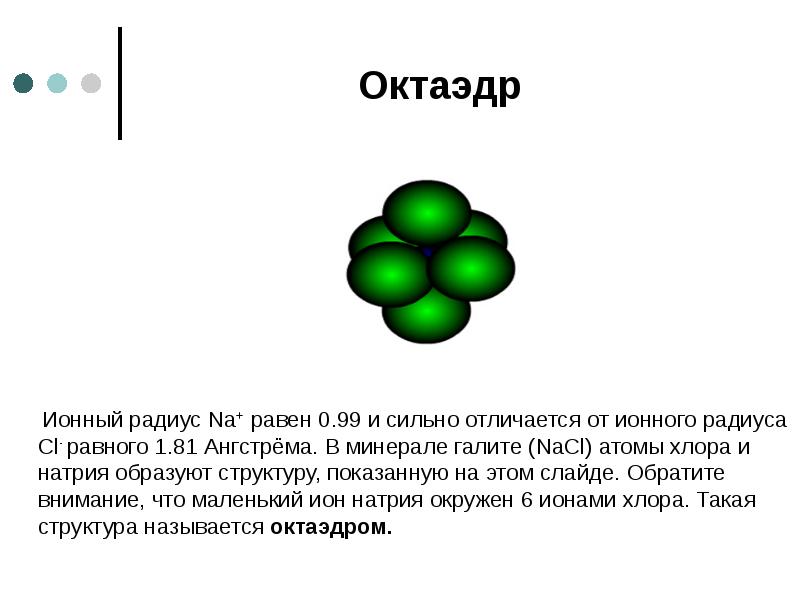
- 29. Октаэдр Ионный радиус Na+ равен 0.99 и сильно отличается от
- 30. Тетраэдр Радиус иона кислорода О2- в 5 раз больше ионного
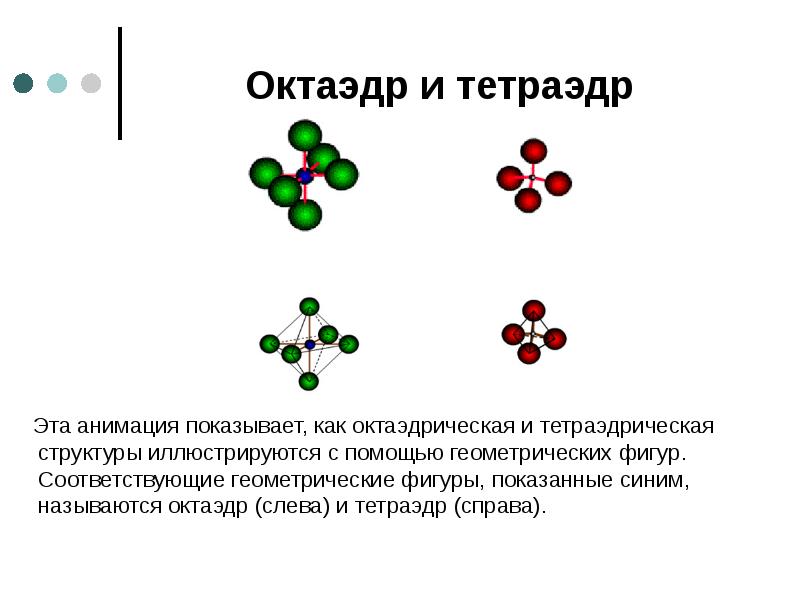
- 31. Октаэдр и тетраэдр Эта анимация показывает, как октаэдрическая и тетраэдрическая
- 32. 2.2. Внутренняя структура и форма кристаллов Форма кристаллов минерала определяется
- 33. Внутренняя структура и форма кристаллов Минералы пирит (FeS2) и галенит
- 34. Внутренняя структура и форма кристаллов Основной структуры минерала кварца являются
- 35. Внутренняя структура минералов На этих фотографиях кристаллы некоторых других минералов.
- 36. Морфология индивидов : алмаз, пирит гранат (куб.), турмалин (триг.)
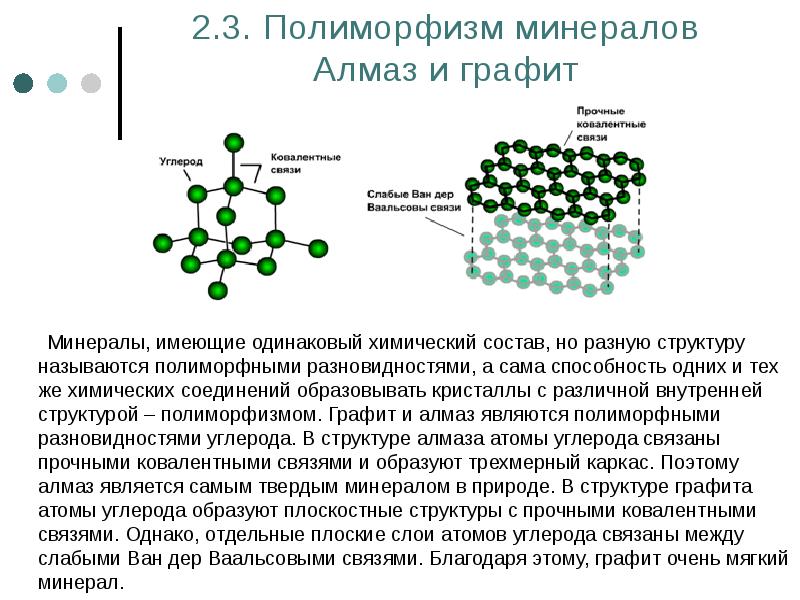
- 37. 2.3. Полиморфизм минералов Алмаз и графит Минералы, имеющие одинаковый
- 38. Полиморфизм Это явление кристаллизации химических соединений одного состава с
- 39. Полиморфизм минералов Графит, плотность которого 2,1 г/см3, стабилен до глубин
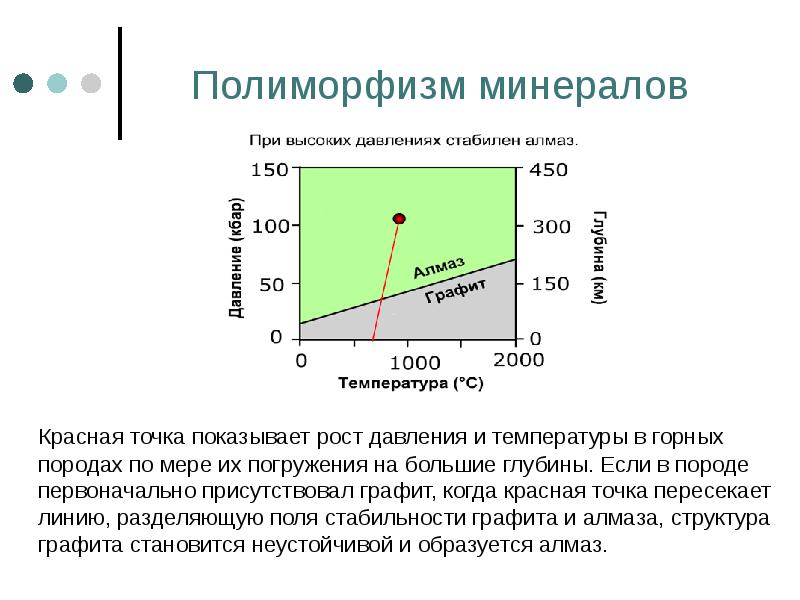
- 40. Полиморфизм минералов Красная точка показывает рост давления и температуры в
- 41. 2.4. Изоморфизм Это способность химических элементов замещать друг друга в
- 42. Изоморфизм На этом рисунке показаны размеры ионов, которые слагают наиболее распространенные
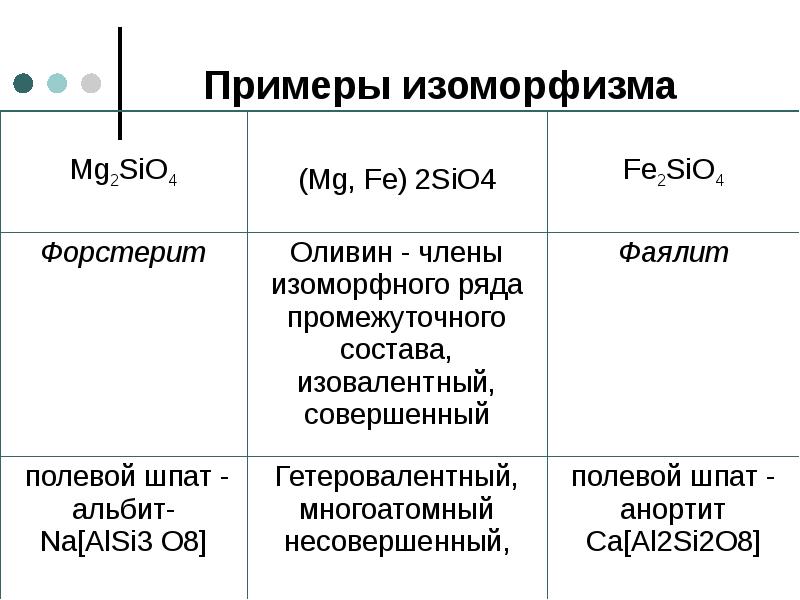
- 43. Примеры изоморфизма
- 44. Изоморфизм Na+ и К+ имеют одинаковый заряд (+1) и относительно
- 45. Изоморфизм Ионы Fe2+ и Mg2+ имеют одинаковый заряд и близкие
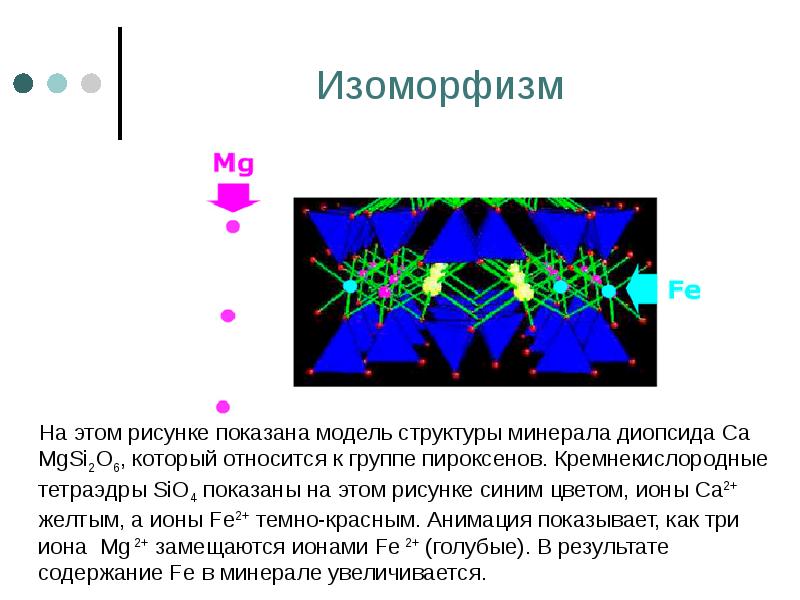
- 46. Изоморфизм На этом рисунке показана модель структуры минерала диопсида Ca
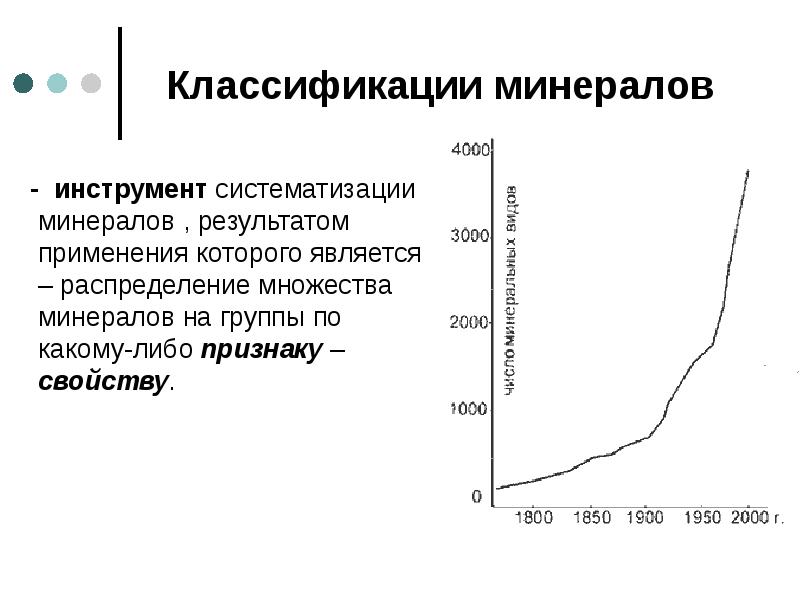
- 47. 3. Классификация минералов В природе зарегистрировано около 4000 минеральных
- 48. Классификации минералов - инструмент систематизации минералов , результатом применения которого
- 49. Первые классификации минералов: (18 век) по цвету по форме кристаллов по
- 50. Классификации минералов (19 век): По химическому составу – по преобладающему элементу
- 51. Современная кристаллохимическая классификация минералов опирается на 2 принципа: сходство химического
- 53. Учитывая ХС земной коры, мы видим, что среди минералов преобладают классы
- 54. Структура силикатов Для элемента – кислород и кремний – составляют
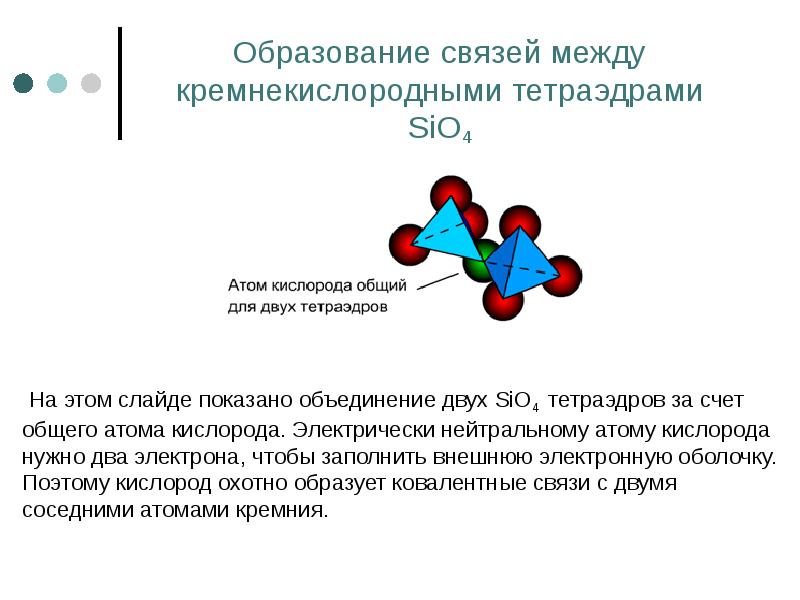
- 55. Образование связей между кремнекислородными тетраэдрами SiO4 На этом слайде показано
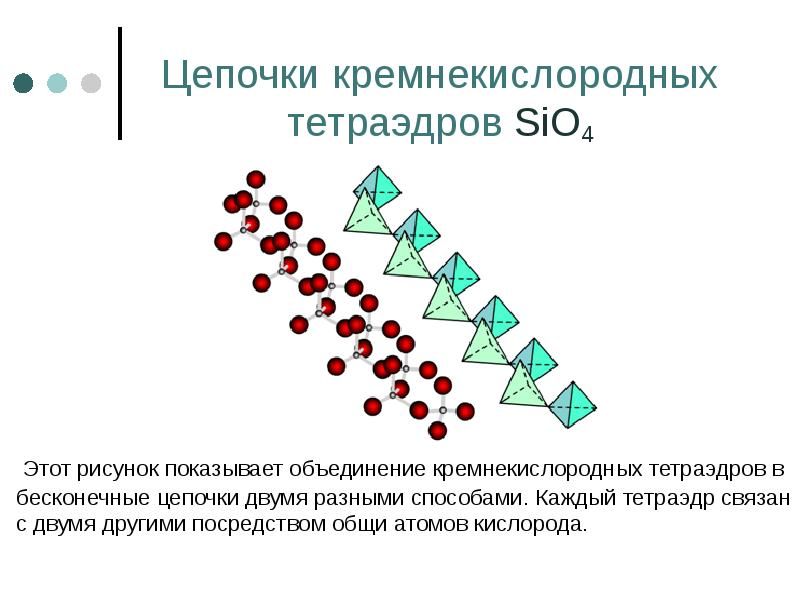
- 56. Цепочки кремнекислородных тетраэдров SiO4 Этот рисунок показывает объединение кремнекислородных тетраэдров
- 57. Островные, кольцевые и листовые силикаты В зависимости от того, как
- 58. Гроссуляр и циркон К островным или ортосиликатам относятся несколько минералов
- 59. Оливин и кианит Оливин и кианит также относятся к ортосиликатам.
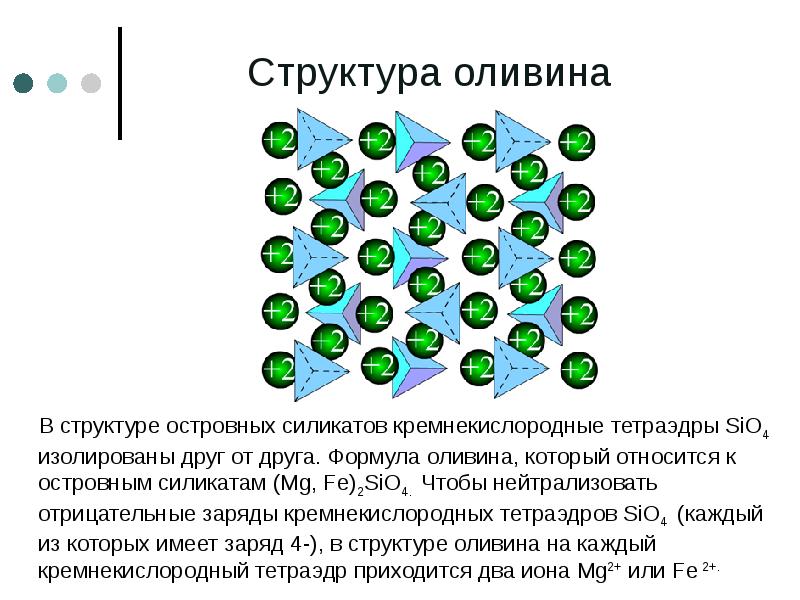
- 60. Структура оливина В структуре островных силикатов кремнекислородные тетраэдры SiO4 изолированы
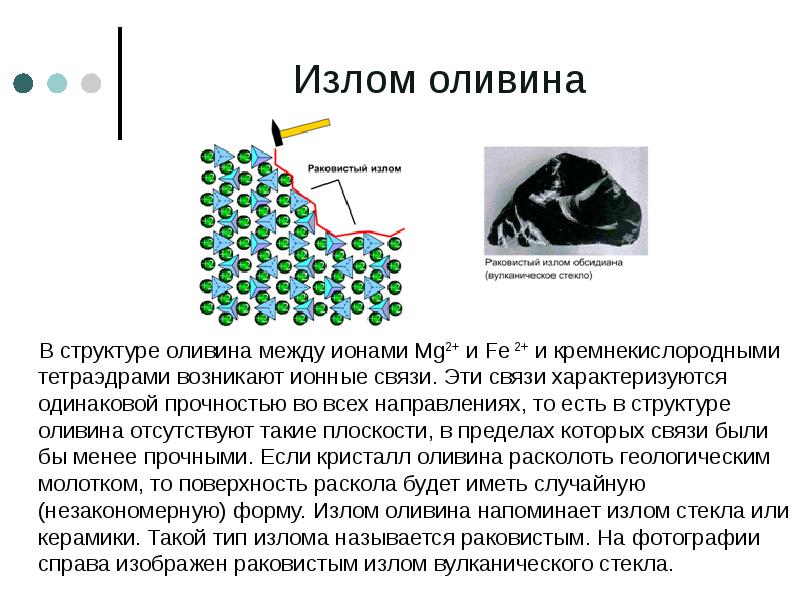
- 61. Излом оливина В структуре оливина между ионами Mg2+ и Fe
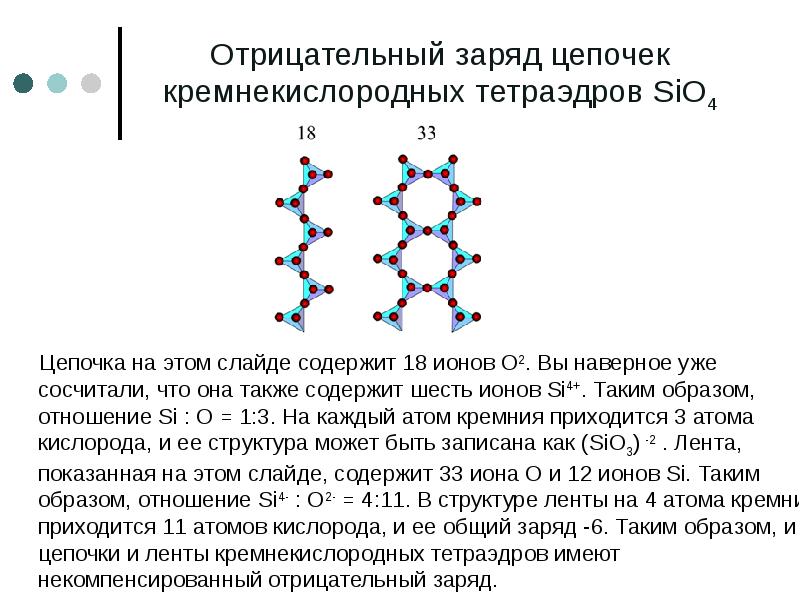
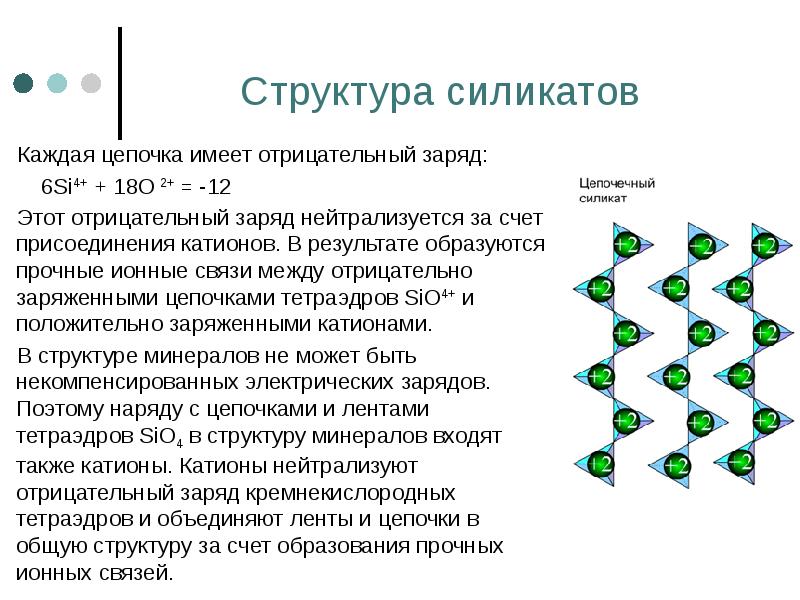
- 62. Отрицательный заряд цепочек кремнекислородных тетраэдров SiO4 Цепочка на этом слайде
- 63. Структура силикатов Каждая цепочка имеет отрицательный заряд:
- 64. Пироксены Минералы из группы пироксенов являются наиболее распространенными цепочечными силикатами.
- 65. Пироксены Другой минерал из группы пироксенов – диопсид. Формула диопсида
- 66. Пироксены Геденбергит, который также относится к пироксенам, темно-зеленого цвета.
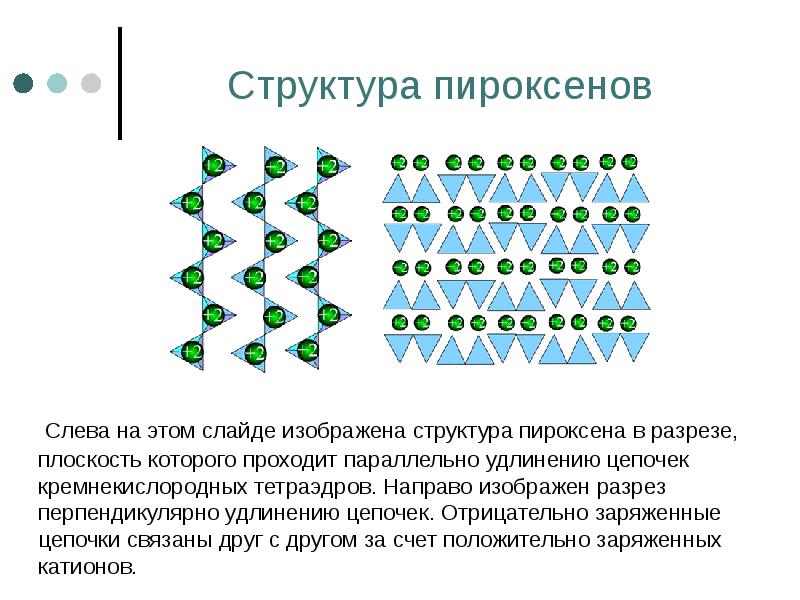
- 67. Структура пироксенов Слева на этом слайде изображена структура пироксена в
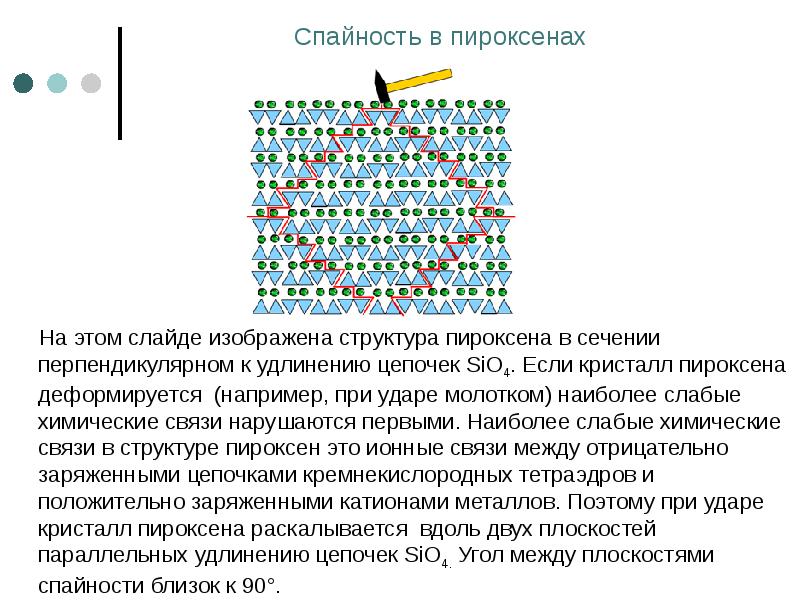
- 68. Спайность в пироксенах На этом слайде изображена структура пироксена в
- 69. Спайность в пироксенах Способность кристаллов минералов раскалываться по определенным направлениям
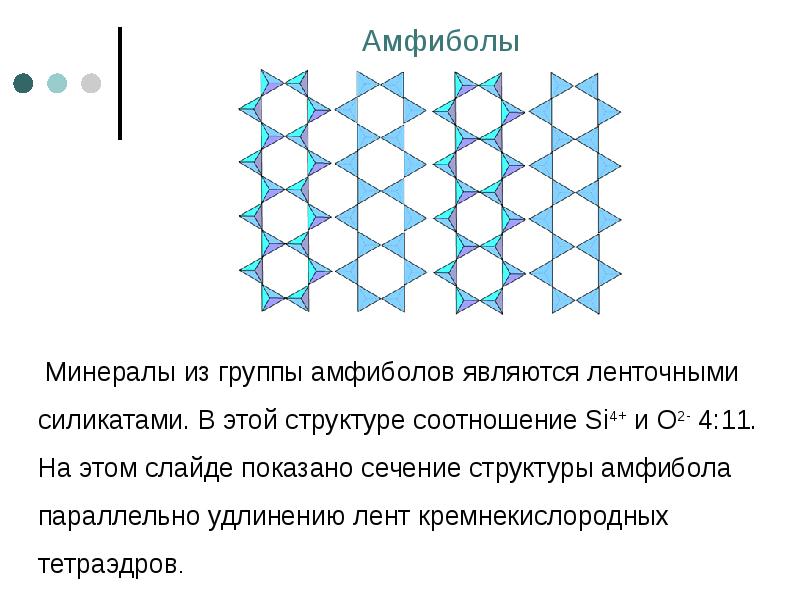
- 70. Амфиболы Минералы из группы амфиболов являются ленточными силикатами. В этой
- 71. Амфиболы Тремолит и актинолит относятся к группе амфиболов. Формула тремолита:
- 72. Амфиболы На фотографии слева кристалл роговой обманки из группы амфиболов,
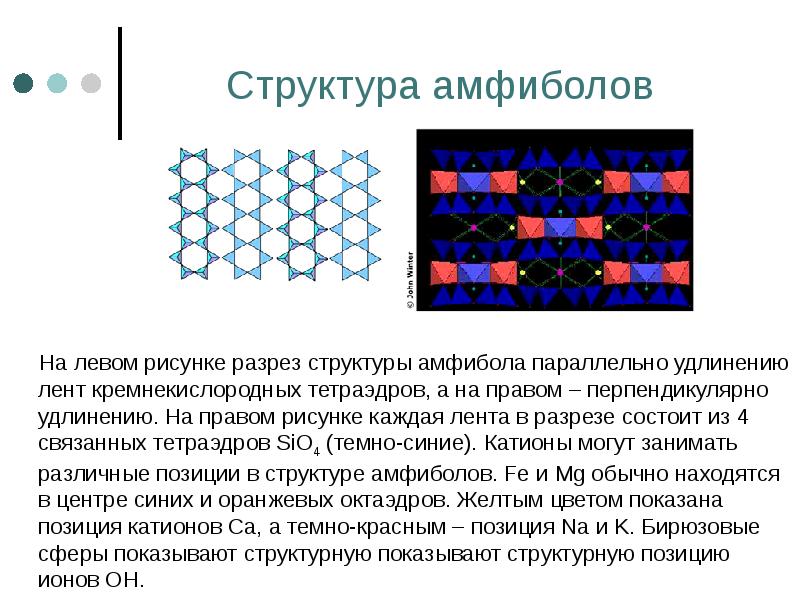
- 73. Структура амфиболов На левом рисунке разрез структуры амфибола параллельно удлинению
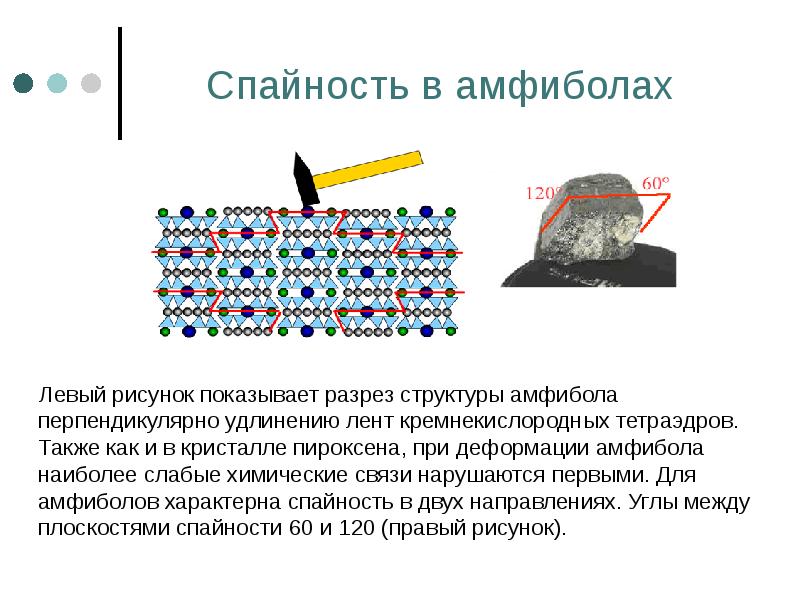
- 74. Спайность в амфиболах Левый рисунок показывает разрез структуры амфибола перпендикулярно
- 75. Асбест
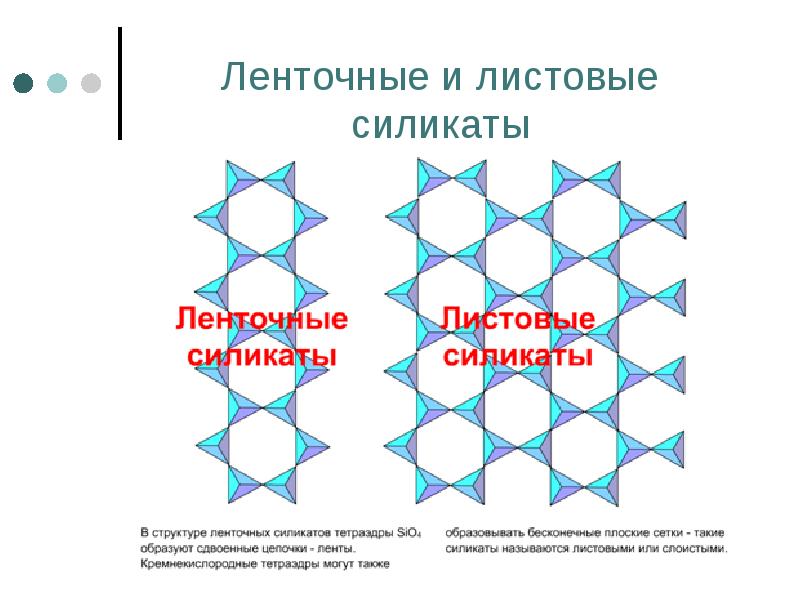
- 76. Ленточные и листовые силикаты
- 77. Слюды
- 78. Другие листовые силикаты
- 79. Другие листовые силикаты
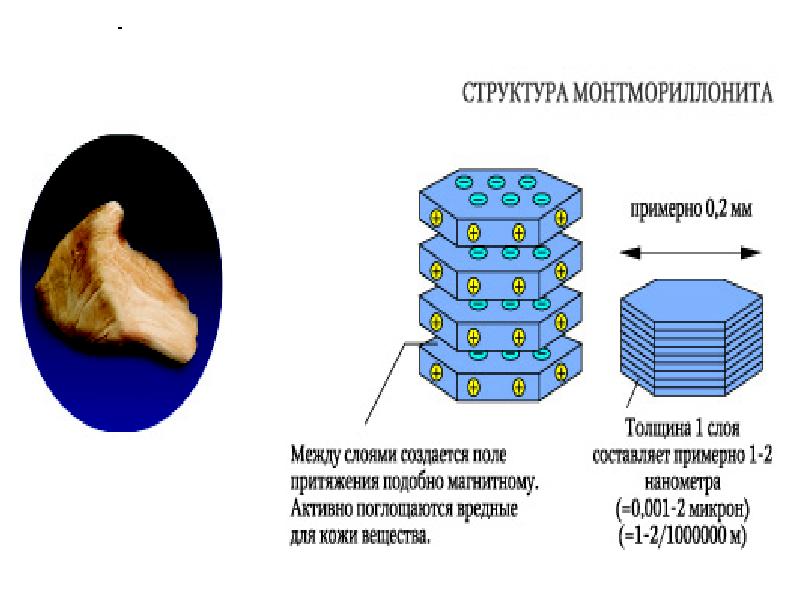
- 81. Структура листовых силикатов
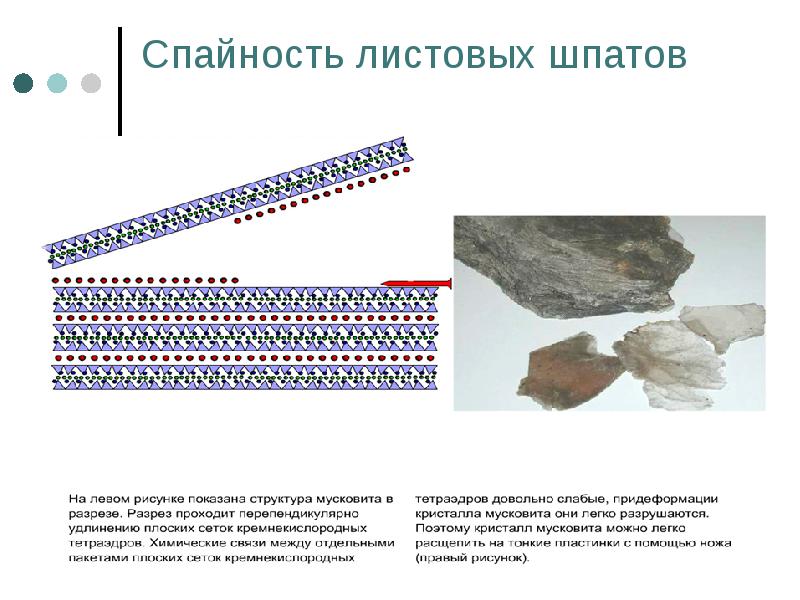
- 82. Спайность листовых шпатов
- 83. Каркасные силикаты
- 84. Щелочной полевой шпат
- 85. Плагиоклазы
- 86. Амазонит
- 87. Структура полевой шпатов
- 88. Спайность в полевых шпатах
- 89. Оксиды
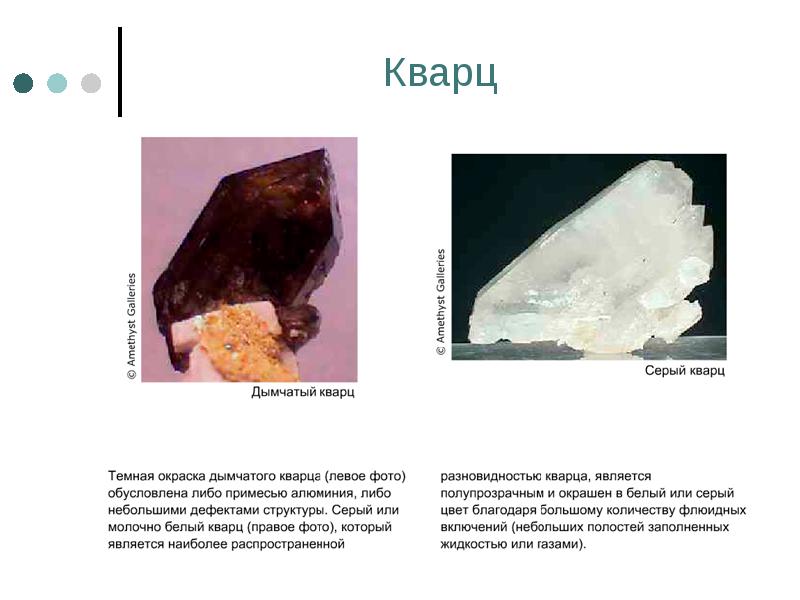
- 90. Кварц
- 91. Кварц
- 92. Кварц
- 93. Кварц
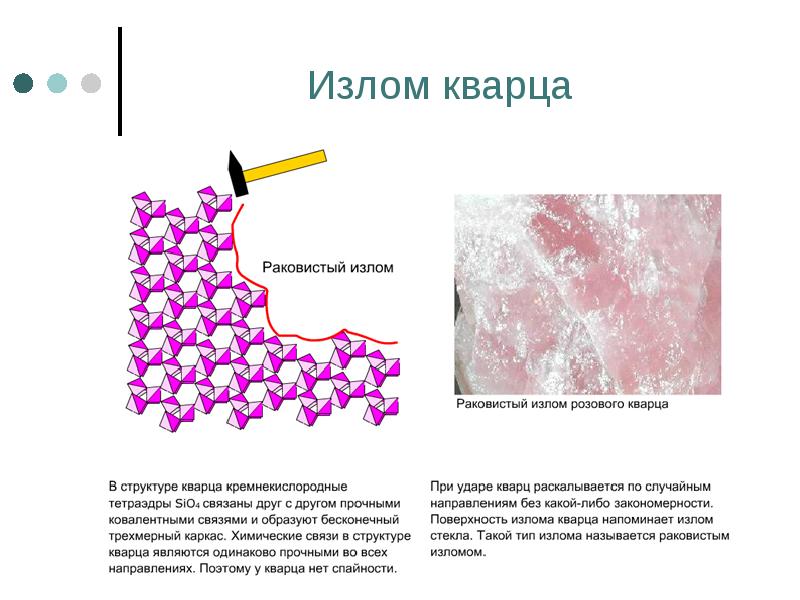
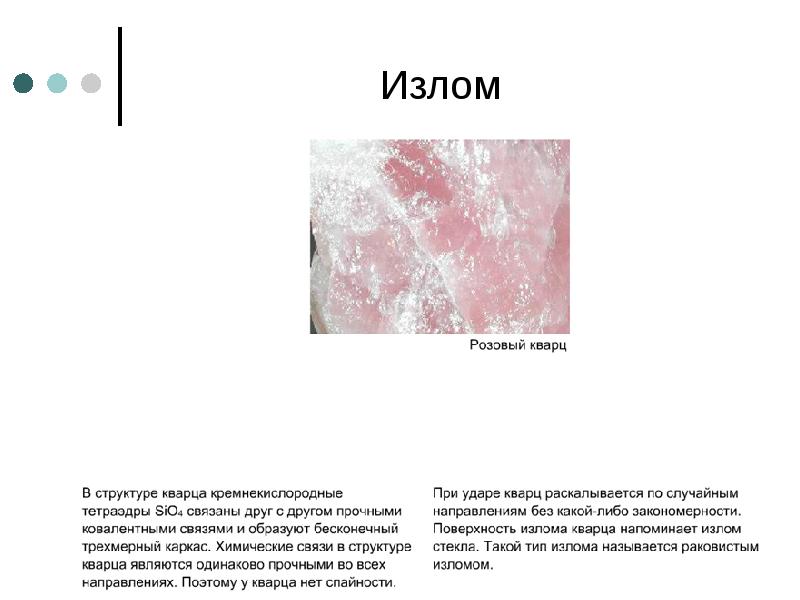
- 94. Излом кварца
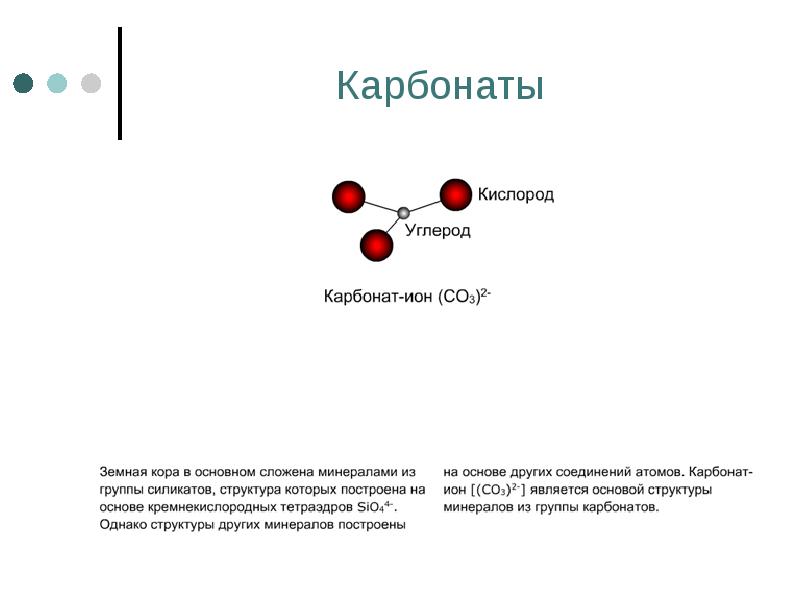
- 95. Карбонаты
- 96. Карбонаты
- 97. Кристаллы Кальцита, до 3,5 см – агрегат – сростки, Ущ. Лухумисцкали,
- 98. Сульфаты
- 99. Сульфиды
- 100. Фосфаты
- 101. Современная минералогия Твердые природные соединения (вещества) аморфного, т.е. не упорядоченного строения-
- 102. 4. Физические свойства минералов
- 103. Твердость по шкале Мооса
- 104. Твердость по шкале Мооса
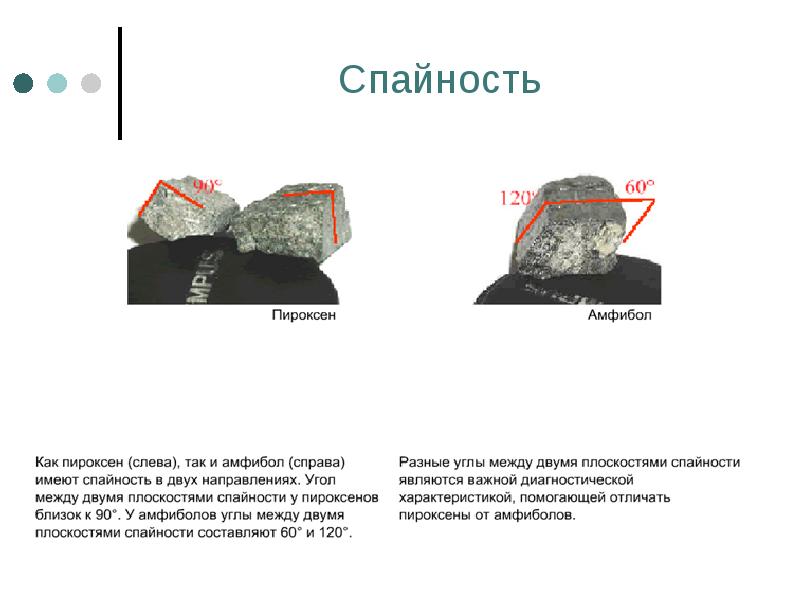
- 105. Спайность
- 106. Спайность
- 107. Спайность
- 108. Излом
- 109. Цвет
- 110. Цвет
- 111. Цвет черты
- 112. Габитус кристаллов
- 113. Магнитность
- 114. Растворимость
- 115. Плотность
- 116. Плотность
- 117. Поляризационный микроскоп
- 118. Гранат и амфибол под микроскопом
- 119. Эклогит под микроскопом
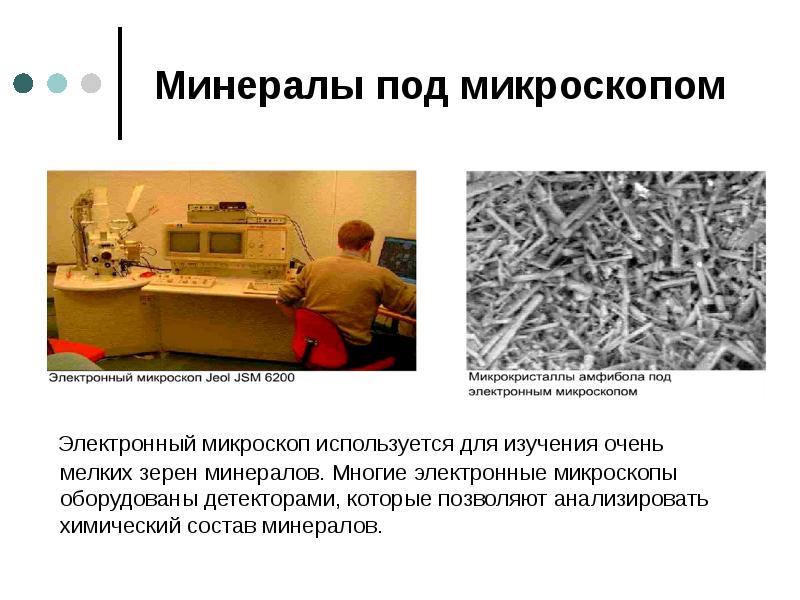
- 120. Минералы под микроскопом Электронный микроскоп используется для изучения очень мелких
- 121. Скачать презентацию













































































Слайды и текст этой презентации
Похожие презентации





























