1 Лекция 5 "Химическая кинетика и катализ Смещение химического равновесия" презентация
Содержание
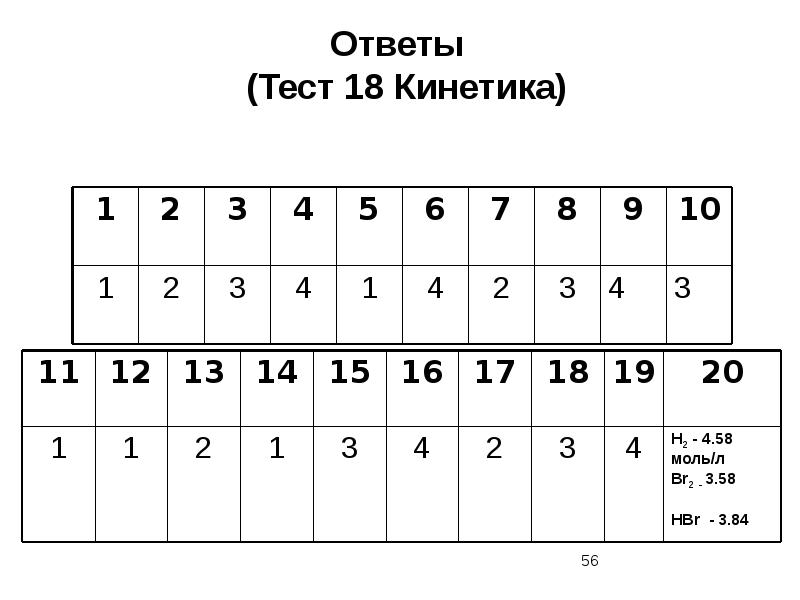
- 35. Тест 18 Кинетика. Катализ, Химическое равновесие (один вариант ответа)
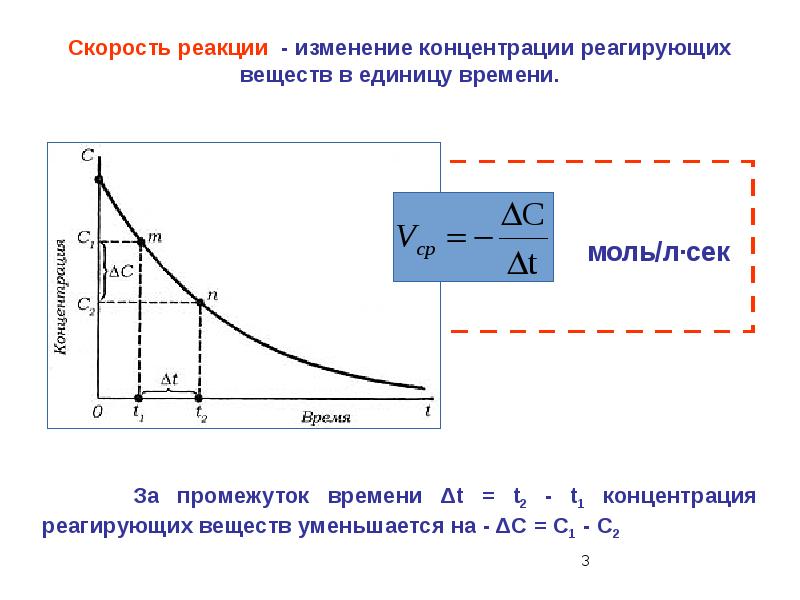
- 36. 1. Единица измерения скорости гомогенной химической реакции: 1) моль/л ∙ с 2) кмоль ∙
- 37. 2. Скорость любой химической реакции зависит от: давления температуры площади соприкосновения реагирующих
- 38. 3. Во сколько раз изменится скорость реакции 2SО2 + О2 →
- 39. 4. Через определенный промежуток времени после начала реакции 2СО2 + С
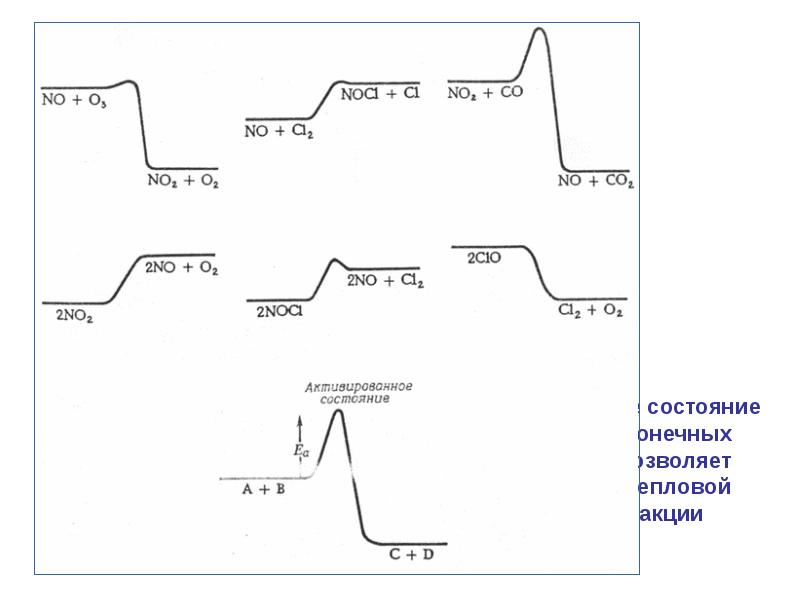
- 40. 5. В реакции, схема которой 2А(г) + В(г) →C + D,
- 41. 6. Во сколько раз надо увеличить концентрацию кислорода в реакции, уравнение
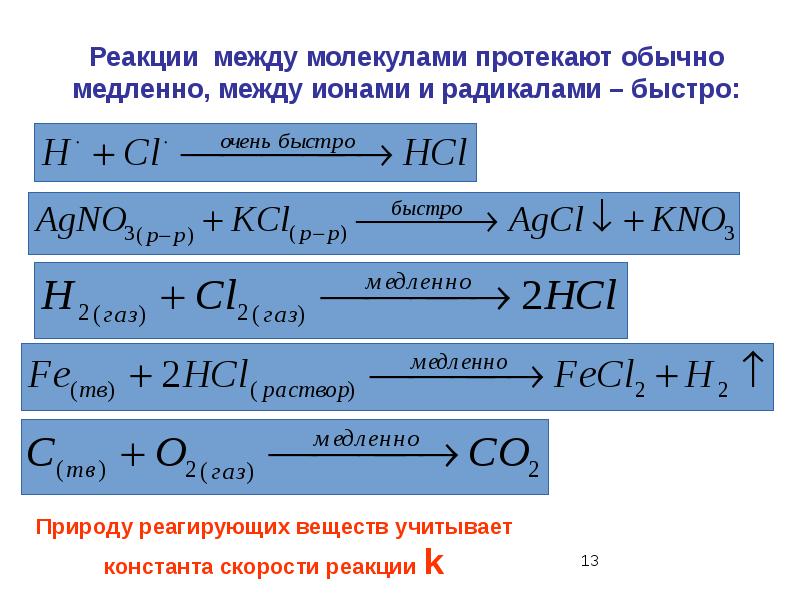
- 42. 7. Константа скорости химической реакции не зависит: от природы реагирующих веществ
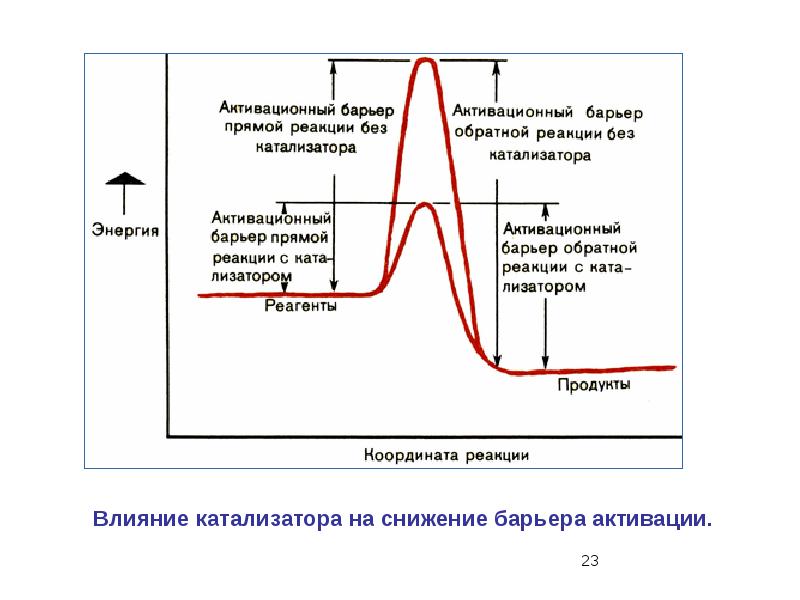
- 43. 8. В присутствии катализатора протекает реакция, уравнение которой: S + О2 →
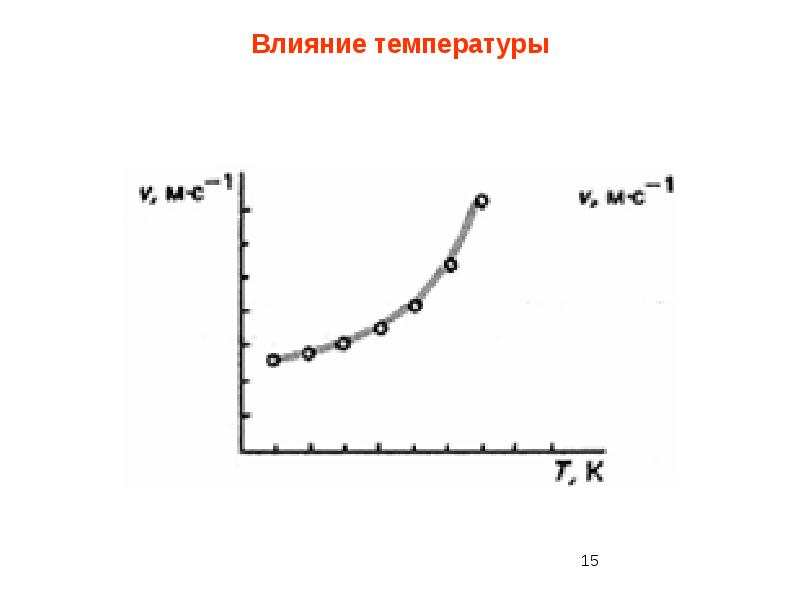
- 44. 9. Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции
- 45. 10. Температурный коэффициент реакции равен 2. На сколько градусов надо уменьшить температуру,
- 46. 11. При 30 °С химическая реакция протекает за 225 с. За какое
- 47. 12. При 10°С реакция протекает за 8 мин, а при 60 °С—
- 48. 13. Обратимой является реакция, уравнение которой: NaOH + НСI → NaCI +
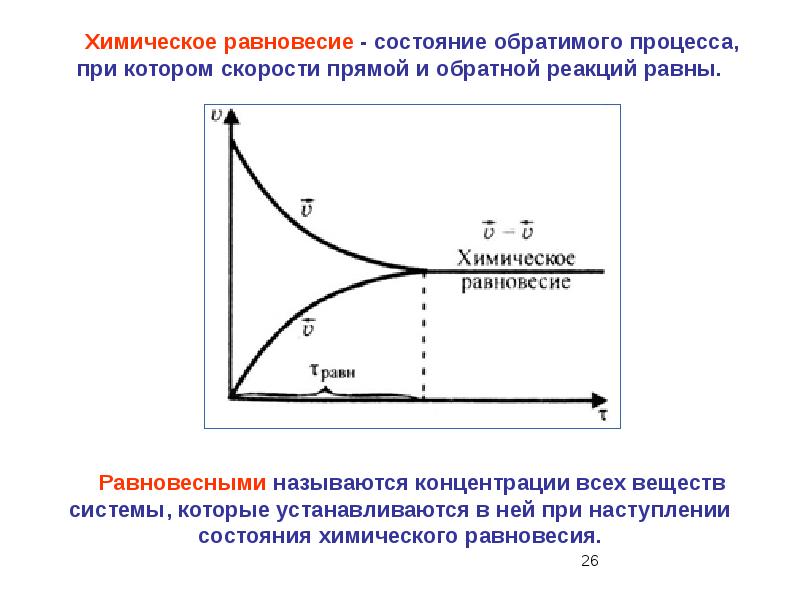
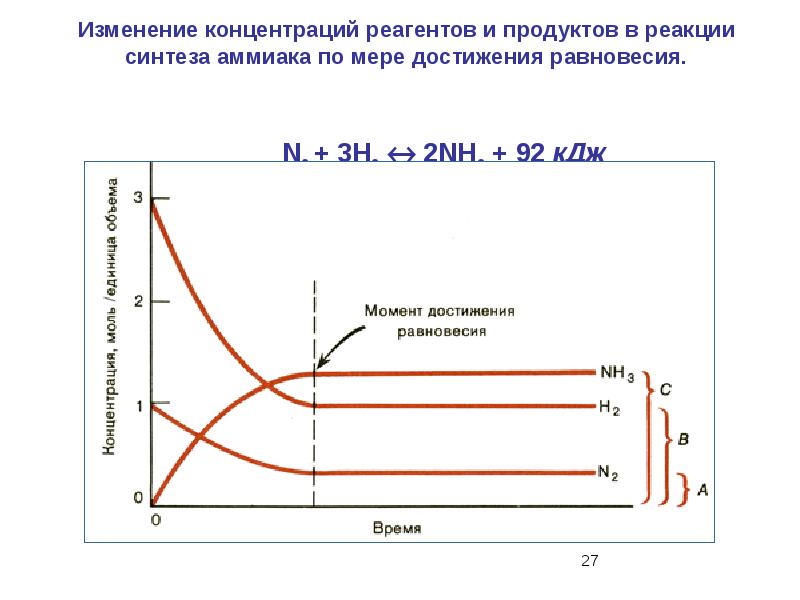
- 49. 14. В реагирующей системе, уравнение которой 2NO(г) + СI2(г) ↔ 2NOCI (г)
- 50. 15. Система, в которой повышение давления не вызовет смещения равновесия: 2NF3(г) +
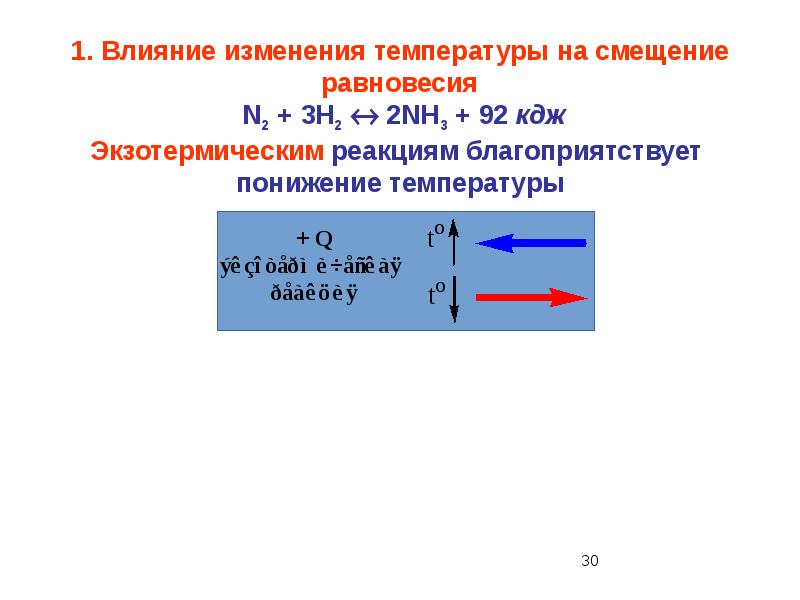
- 51. 16. Система, в которой повышение давления и повышение температуры приведут к смещению
- 52. 17. В реагирующей системе 2А + В ↔С + 2D исходная
- 53. 18. В реагирующей системе ЗА +
- 54. 19. В реагирующей системе A +
- 55. 20. В системе 20. В системе Н2 + Вr2 ↔ 2
- 57. Спасибо за внимание!
- 58. Скачать презентацию













































Слайды и текст этой презентации
Скачать презентацию на тему 1
Лекция 5
"Химическая кинетика и катализ
Смещение химического равновесия" можно ниже:
Похожие презентации





























