42. Соли угольной кислоты презентация
Содержание
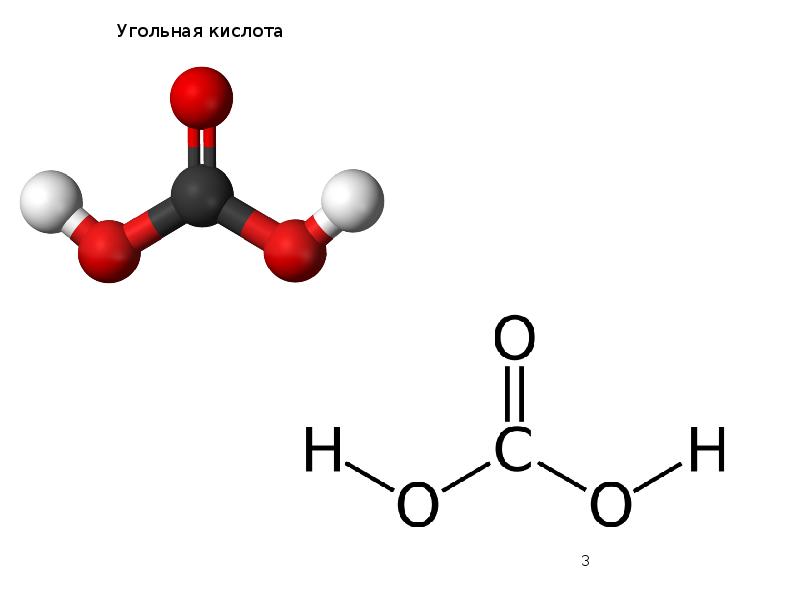
- 2. Угольная кислота Угольная кислота Н2СО3 – единственный гидрат диоксида углерода СО2.
- 3. Угольная кислота
- 4. Угольная кислота В растворах угольная кислота хорошо изучена; она проявляет лишь
- 5. Карбонаты Карбонаты Угольная кислота может образовывать два ряда солей: средние и
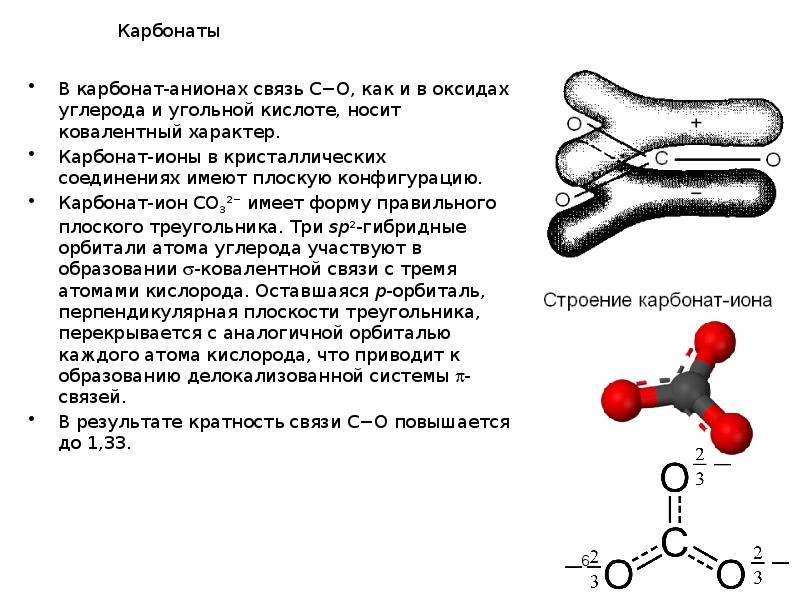
- 6. Карбонаты В карбонат-анионах связь С−О, как и в оксидах углерода и
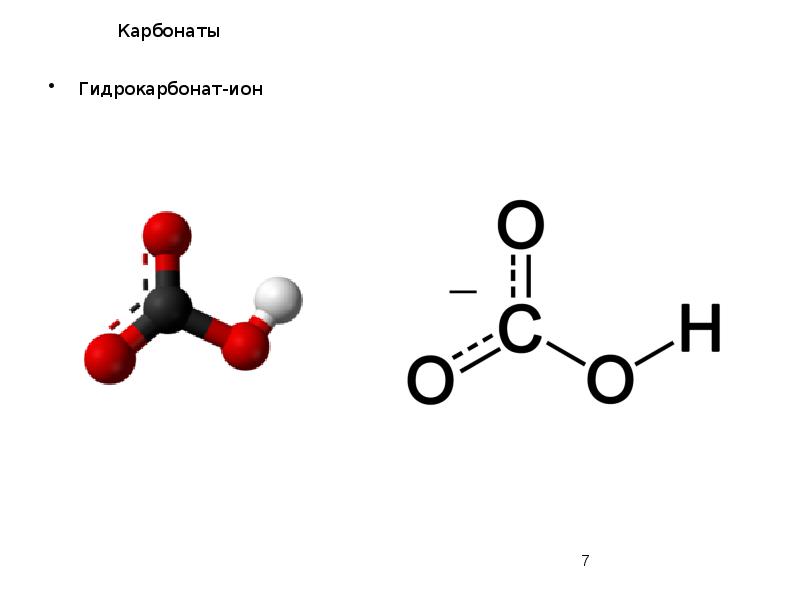
- 7. Карбонаты Гидрокарбонат-ион
- 8. Карбонаты Карбонат-ионы в водных средах подвергаются гидролизу. Средний карбонат натрия гидролизуется
- 9. Карбонаты
- 10. Карбонаты Карбонаты двухвалентных металлов трудно растворимы в воде, но их растворимость
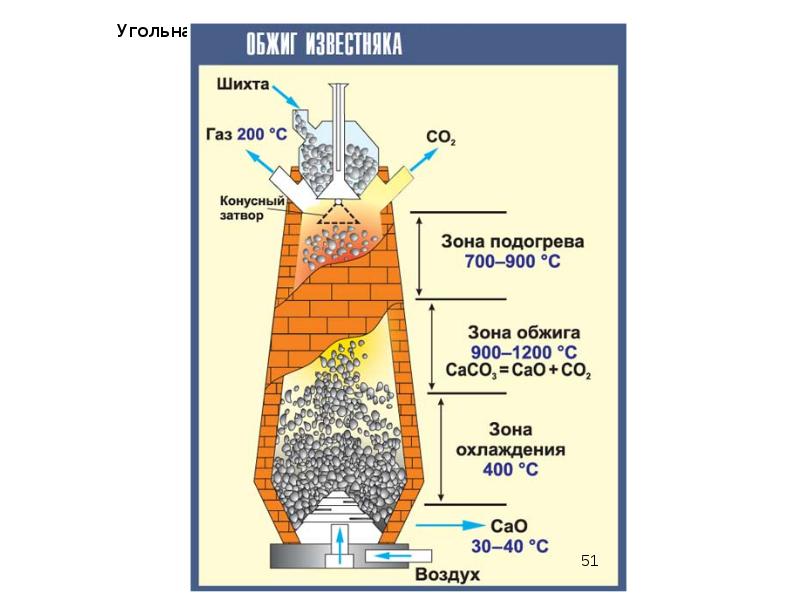
- 11. Карбонаты При нагревании карбонаты, как правило, разлагаются (CaCO3 = CaO +
- 12. Угольная кислота
- 13. Карбонаты Из карбонатов щелочных металлов термически неустойчивы карбонаты лития и цезия,
- 14. Карбонаты Прокаливание карбонатов с восстановителями приводит к образованию оксидов и свободных
- 15. Карбонаты Нормальные и кислые карбонаты разлагаются более сильными (или менее летучими)
- 16. Карбонаты
- 17. Карбонаты В результате реакций обмена карбонаты щелочных металлов могут осаждать малорастворимые
- 18. Карбонаты
- 19. Карбонаты
- 20. Карбонаты
- 21. Карбонаты
- 22. Карбонаты Кроме средних и кислых карбонатов известны основные карбонаты, которые образуются
- 23. Карбонаты Наиболее практически важным для карбонатов, получаемых в промышленном масштабе, является
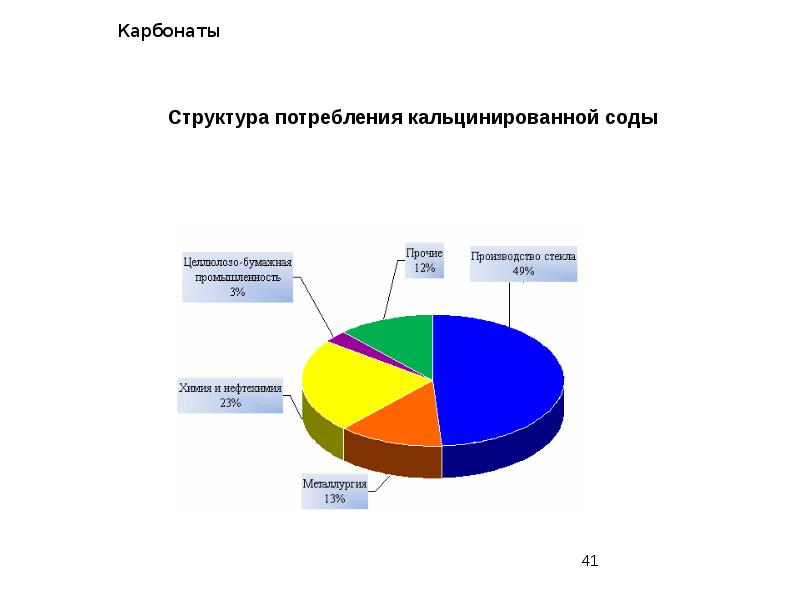
- 24. Карбонаты Сода Кальцинированная сода — карбонат натрия Na2CO3 (КАЛЬЦИНАЦИЯ – прокаливание, накаливание,
- 25. Карбонаты В природе сода встречается в виде минералов: трона Na2CO3·NaHCO3·2H2O, сода
- 26. Карбонаты Сода кристаллизуется в моноклинной системе, образует белые зернистые или порошковые
- 27. Карбонаты
- 28. Карбонаты
- 29. Карбонаты Безводный Na2CO3 – бесцветный кристаллический порошок; плотность 2,53 г/см3 при
- 30. Карбонаты Промышленное производство соды Русский академик Лаксман уже в 1764 г.
- 31. Карбонаты Петр I сообщал князю Д. Голицыну, отвечая на его вопрос,
- 32. Карбонаты В 1791 г. французский химик-технолог Николя Леблан, ничего не зная
- 33. Карбонаты Производство соды по методу Леблана 1791 г. во Франции состояло
- 34. Карбонаты
- 35. Карбонаты Аммиачный метод производства соды – карбоната натрия Na2CО3 – был
- 36. Карбонаты Бельгийский инженер-химик, член Парижской академии наук Эрнст-Гастон Сольве (1838-1922) только
- 37. Карбонаты Способ получения соды по Сольве основан на реакциях, идущих в
- 38. Карбонаты Аммиак возвращается в производство. Все реакции идут при невысоких температурах.
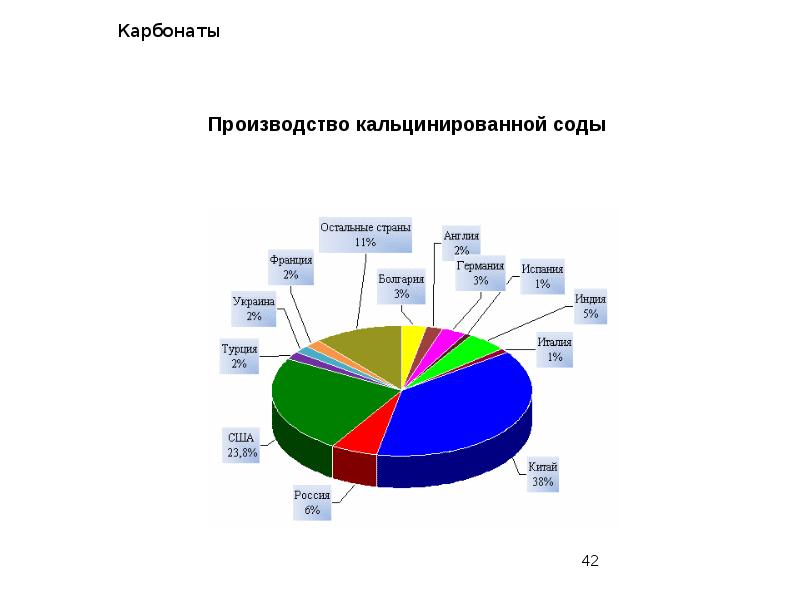
- 39. Карбонаты Производство соды в наши дни осуществляется четырьмя способами: аммиачным (из
- 40. Карбонаты Производство кальцинированной соды из природного сырья – отрасль сравнительно новая,
- 41. Карбонаты
- 42. Карбонаты
- 43. Карбонаты Сода – один из важнейших продуктов химической промышленности. В больших
- 44. Карбонаты Среди карбонатов других катионов несколько особняком стоят производные угольной кислоты
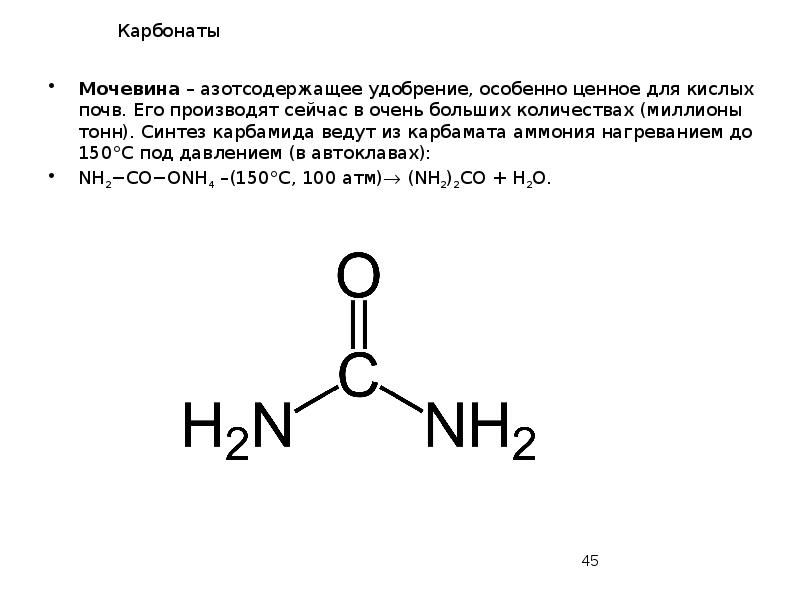
- 45. Карбонаты Мочевина – азотсодержащее удобрение, особенно ценное для кислых почв. Его
- 46. Карбонаты Промышленное применение известняка Известняк – самая распространенная форма карбоната кальция,
- 47. Карбонаты Промышленное применение известняка Известь используется также в качестве смазочного материала
- 48. Карбонаты Промышленное применение известняка Еще одно применение – нейтрализация кислотных растворов
- 49. Карбонаты Промышленное применение известняка Производство высококачественной бумаги требует широкого использования специально
- 50. Карбонаты Промышленное применение известняка В быту и фармацевтической промышленности осажденный СаСO3
- 51. Угольная кислота
- 52. Карбонаты
- 53. Карбонаты Карбонат кальция Нахождение в природе Карбонат кальция находится в минералах
- 54. Карбонаты (минералы)
- 55. Карбонаты (минералы)
- 56. Карбонаты (минералы)
- 57. Карбонаты (минералы)
- 58. Карбонаты (минералы)
- 59. Карбонаты (минералы)
- 60. Карбонаты (минералы)
- 61. Карбонаты (минералы)
- 62. Карбонаты (минералы)
- 63. Карбонаты (минералы)
- 64. Карбонаты (минералы)
- 65. Карбонаты (минералы)
- 66. Карбонаты (минералы)
- 67. Карбонаты (минералы)
- 68. Карбонаты (минералы)
- 69. Карбонаты (минералы)
- 70. Карбонаты (минералы)
- 71. Карбонаты (минералы)
- 72. Карбонаты (минералы)
- 73. Карбонаты (минералы)
- 74. Карбонаты (минералы)
- 75. Карбонаты (минералы)
- 76. Карбонаты (минералы)
- 77. Карбонаты (минералы)
- 78. Карбонаты (минералы)
- 79. Скачать презентацию







































































Слайды и текст этой презентации
Похожие презентации





























