Химическая термодинамика презентация
Содержание
- 2. В более узком понимании термодинамика изучает общие термические свойства веществ при
- 3. В более узком понимании термодинамика изучает общие термические свойства веществ при
- 4. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 1 Термодинамическая система – это тело или
- 5. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 2 Гомогенная система – система, внутри которой
- 6. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 3 В общем случае, если в системе
- 7. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 4 Совокупность всех физических и химических свойств
- 8. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 5 Всякое изменение термодинамического состояния системы (изменения хотя
- 9. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 6 Энергия – мера способности системы
- 10. Внутренняя энергия – это функция состояния системы, т.е. её изменение не
- 11. Теплота – переход энергии за счет хаотического столкновения молекул двух соприкасающихся
- 12. Законы термодинамики Законы термодинамики сформулированы на основе экспериментальных данных и поэтому
- 13. 1-й закон термодинамики Представляет собой обобщённый закон сохранения энергии для термодинамических
- 14. Формулировки 1 начала Согласно этому закону, во всех таких преобразованиях энергия
- 15. Понятие Механический эквивалент теплоты возникло в связи с тем, что исторически
- 16. Герман Иванович Гесс Российский химик, академик Петербургской Академии наук. Родился
- 17. Закон Гесса открыт в 1840 г., Закон является частным случаем
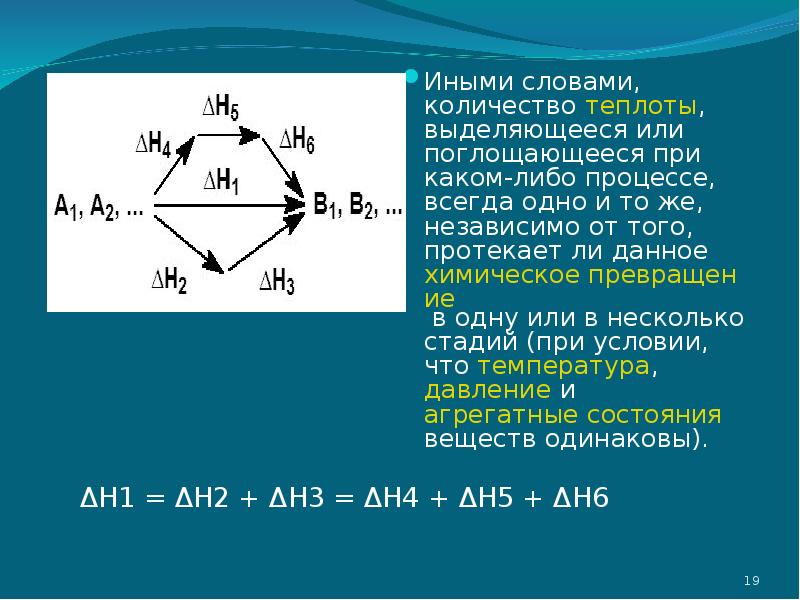
- 18. Закон Гесса формулируется следующим образом: Закон Гесса формулируется следующим образом: Тепловой
- 19. Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда
- 20. Работы Гесса являются фундаментом термохимии Термохимические уравнения Уравнения химических реакций, в
- 22. Следствия из закона Гесса Тепловой эффект прямой реакции равен по
- 23. Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно
- 24. Стандартная теплота образования Из закона сохранения энергии следует, что, когда вещество
- 25. Пример расчета теплового эффекта реакции Реакция образования вторичного муллита при обжиге
- 26. Тепловой эффект реакции по прямому пути: Тепловой эффект реакции по прямому
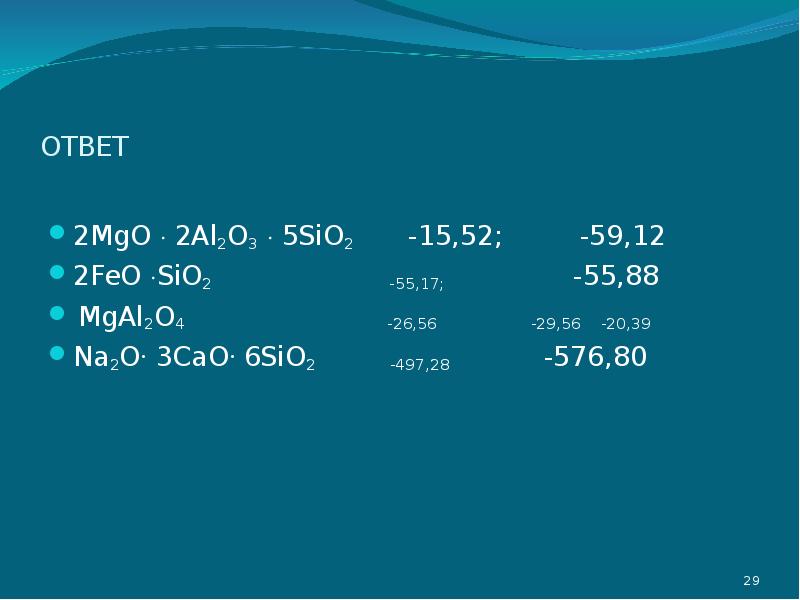
- 27. Задание для самостоятельной работы Рассчитать теплоту образования следующих силикатных соединений, пользуясь
- 28. Задание для самостоятельной работы Рассчитать теплоту образования следующих силикатных соединений, пользуясь
- 29. ОТВЕТ 2MgO 2Al2O3 5SiO2 -15,52;
- 30. Скачать презентацию



























Слайды и текст этой презентации
Похожие презентации





























