Химическая кинетика презентация
Содержание
- 7. Основные факторы, влияющие на скорость реакции A + 2B → C
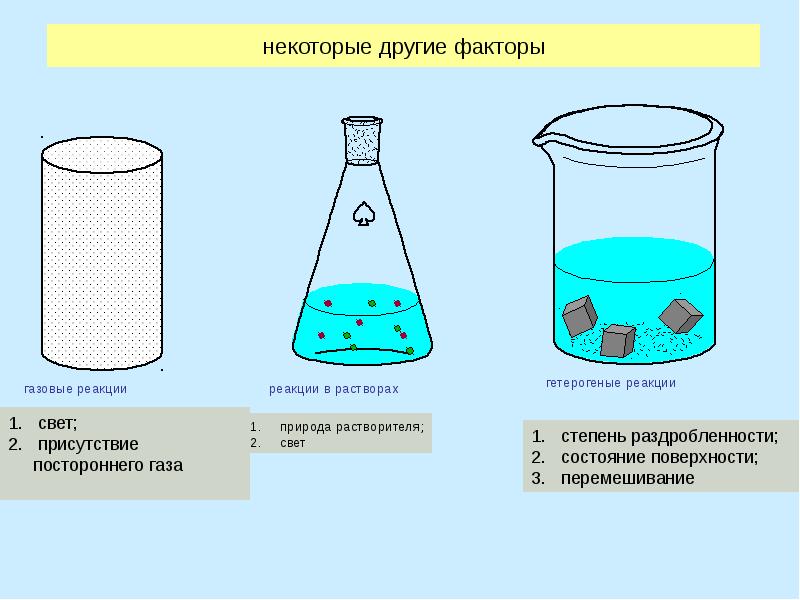
- 8. некоторые другие факторы
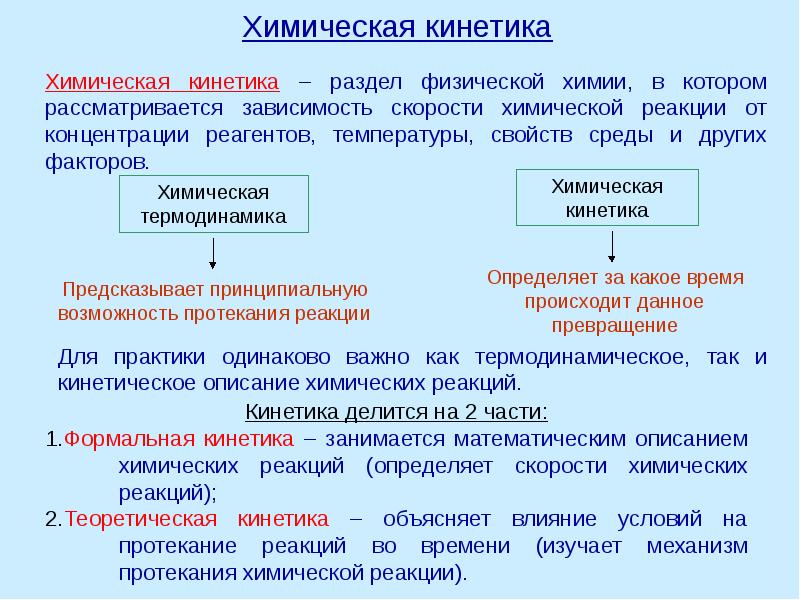
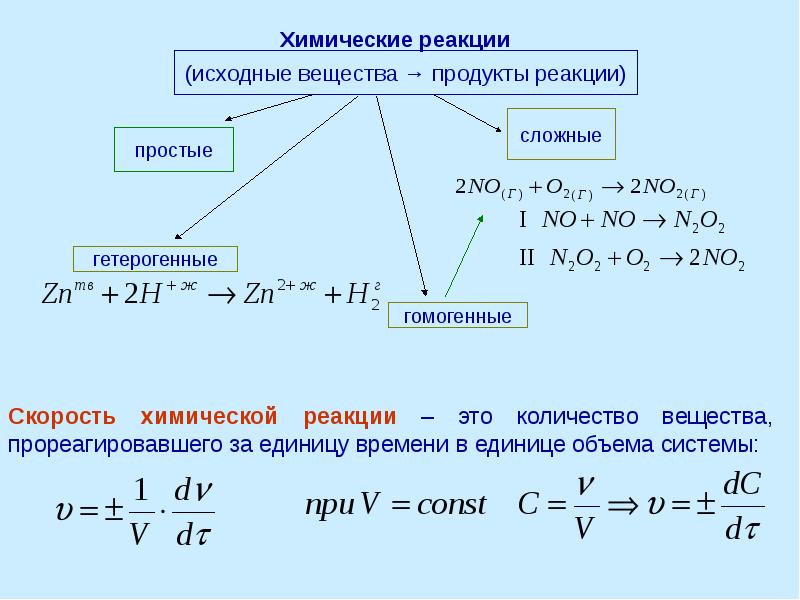
- 9. Классификация химических реакций (по молекулярности и порядку)
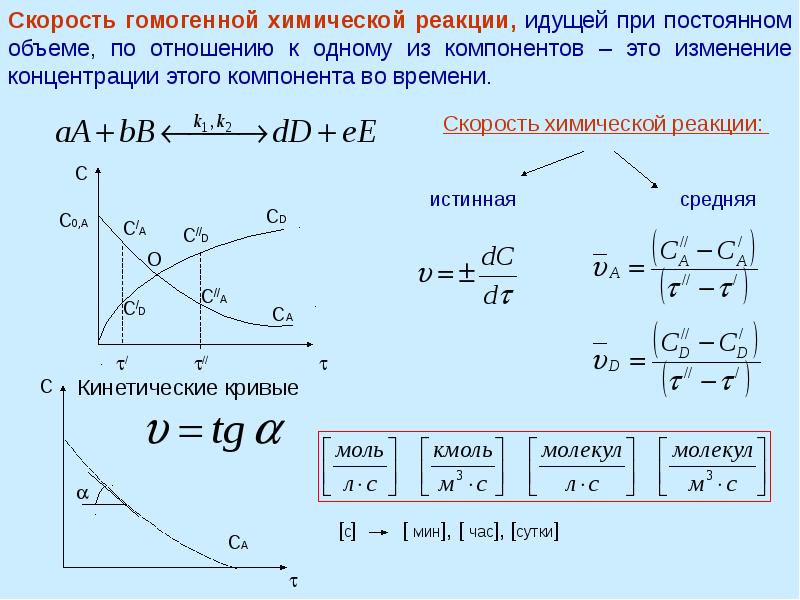
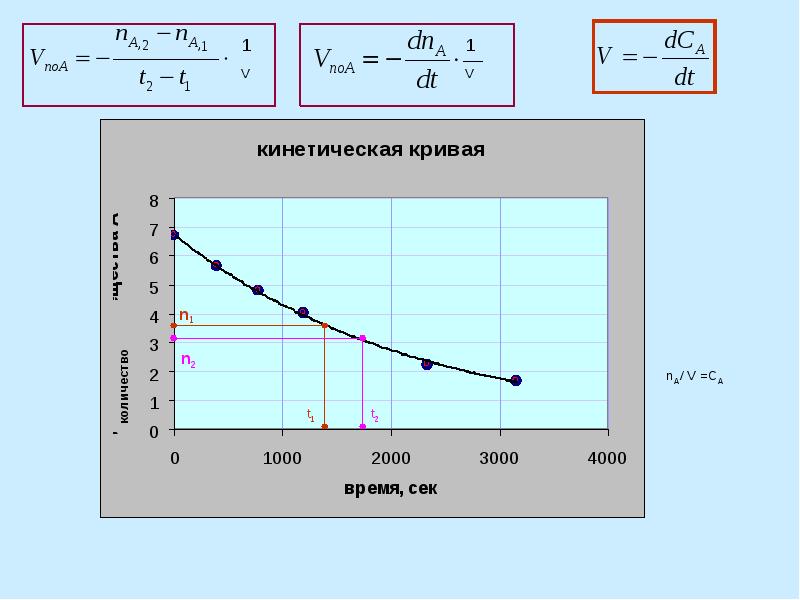
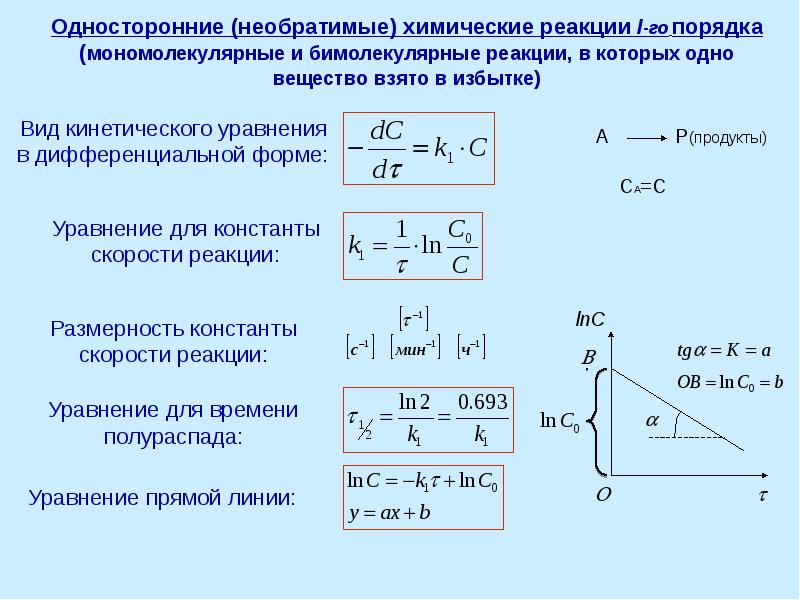
- 13. Односторонние (необратимые) химические реакции I-го порядка (мономолекулярные и бимолекулярные реакции, в
- 15. Односторонние (необратимые) химические реакции II -го порядка
- 20. 1.Метод подстановки – экспериментальные данные подставляются в уравнение для К определённого
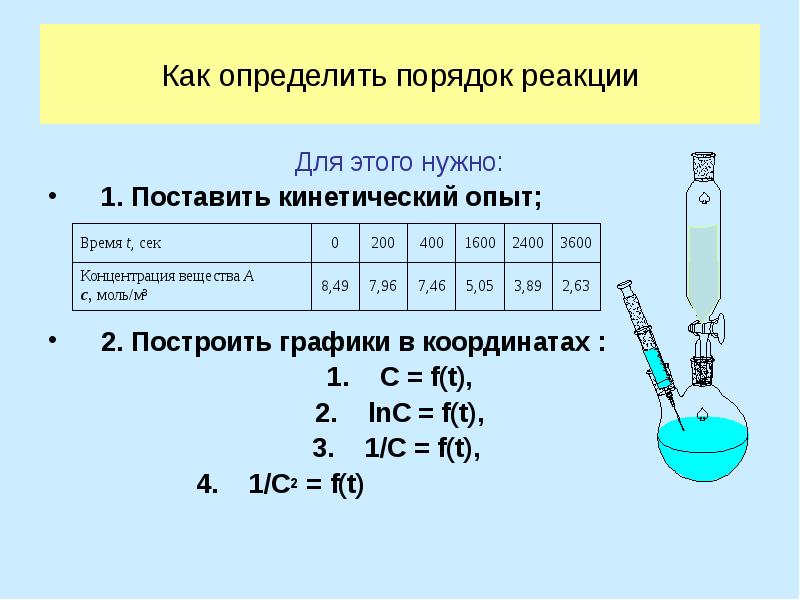
- 22. Как определить порядок реакции Для этого нужно: 1. Поставить кинетический опыт;
- 24. Скачать презентацию















Слайды и текст этой презентации
Похожие презентации





























