Строение атома презентация
Содержание
- 2. Явления, свидетельствующие о сложной структуре атома. Слово
- 3. Модель атома Томсона В 1903г. Английский физик
- 4. Опыт Э. Резерфорда по рассеянию альфа – частиц
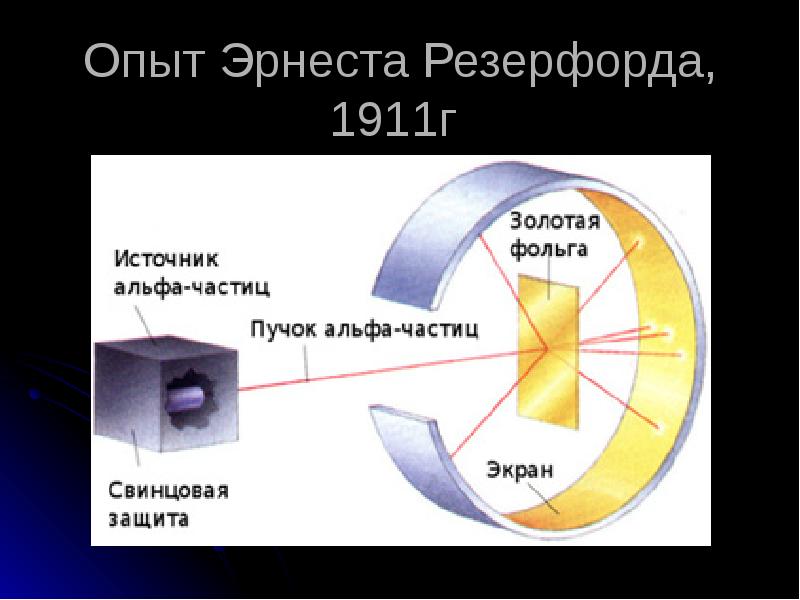
- 5. Опыт Эрнеста Резерфорда, 1911г
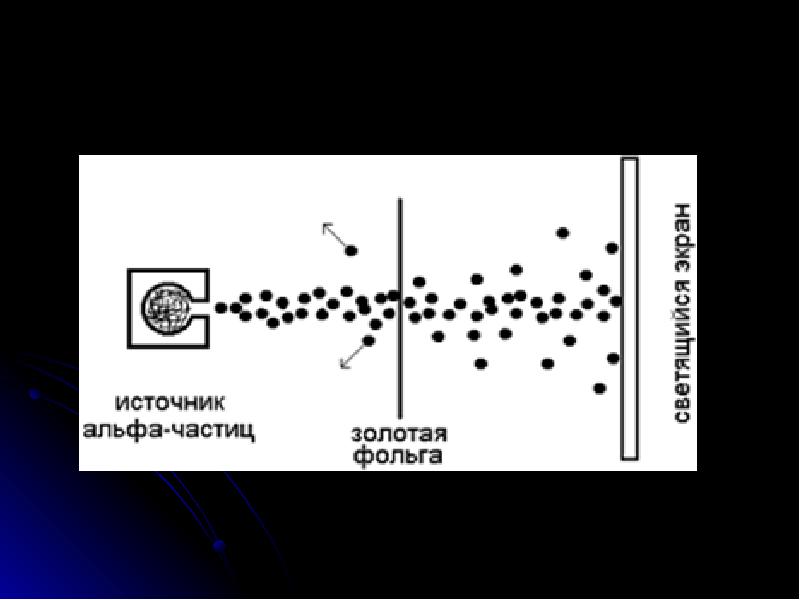
- 7. Результаты опытов
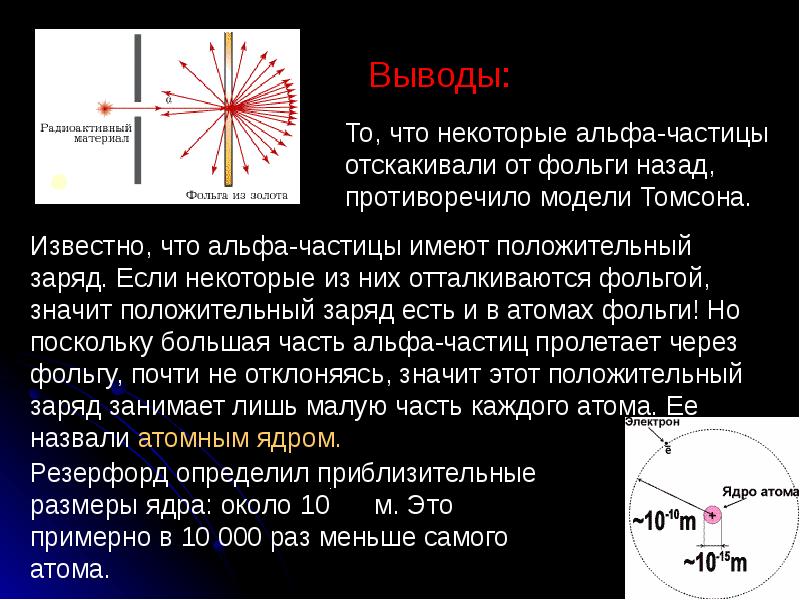
- 8. Выводы:
- 9. Ядерная (планетарная) модель атома Резерфода
- 10. Объяснение результатов опыта Резерфорда на основе ядерной модели атома.
- 11. Планетарная модель строения атома
- 12. Лирическое отступление
- 13. Чего не сумел объяснить Резерфорд Резерфорд доказал, что электроны обращаются
- 14. Первый постулат Бора Выход из создавшегося противоречия между теоретическими расчетами и
- 15. Нильс Бор ( 1885 – 1962 )
- 16. Второй постулат Бора Электрон может переходить с одной стационарной орбиты на
- 17. Модель атома водорода по Бору. Свои постулаты Бор применил для построения
- 18. Все частоты излучений атома водорода составляют ряд серий, каждая из которых
- 19. Поглощение света Поглощение света – процесс, обратный излучению. Атом, излучая свет,
- 20. Трудности теории Бора Теория Бора не была логически последовательной. На ее
- 21. Значение теории Бора Теория Бора – это первая квантовая теория строения
- 23. 1. Свойства ядерных сил Сил, действующие между нуклонами в ядре. 1)
- 24. 2. Радиоактивность 1) 1896 г. Анри Беккерель, самопроизвольное испускание лучей солями
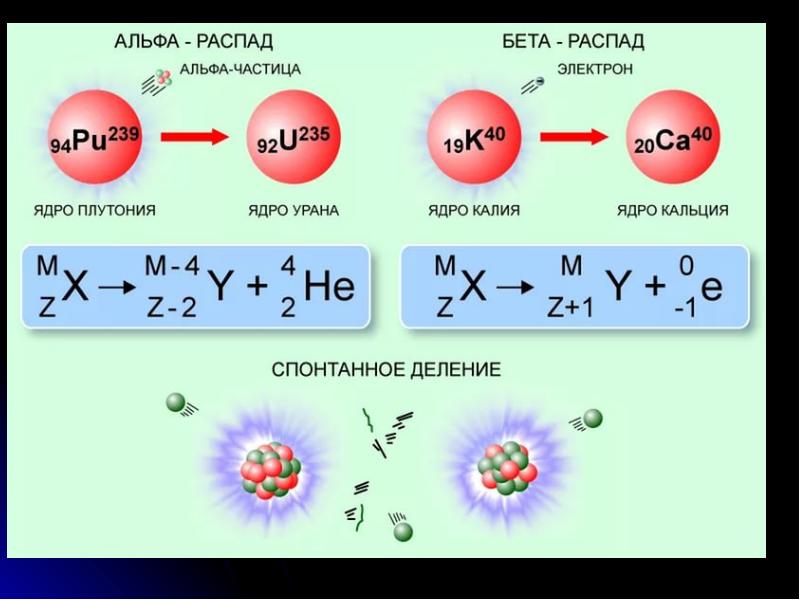
- 25. 3. Радиоактивные превращения 1) α-распад. α-частица – ядро атома гелия 24Не.
- 27. Закон сохранения массового числа и заряда Сумма массовых чисел до распада,
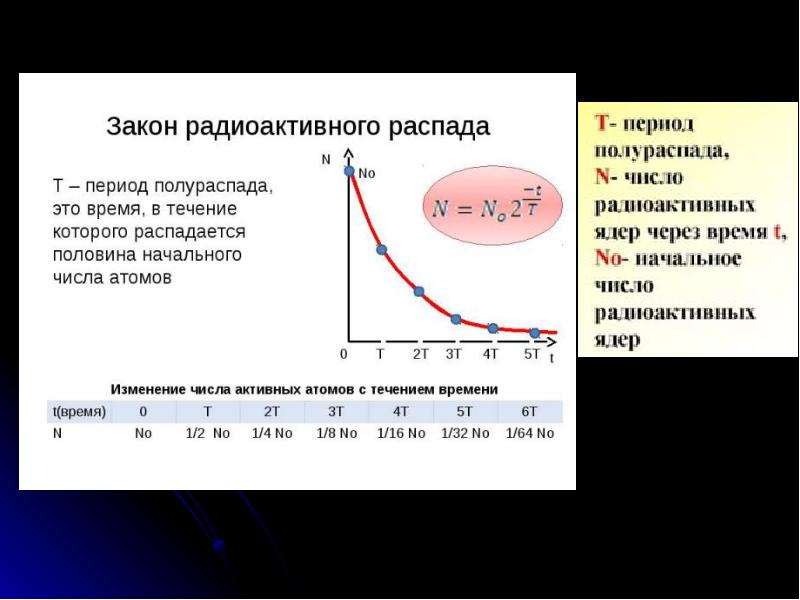
- 28. Закон радиоактивного распада 1) Период полураспада – промежуток времени, в течение
- 30. Скачать презентацию
























Слайды и текст этой презентации
Похожие презентации





























