Элементы физической кинетики презентация
Содержание
- 3. Тема 3. ЭЛЕМЕНТЫ ФИЗИЧЕСКОЙ КИНЕТИКИ 3.1. Явления переноса в газах 3.2.
- 4. Под идеальным газом мы будем понимать газ, для которого: 1)
- 5. 1.3. Температура и средняя кинетическая энергия теплового движения молекул Из
- 6. Именно средняя кинетическая энергия атомов и молекул служит характеристикой системы в
- 7. Чтобы связать энергию с температурой, Больцман ввел коэффициент пропор- циональности k,
- 8. Величину T называют абсолютной темпе-ратурой и измеряют в градусах Кельвина (К).
- 9. Тогда следовательно,
- 10. Так как температура определяется средней энергией движения молекул, то она, как
- 11. Основное уравнение молекулярно-кинетической теории можно записать по другому. Так как
- 12. В физике и технике за абсолютную шкалу температур принята шкала Кельвина,
- 13. 3.1. Явления переноса в газах Из прошлых лекций мы знаем,
- 14. Рассмотрим некоторые явления, происходящие в газах. Распространение молекул примеси в газе
- 15. Связанный с этим движением перенос вещества обусловлен диффузией. Диффузионный поток будет
- 16. Если какое либо тело движется в газе, то оно сталкивается с
- 17. Это явление носит название внутреннее трение или вязкость газа, причём сила
- 18. Если в соседних слоях газа создана и поддерживается разность температур, то
- 19. называется теплопроводностью. Поток тепла пропорционален градиенту температуры:
- 20. В состоянии равновесия в среде, содержащей заряженные частицы, потенциал электрического поля
- 21. Связанный с этим движением перенос электрического заряда называется электропроводностью, а само
- 22. В процессе диффузии, при тепло и электропроводности происходит перенос вещества, а
- 23. 3.2. Число столкновений и средняя длина свободного пробега молекул в газах
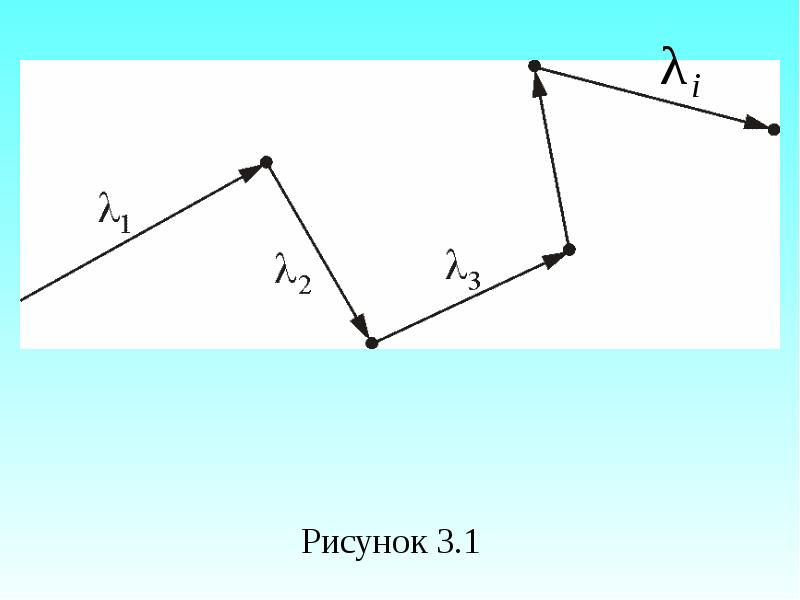
- 24. Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного
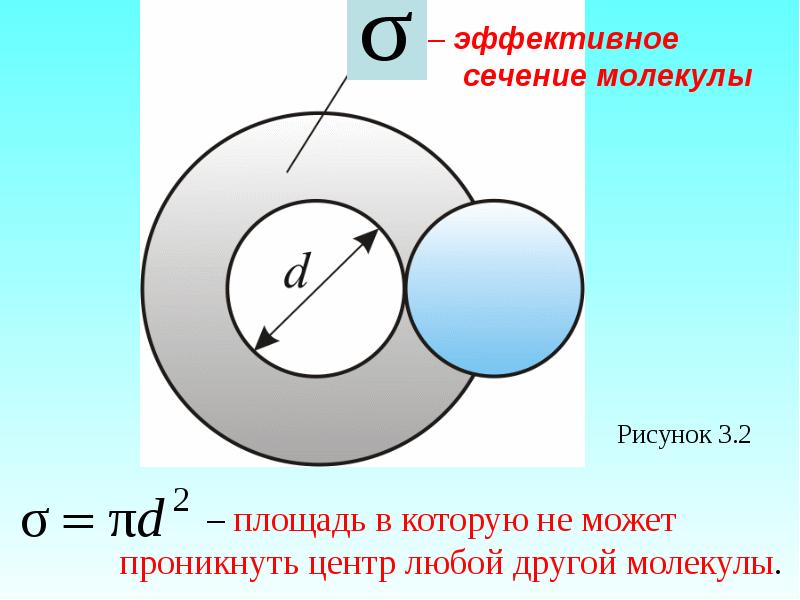
- 26. Модель идеального газа – твёрдые шарики одного диаметра, взаимодействую-щие между собой
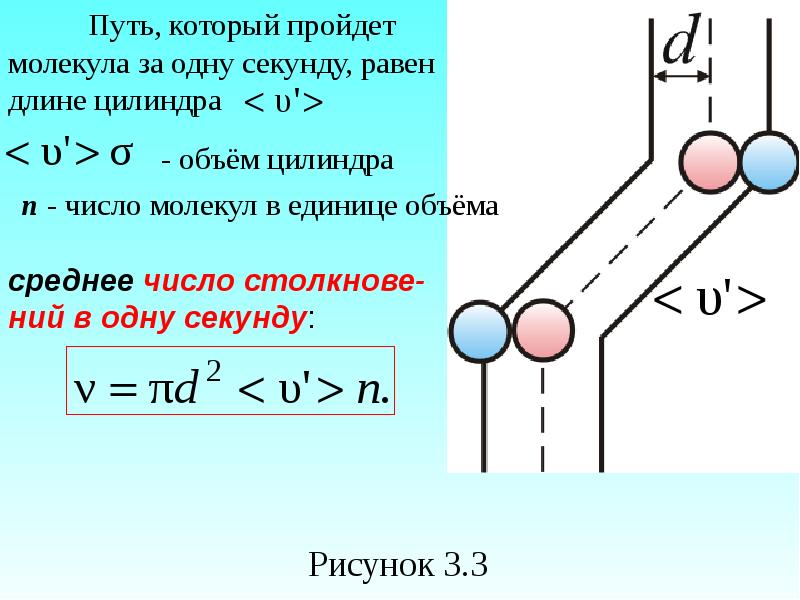
- 28. За одну секунду молекула проходит путь, равный средней арифметической скорости
- 29. Подсчитаем число столкновений ν. Вероятность столкновения трех и более молекул бесконечно
- 31. На самом деле, все молекулы движутся (и в сторону и навстречу
- 32. Из уравнения состояния идеального газа выразим n через давление P и
- 33. Таким образом, при заданной температуре, средняя длина свободного пробега обратно пропорциональна
- 34. 3.3. Диффузия газов Диффузия от латинского diffusio –
- 35. Диффузия имеет место в газах, жидкостях и твердых телах. Наиболее быстро
- 36. Обозначим: – коэффициент диффузии. Тогда
- 37. Из уравнения Фика видно, что диффузионный поток, направлен в сторону уменьшения
- 38. Молекулы участвуют в тепловом движении, они будут переходить из слоя в
- 39. Сила, действующая на единицу площади поверхности, разделяющей два соседних слоя газа:
- 40. Физический смысл коэффициента вязкости η в том, что он численно равен
- 41. 3.5. Теплопроводность газов Учение о теплопроводности начало развиваться в XVIII в.
- 42. или
- 43. υТ – тепловая скорость молекул; – удельная
- 44. 3.6. Уравнения и коэффициенты переноса Сопоставим уравнения переноса
- 46. или
- 47. Все эти законы были установлены опытно, задолго до обоснования молекулярно-кинетической теорией.
- 48. Однако к концу XIX века, несмотря на блестящие успехи молекулярно-кинетической теории
- 49. Но это конечно не так. Все выше указанные коэффициенты связаны между
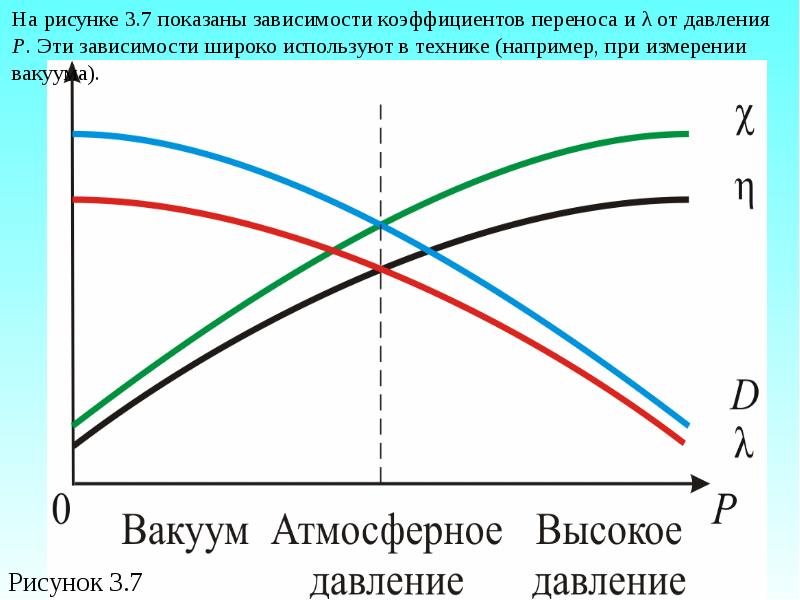
- 50. Зависимость коэффициентов переноса от давления Р Так как скорость теплового
- 51. С ростом давления λ уменьшается и затрудняется диффузия (
- 53. Молекулярное течение. Эффузия газов Молекулярное течение – течение
- 54. В вакууме происходит передача импульса непосредственно стенкам сосуда, то есть, происходит
- 55. Как при молекулярном течении, так и при эффузии, количество протекающего в
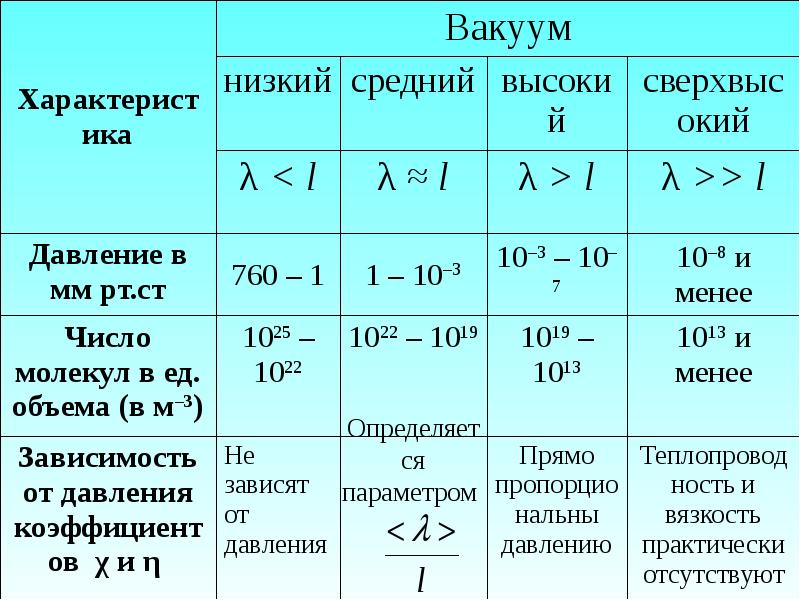
- 56. 3.7. Понятие о вакууме Газ называется разреженным, если его плотность
- 57. Плотный воздух Плотный воздух
- 58. Свойства разряженных газов отличаются от свойств неразряженных газов. Это видно из
- 60. Если из сосуда откачивать газ, то по мере понижения давления число
- 61. Вопросы создания вакуума имеют большое значение в технике, так как например,
- 63. Скачать презентацию
























































Слайды и текст этой презентации
Похожие презентации





























