Первое начало термодинамики презентация
Содержание
- 2. 1. Внутренняя энергия. Работа и теплота 1. Внутренняя энергия. Работа
- 8. Закон сохранения энергии для малого изменения состояния системы будет иметь вид:
- 10. Теплота Q и работа А зависят от того, каким образом совершен
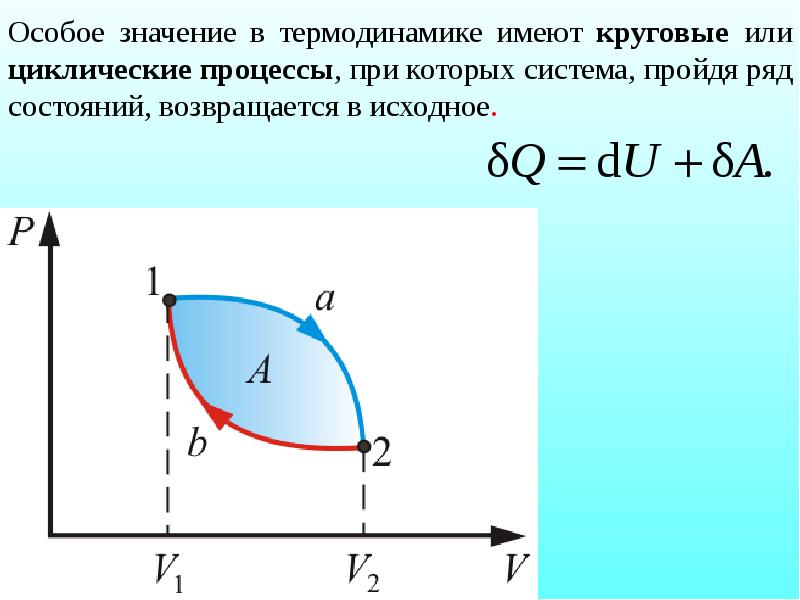
- 11. Особое значение в термодинамике имеют круговые или циклические процессы, при которых
- 13. 2. Теплоёмкость идеального газа 2. Теплоёмкость идеального газа
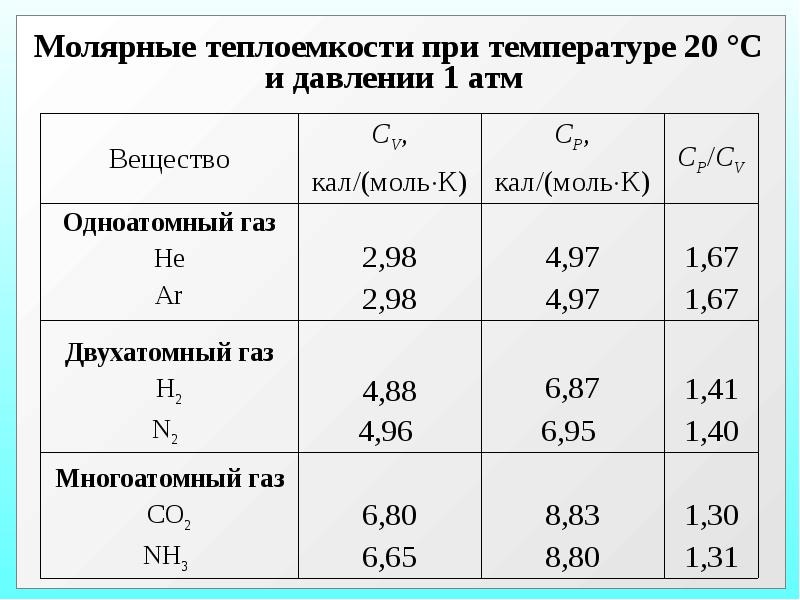
- 14. Удельная теплоёмкость Суд – количество теплоты, необходимое для нагревания единицы массы
- 15. Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при
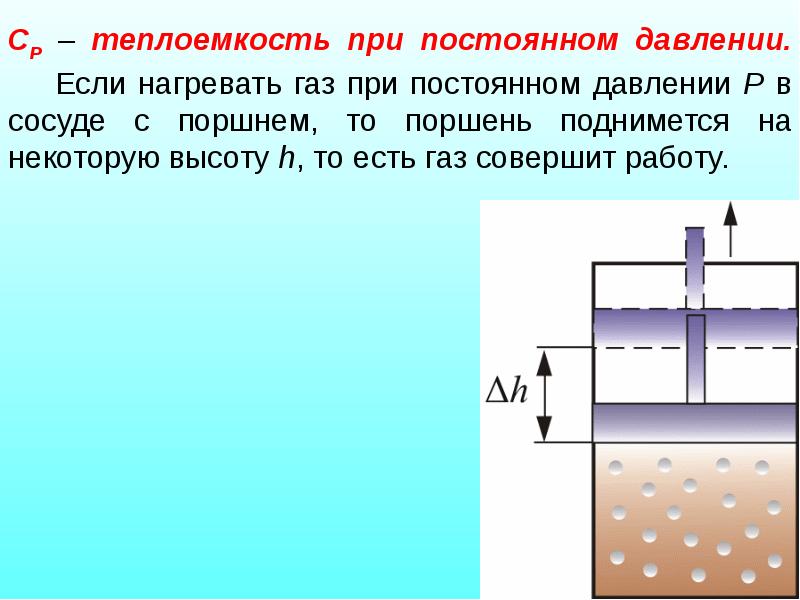
- 16. СР – теплоемкость при постоянном давлении. Если нагревать газ при
- 17. Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы.
- 18. Пусть мы нагреваем один моль идеального газа при постоянном объёме. Тогда,
- 19. В общем случае
- 20. Внутренняя энергия идеального газа является только функцией температуры (и не зависит
- 21. При изобарическом процессе кроме увеличения внутренней энергии происходит совершение работы газом:
- 22. Это уравнение Майера для одного моля газа. Из него следует, что
- 23. 3. Теплоёмкости одноатомных и многоатомных газов 3. Теплоёмкости одноатомных и многоатомных
- 24. - постоянная адиабаты (коэффициент Пуассона)
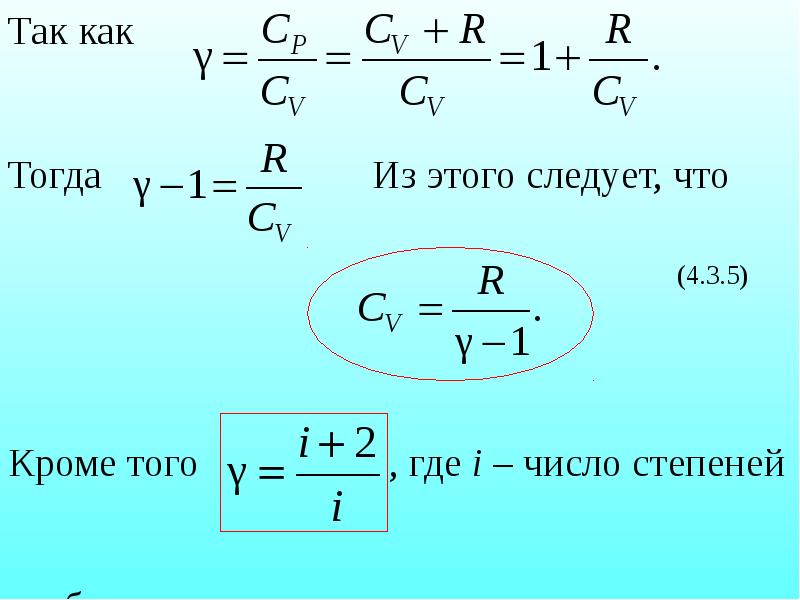
- 25. Так как Тогда Из
- 26. Подставив в выражение для внутренней энергии, получим: а так как
- 27. Опыты с двухатомными газами такими как азот, кислород и др. показали,
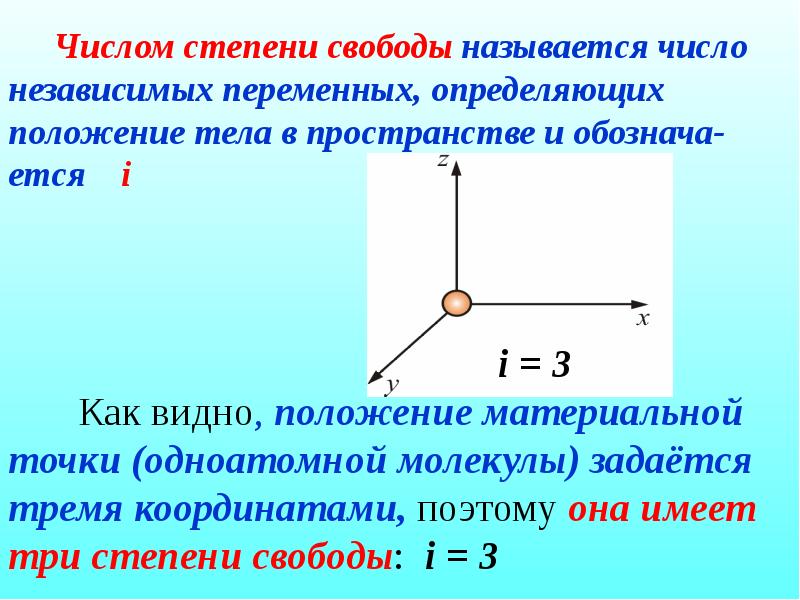
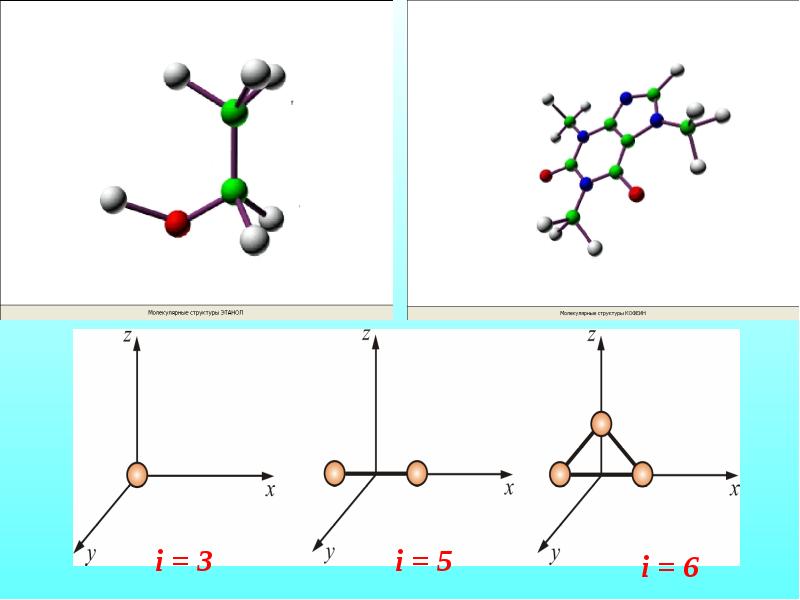
- 28. Числом степени свободы называется число независимых переменных, определяющих положение тела в
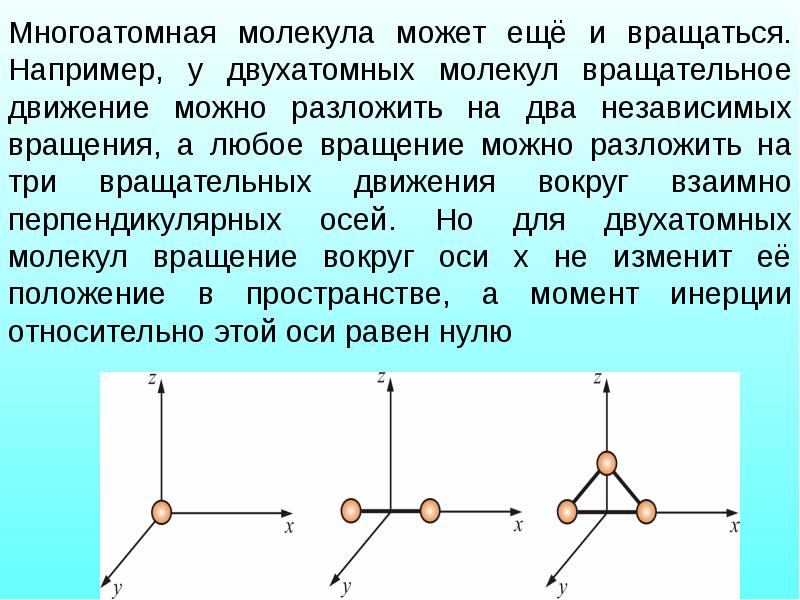
- 29. Многоатомная молекула может ещё и вращаться. Например, у двухатомных молекул вращательное
- 31. Для i степеней свободы i = iп + iвр + iкол
- 32. Для молярной теплоемкости Для удельной теплоемкости
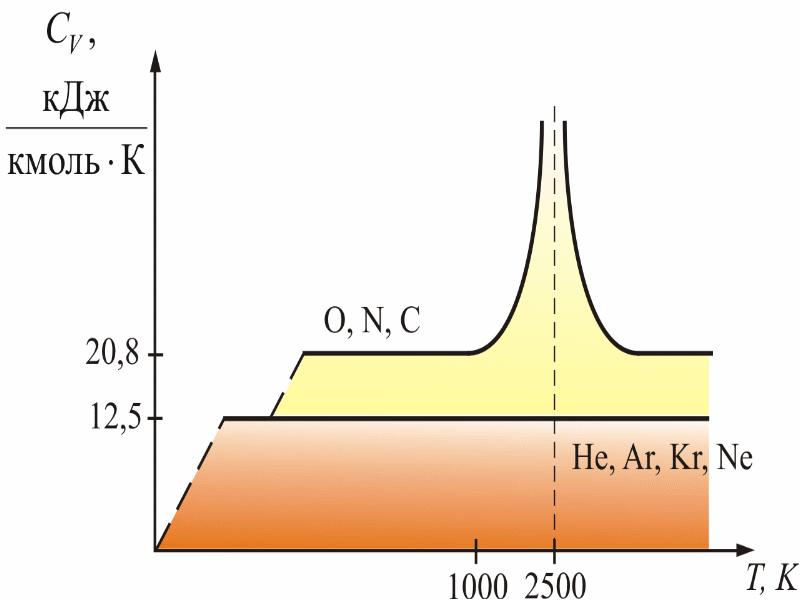
- 34. Для одноатомных газов это выполняется в очень широких пределах, а для
- 35. Одна колебательная степень свободы несет энергии, так как
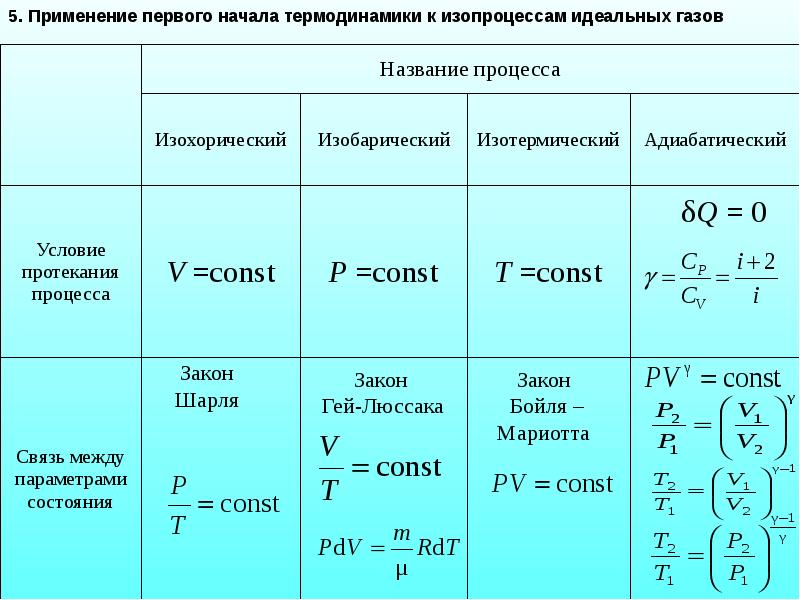
- 41. Политропный процесс – такой процесс, при котором изменяются все основные параметры
- 42. С помощью показателя n можно легко описать любой изопроцесс: 1. Изобарный
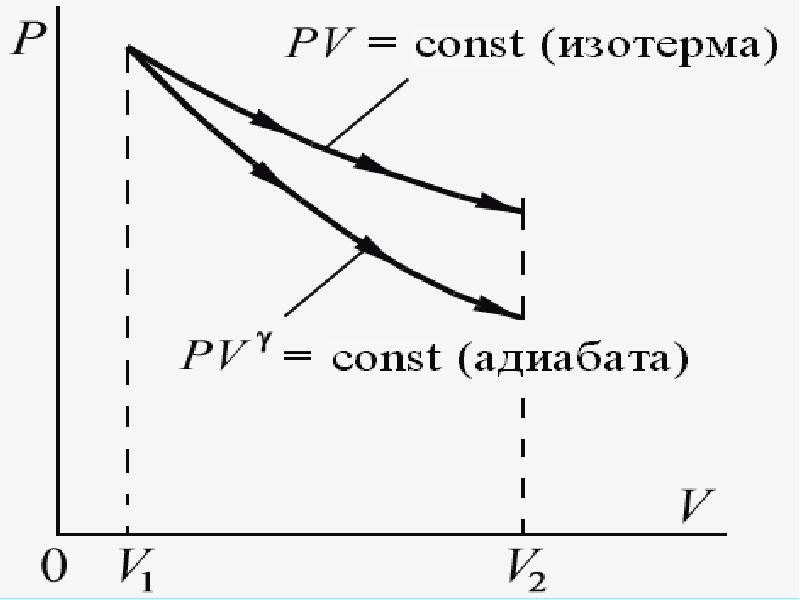
- 43. 4. Адиабатический процесс Q = 0, n = γ, Сад =
- 46. Скачать презентацию



































Слайды и текст этой презентации
Похожие презентации





























