Химическая термодинамика презентация
Содержание
- 2. 2. Химическая термодинамика 2.5. Термохимия 2.5.1. Тепловые эффекты реакций Химические реакции
- 3. 2. Химическая термодинамика 2.5. Термохимия Тепловым эффектом химической реакции называется количество
- 4. 2. Химическая термодинамика 2.5. Термохимия Физико-химические процессы протекают при постоянном объеме
- 5. 2. Химическая термодинамика 2.5. Термохимия Для реакций с участием идеальных газов,
- 6. 2. Химическая термодинамика 2.5. Термохимия Тепловые эффекты зависят от природы реагирующих
- 7. 2. Химическая термодинамика 2.5. Термохимия стандартная энтальпия/теплота реакции при
- 8. 2. Химическая термодинамика 2.5. Термохимия 2.5.2. Закон Гесса (1840 г.) Тепловой
- 9. 2. Химическая термодинамика 2.5. Термохимия Термохимическое уравнение - уравнение химической
- 10. 2. Химическая термодинамика 2.5. Термохимия Экзотермическая реакция – сопровождается выделением теплоты
- 11. 2. Химическая термодинамика 2.5. Термохимия Определение теплового эффекта реакций по закону
- 12. 2. Химическая термодинамика 2.5. Термохимия Следствия из закона Гесса: Следствие 1.
- 13. 2. Химическая термодинамика 2.5. Термохимия Зная тепловой эффект образования химического соединения
- 14. 2. Химическая термодинамика 2.5. Термохимия Иногда при вычислении теплот образования, теплот
- 15. 2. Химическая термодинамика 2.5. Термохимия 2.5.3. Калориметрия Калориметрия (лат. calor — тепло
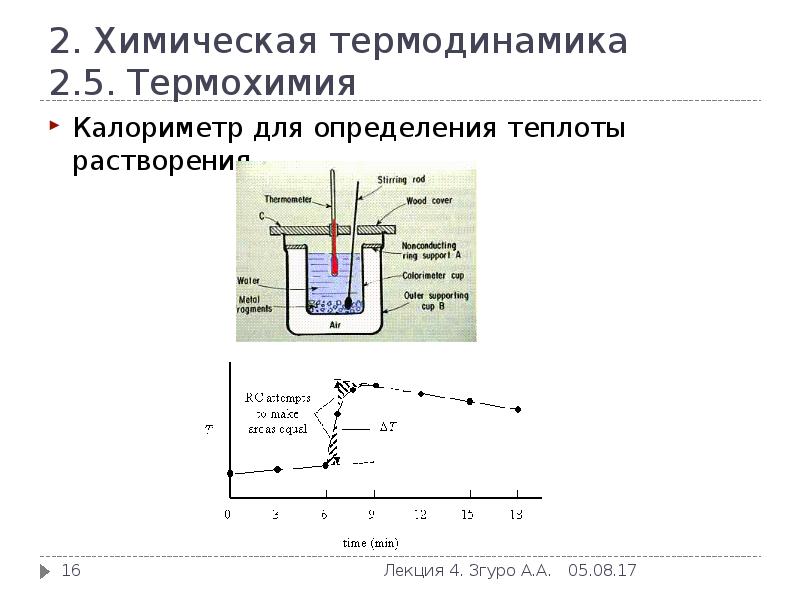
- 16. 2. Химическая термодинамика 2.5. Термохимия Калориметр для определения теплоты растворения
- 17. 2. Химическая термодинамика 2.5. Термохимия Калориметрическая бомба http://www.esru.strath.ac.uk/EandE/Web_sites/06-07/Biodiesel/Experiment/bombcalorimeter.gif
- 18. 2. Химическая термодинамика 2.5. Термохимия 2.5.4. Закон Лавуазье–Лапласа Является следствием
- 19. 2. Химическая термодинамика 2.5. Термохимия 2.5.5. Уравнение (закон) Кирхгофа Тепловой эффект
- 20. 2. Химическая термодинамика 2.5. Термохимия Закон Кирхгофа: Температурный коэффициент теплового эффекта
- 21. 2. Химическая термодинамика 2.5. Термохимия Для изобарных процессов (р=const):
- 22. 2. Химическая термодинамика 2.5. Термохимия Для изохорных процессов (V=const):
- 23. 2. Химическая термодинамика 2.5. Термохимия С помощью уравнения Кирхгофа можно
- 24. 2. Химическая термодинамика 2.5. Термохимия Если теплоемкость во время процесса не
- 25. Скачать презентацию























Слайды и текст этой презентации
Похожие презентации