Строение атома презентация
Содержание
- 2. Строение атома
- 3. Модель Томсона В 1904 году Томсон представил свою новую модель атома.
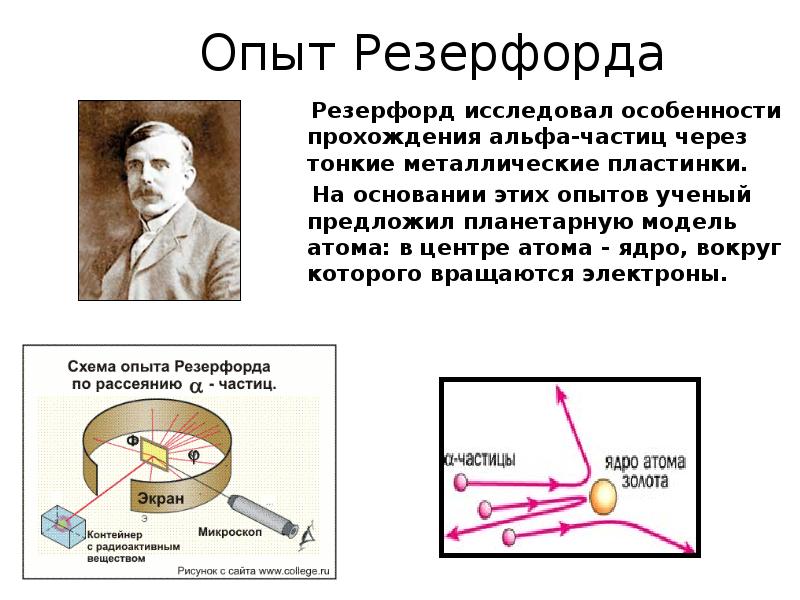
- 4. Опыт Резерфорда Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические
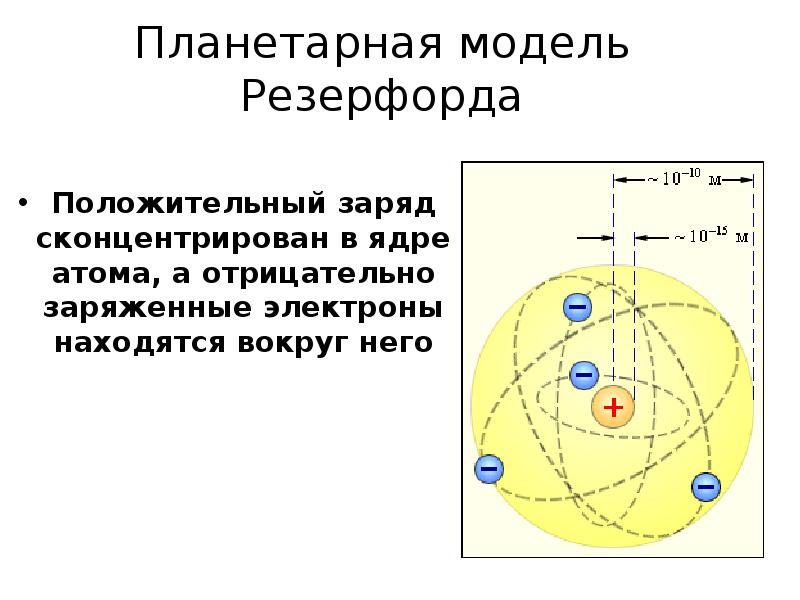
- 5. Планетарная модель Резерфорда Положительный заряд сконцентрирован в ядре атома, а отрицательно
- 7. Обсудим некоторые термины АТОМ - мельчайшая , химически неделимая, частица ОРБИТАЛИ
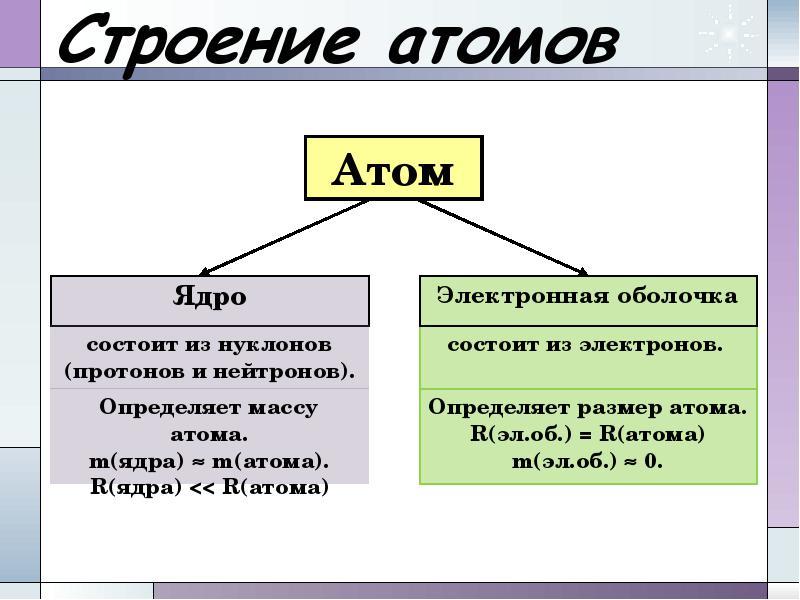
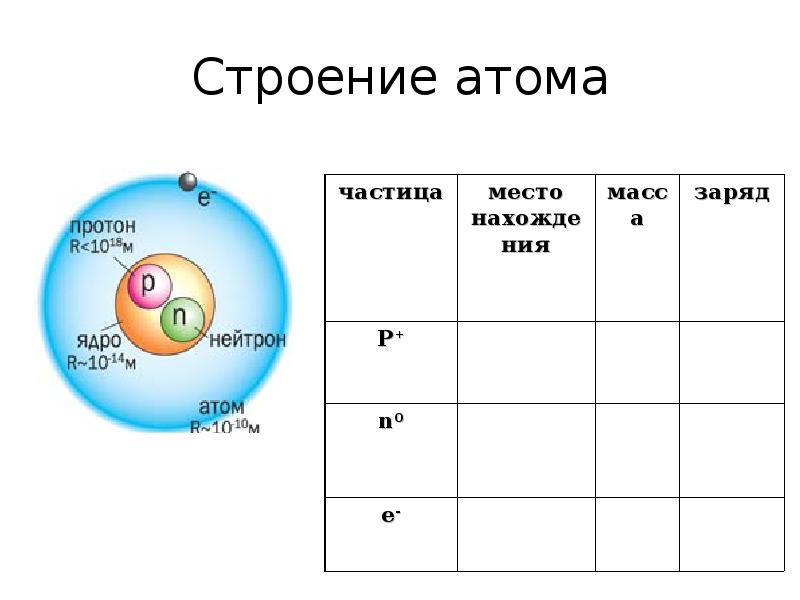
- 9. Строение атома
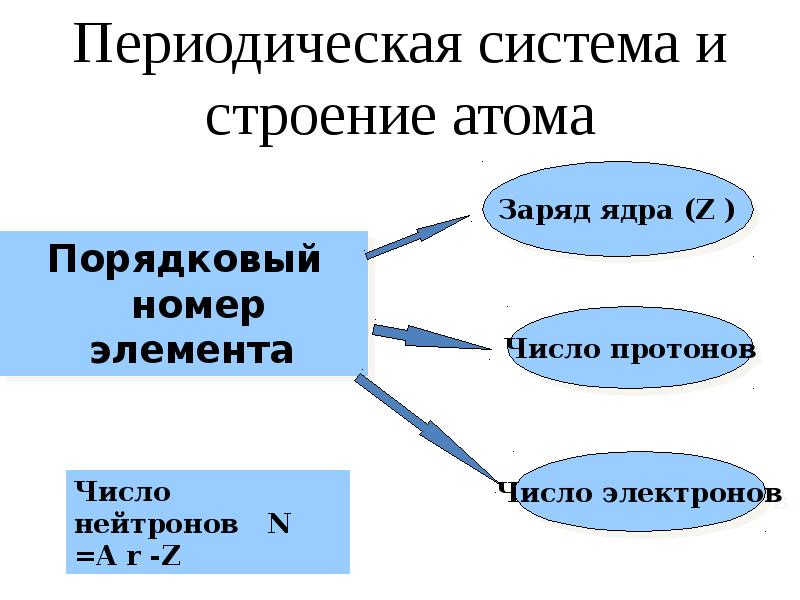
- 10. Периодическая система и строение атома Порядковый номер элемента
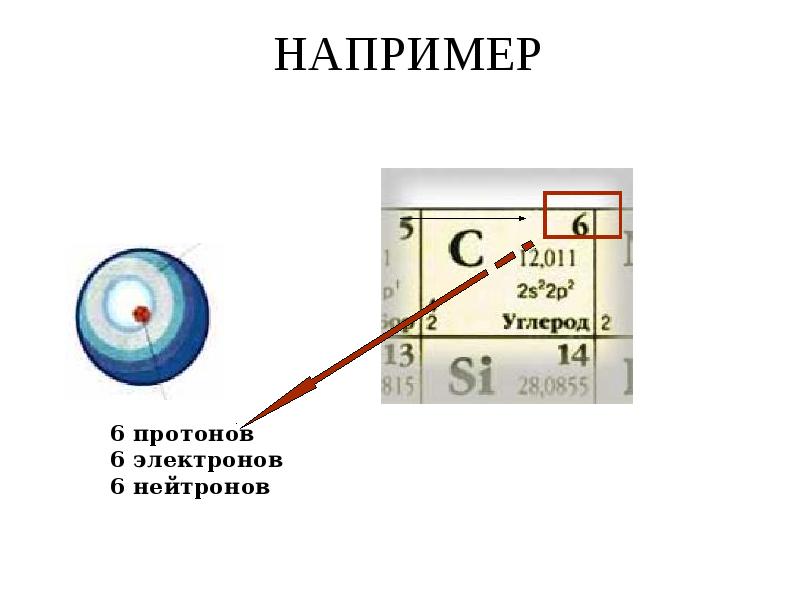
- 11. НАПРИМЕР
- 12. Изотопы ИЗОТОПЫ – это атомы одного химического элемента , имеющие одинаковое
- 13. Практическая часть Закончи определения АТОМ –это … ПЛАНЕТАРНАЯ МОДЕЛЬ –это… ОРБИТАЛЬ
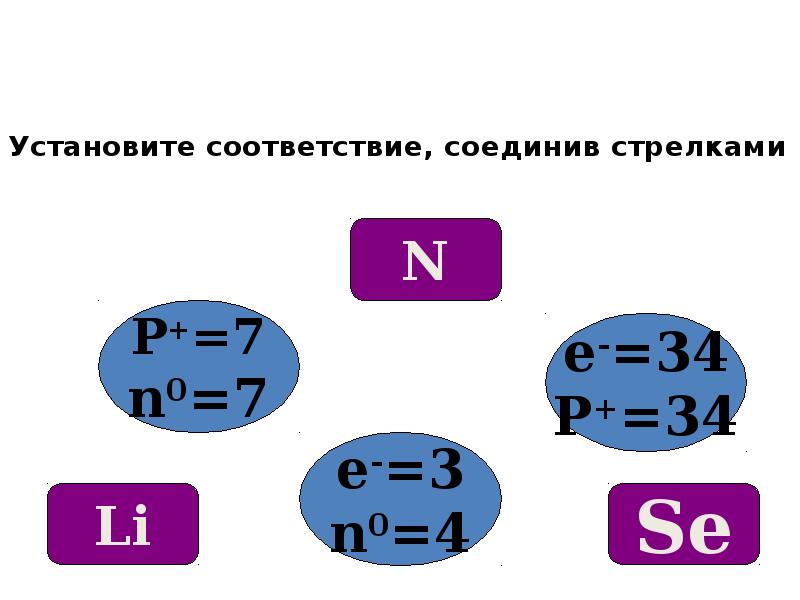
- 14. Установите соответствие, соединив стрелками Установите соответствие, соединив стрелками
- 15. Заполни таблицу
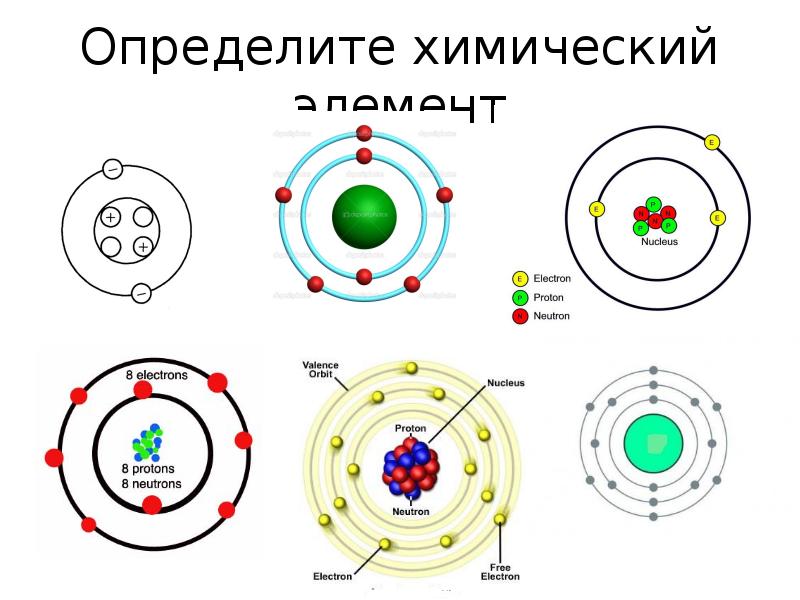
- 16. Определите химический элемент
- 17. Тестовые задания Заряд ядра атома азота равен : а) 7
- 18. Тестовые задания Заряд ядра атома азота равен : а) 7
- 19. МОЛОДЦЫ !!! МОЛОДЦЫ !!! Вы справились. Желаю дальнейших успехов в изучении
- 20. Скачать презентацию









Слайды и текст этой презентации
Похожие презентации





























