Аммиак 9 класс презентация
Содержание
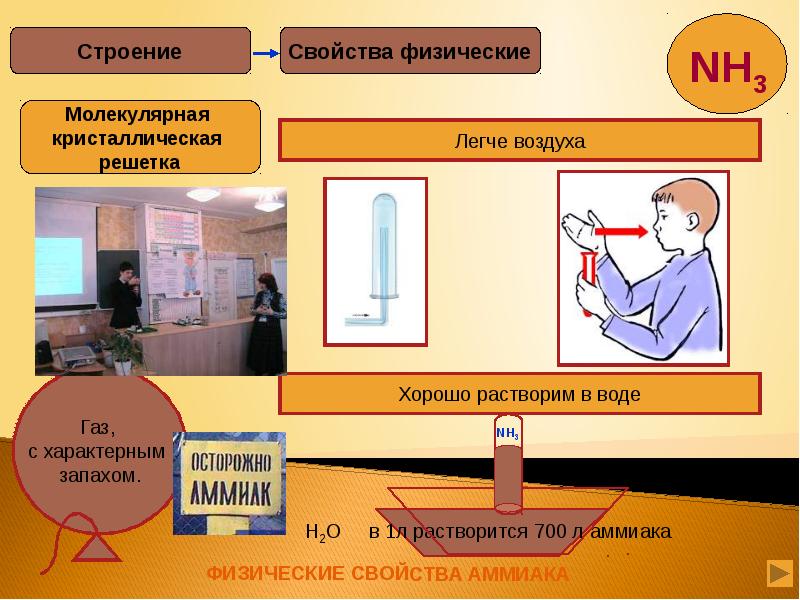
- 2. Из истории химических имён. Из истории химических имён. Строение молекулы аммиака.
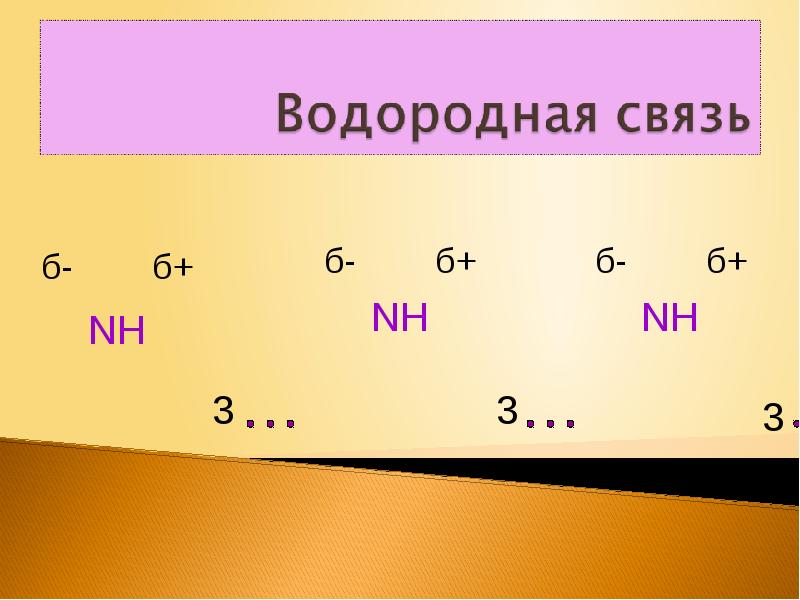
- 11. Вывод. Наличие не поделённой электронной пары на атоме азота и присутствие
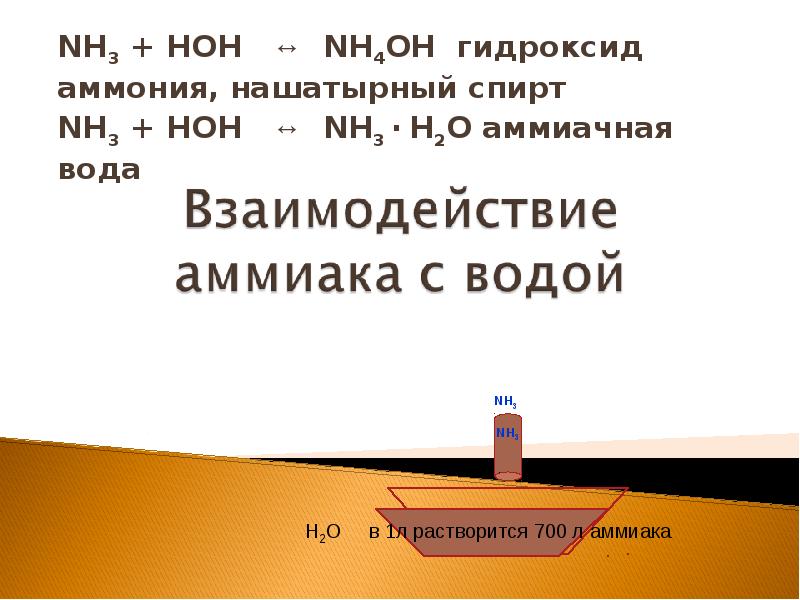
- 14. 1.Взаимодействие с водой. Действие водного раствора аммиака на индикаторы. 2.Взаимодействие с
- 16. NH3 + HОН ↔ NH4ОН гидроксид аммония, нашатырный спирт NH3 +
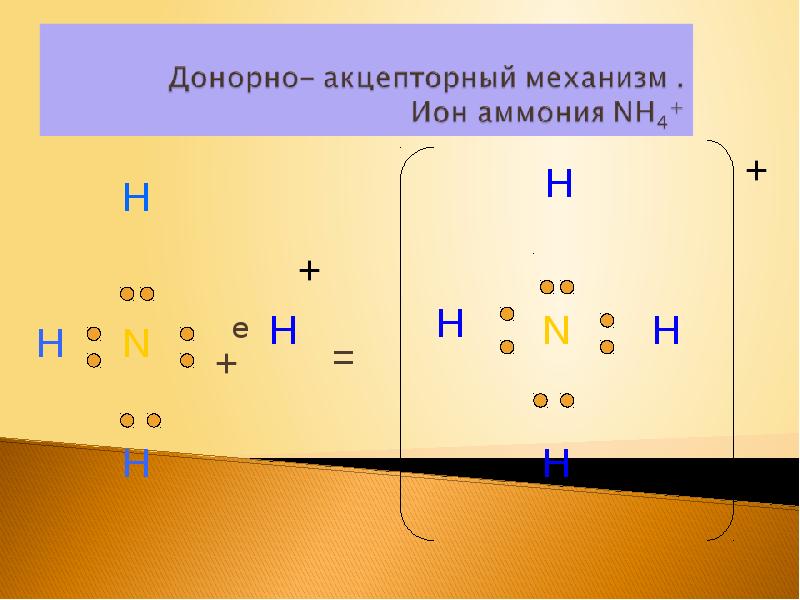
- 17. е
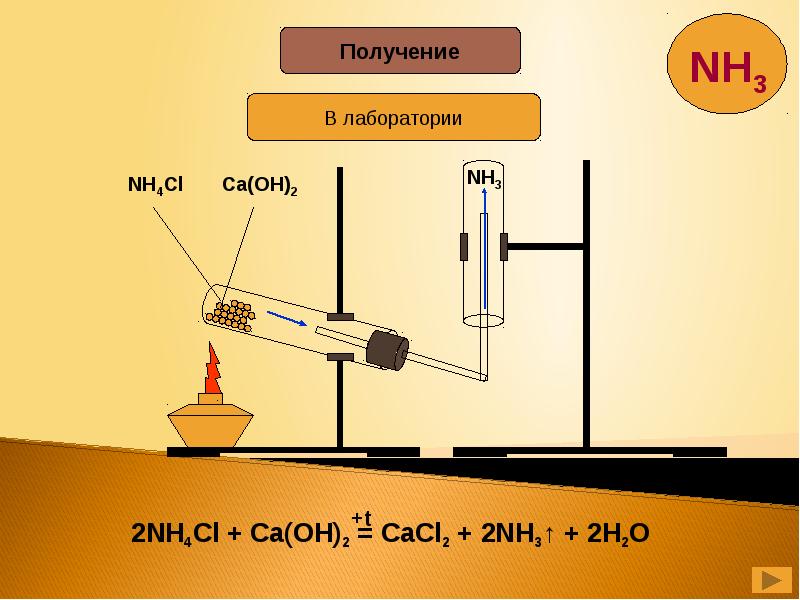
- 18. Растворение аммиака в воде и в кислотах – процесс химический, в
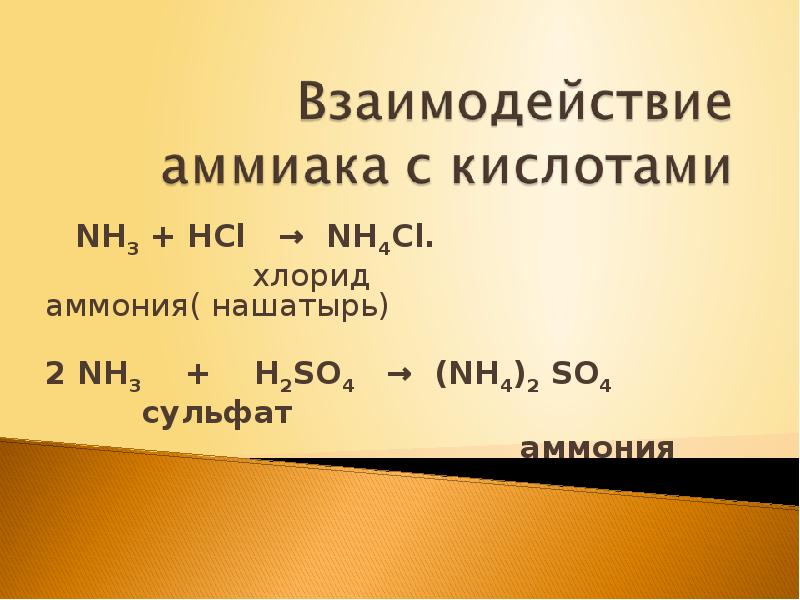
- 19. NH3 + HCl → NH4Cl. хлорид
- 20. 1. В отсутствии катализатора NH3 + O2 → N2 + H2O
- 21. Аммиак не горит на воздухе, но в чистом кислороде или в
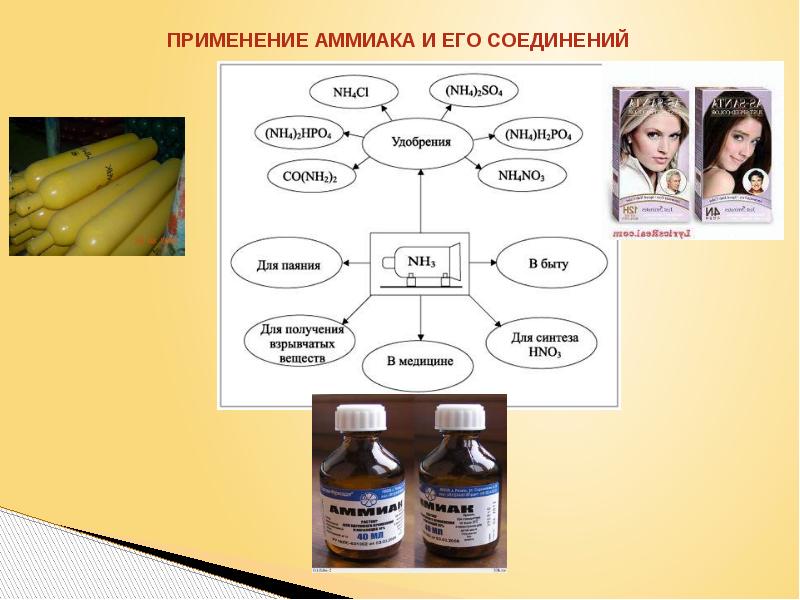
- 26. Чтоб продукты не пропали Чтоб продукты не пропали Вам поможет аммиак,
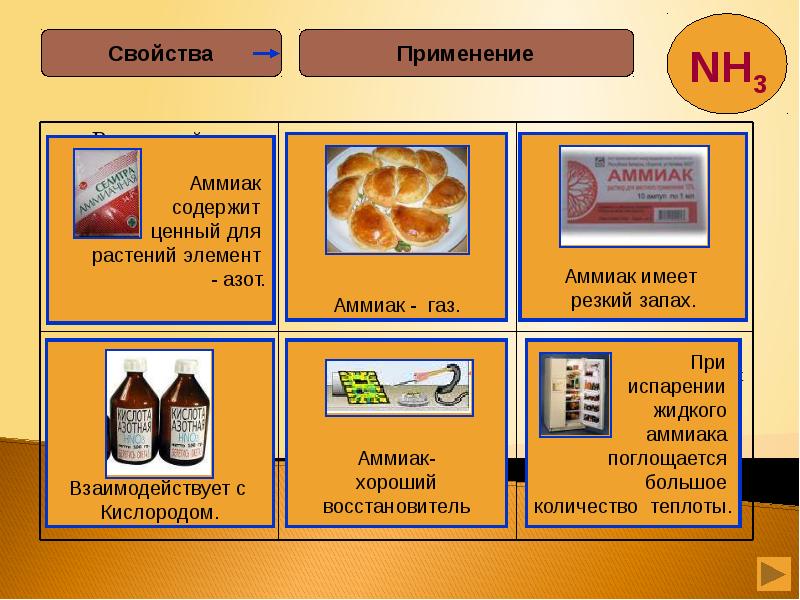
- 33. Аммиак Аммиак Газообразный Хорошорастворим Восстановитель при горении Образующий соль нашатырь Поражающий
- 35. Скачать презентацию




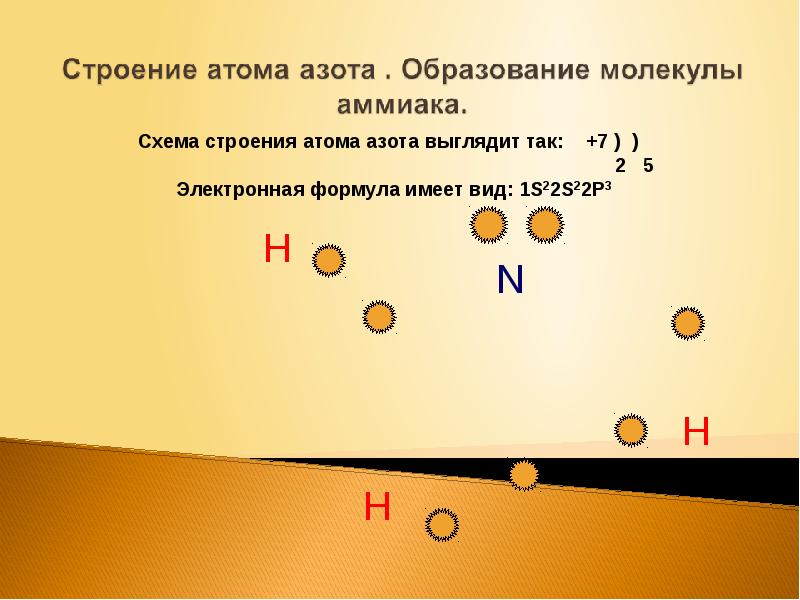
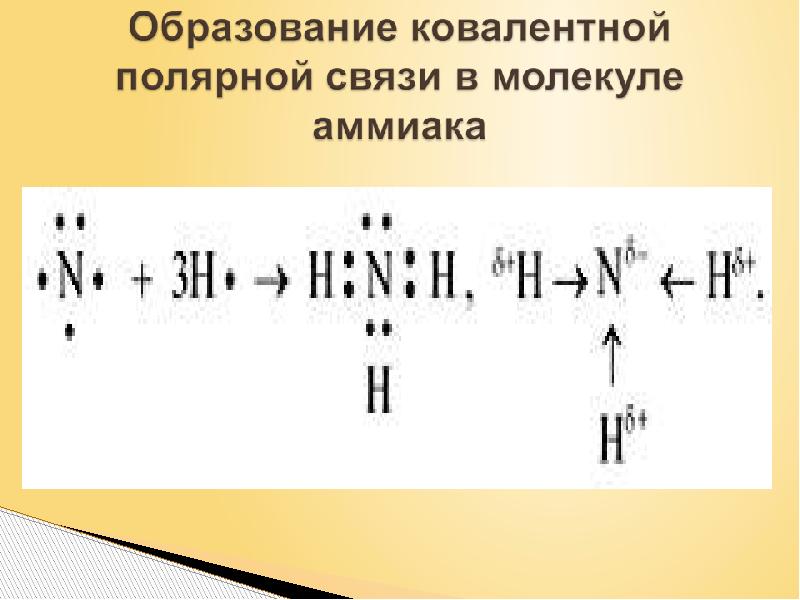
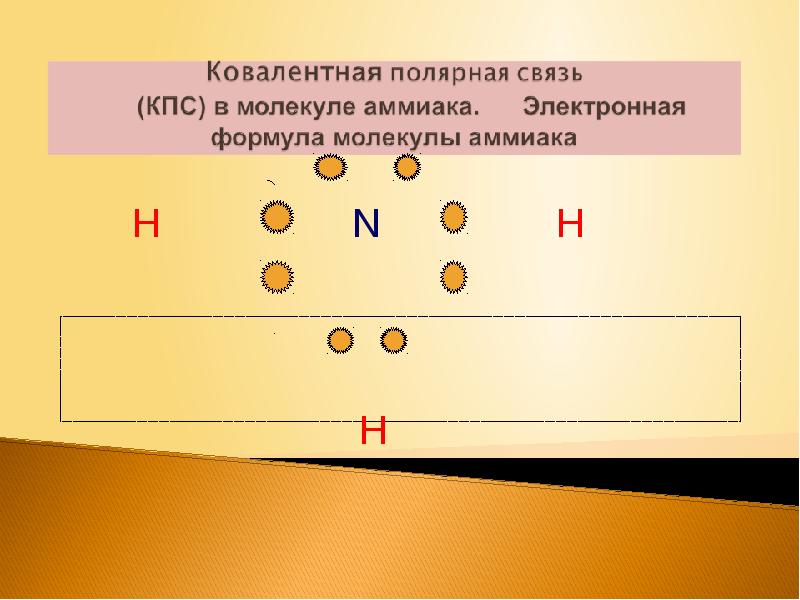
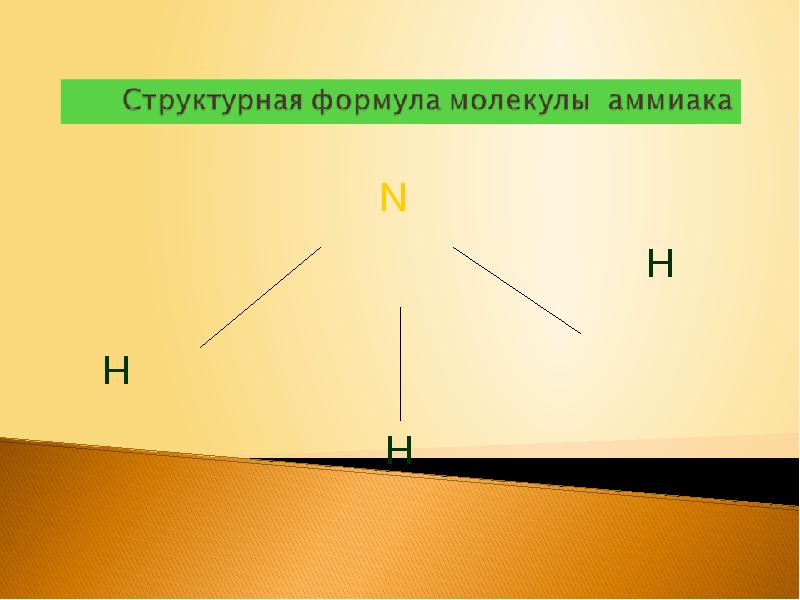


















Слайды и текст этой презентации
Похожие презентации





























