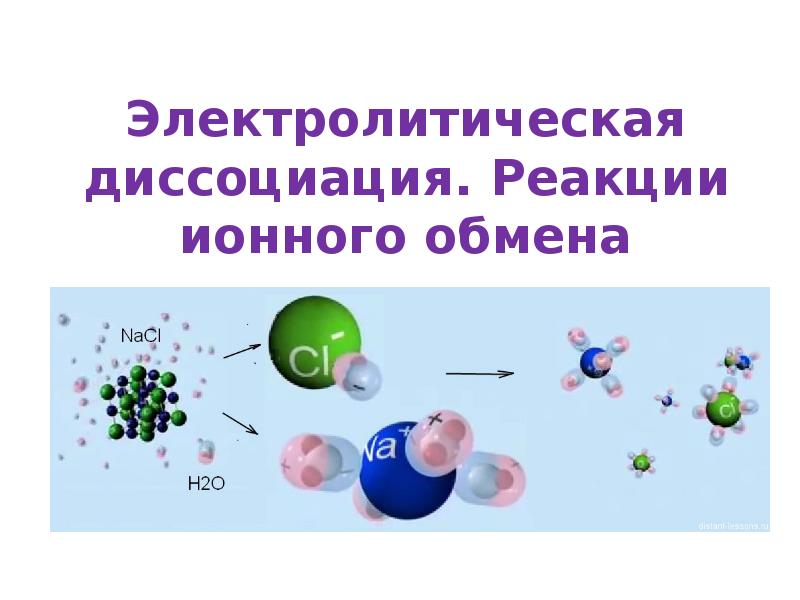
Электролитическая диссоциация. Реакции ионного обмена презентация
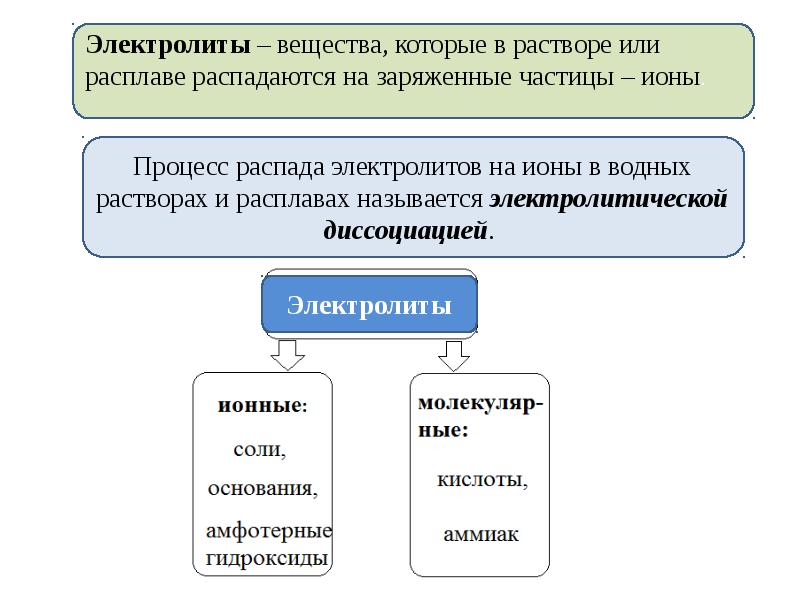
Содержание
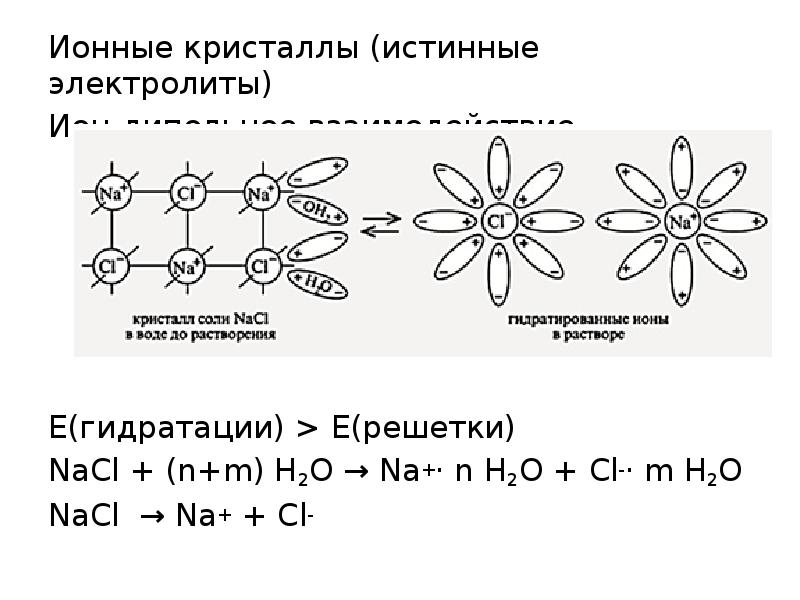
- 3. Ионные кристаллы (истинные электролиты) Ионные кристаллы (истинные электролиты) Ион-дипольное взаимодействие Е(гидратации)
- 4. Полярные молекулярные вещества (потенциальные электролиты) Полярные молекулярные вещества (потенциальные электролиты) Диполь-дипольное
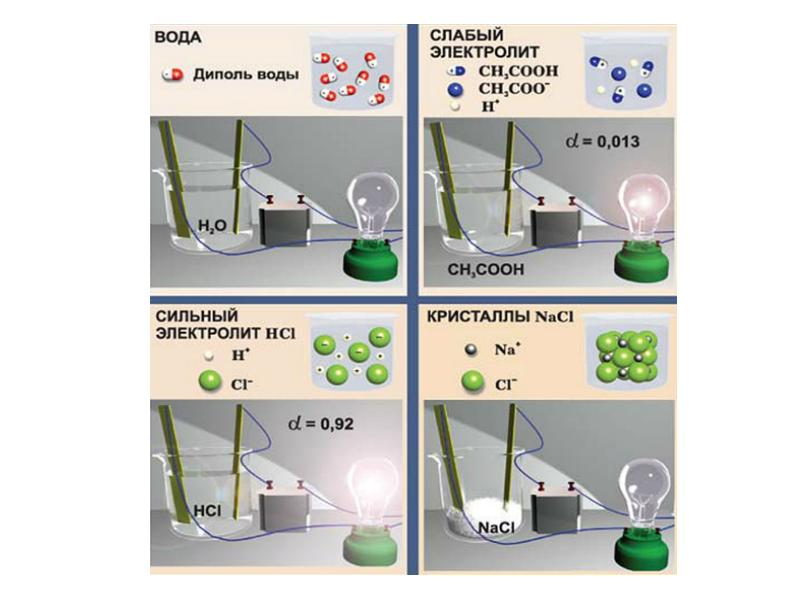
- 5. Для молекулярных электролитов Для молекулярных электролитов Степень диссоциации (ионизации):
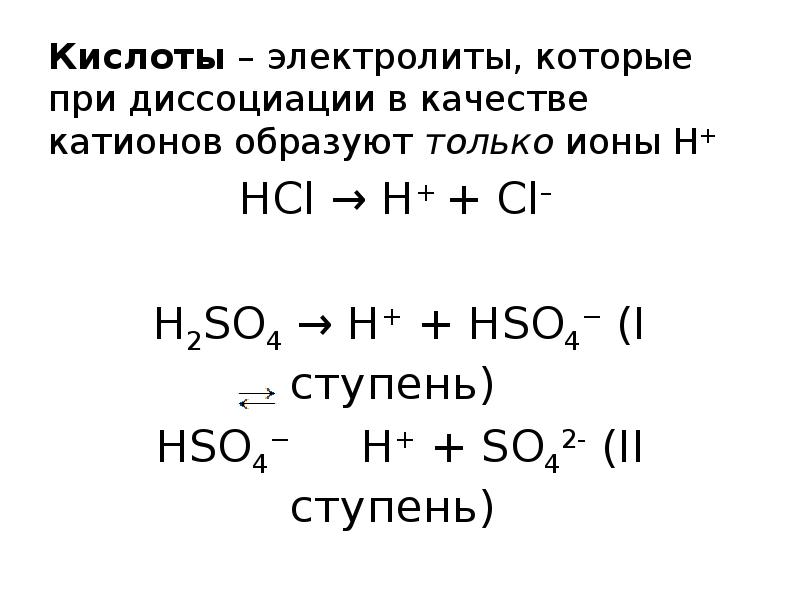
- 7. Кислоты – электролиты, которые при диссоциации в качестве катионов образуют только
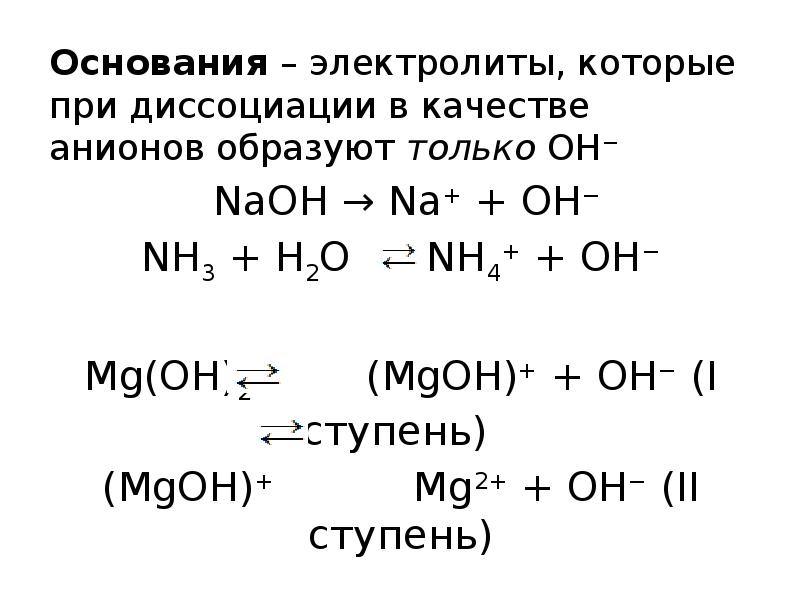
- 8. Основания – электролиты, которые при диссоциации в качестве анионов образуют только
- 9. Амфотерные гидроксиды (амфолиты) – электролиты, которые могут диссоциировать как по кислотному,
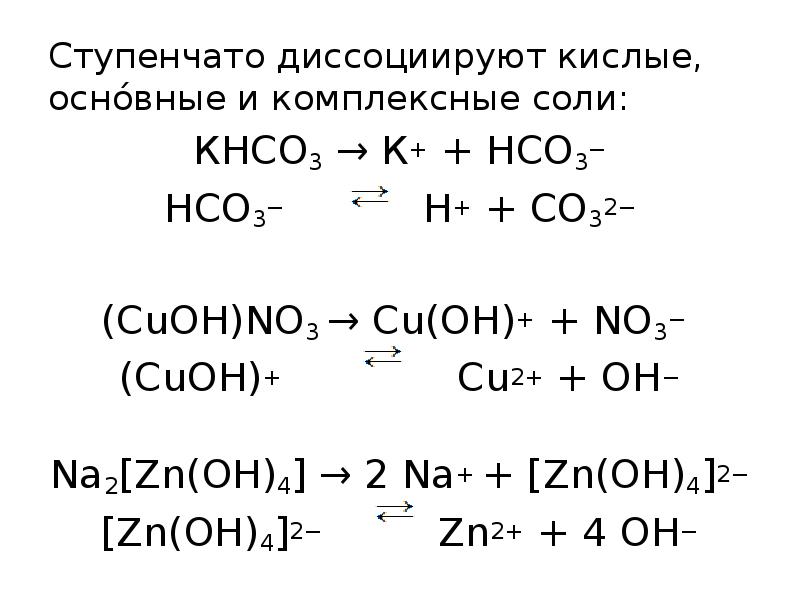
- 10. Ступенчато диссоциируют кислые, оснóвные и комплексные соли: Ступенчато диссоциируют кислые, оснóвные
- 11. Средние, двойные и смешанные соли диссоциируют в одну стадию! Средние, двойные
- 12. Диссоциация воды Диссоциация воды H2O ↔ H+ + OH− [H+]·[OH−]
- 13. При [H+]=[OH−] =10-7, При [H+]=[OH−] =10-7, рН = –
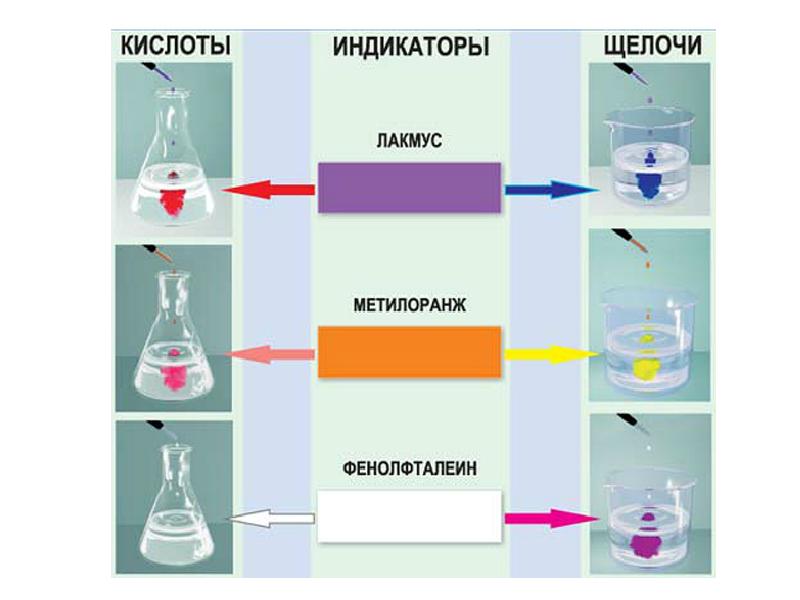
- 14. Окраска лакмуса: Окраска лакмуса:
- 15. Реакции ионного обмена Реакции ионного обмена
- 16. Реакция нейтрализации Реакция нейтрализации 1) Сильная кислота + щелочь с образованием
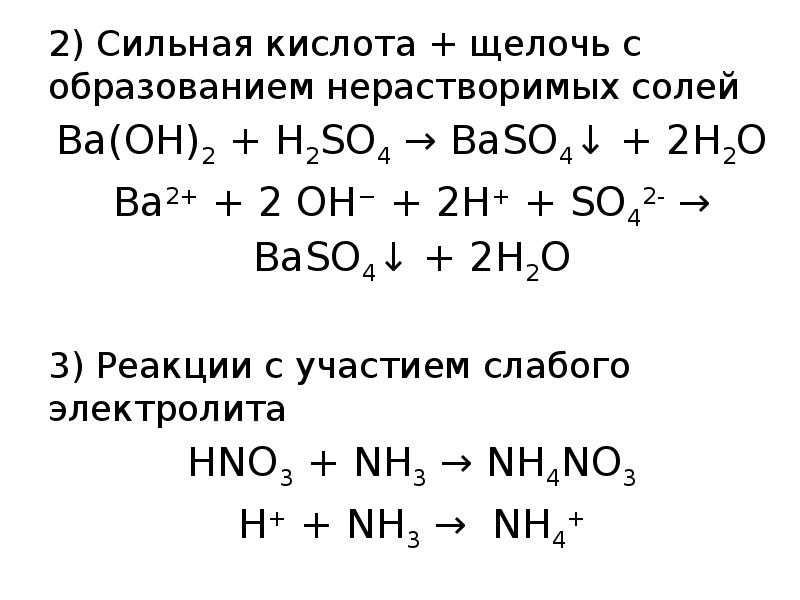
- 17. 2) Сильная кислота + щелочь с образованием нерастворимых солей 2) Сильная
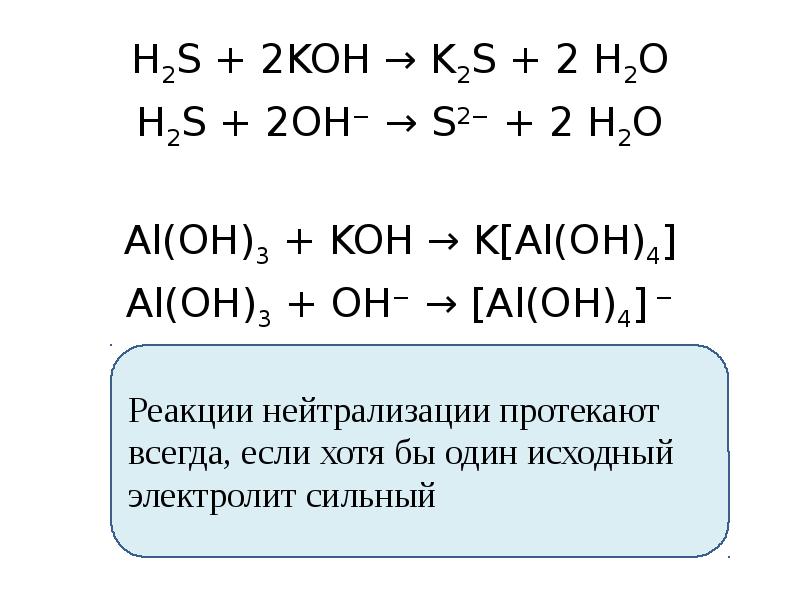
- 18. H2S + 2KOH → K2S + 2 H2O H2S + 2KOH
- 19. 4) 4) H2S + 2NH3 → (NH4)2S H2S + 2NH3 →
- 20. 5) Неполная нейтрализация 5) Неполная нейтрализация в избытке кислоты: H2SО4
- 21. Гидролиз солей Гидролиз солей Не подвергаются гидролизу соли:
- 22. 1) Соль, образованная сильным основанием и слабой кислотой 1) Соль,
- 23. 2) Соль, образованная слабым основанием и сильной кислотой 2) Соль,
- 24. 3) Соль, образованная слабым основанием и слабой кислотой 3) Соль,
- 25. Совместный гидролиз Совместный гидролиз 1) Соли металлов со степенью окисления +3
- 26. 2) Соли металлов со степенью окисления +2 (кроме кальция, стронция и
- 27. Гидролиз - эндотермический процесс Гидролиз - эндотермический процесс
- 28. Скачать презентацию




![Диссоциация воды
Диссоциация воды
H2O ↔ H+ + OH−
[H+]·[OH−] Диссоциация воды
Диссоциация воды
H2O ↔ H+ + OH−
[H+]·[OH−]](/documents_7/9e42dd52e3d4d90be19b7de62c1fa4ea/img11.jpg)
![При [H+]=[OH−] =10-7,
При [H+]=[OH−] =10-7,
рН = – При [H+]=[OH−] =10-7,
При [H+]=[OH−] =10-7,
рН = –](/documents_7/9e42dd52e3d4d90be19b7de62c1fa4ea/img12.jpg)











Слайды и текст этой презентации
Скачать презентацию на тему Электролитическая диссоциация. Реакции ионного обмена можно ниже:
Похожие презентации





























