ФЕНОЛ презентация
Содержание
- 2. Содержание Классификация Физические свойства Строение фенола Химические свойства Получение Источники информации
- 3. Классификация Фенолами называют гидроксильные производные бензола, в которых OH–группы
- 4. Физические свойства Фенол – бесцветное кристаллическое легкоплавкое вещество, с резким
- 5. Строение фенола Молекула фенола является классическим примером взаимного влияния атомов.
- 6. Ослабление её настолько существенно, что в Ослабление её настолько существенно,
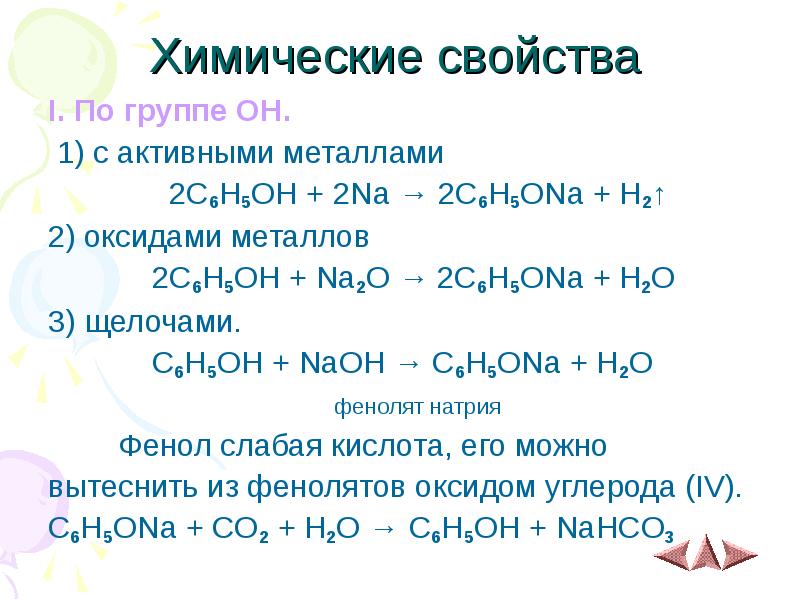
- 7. Химические свойства I. По группе OH. 1) с активными металлами
- 8. Фенол не вступает в реакции дегидратации, не взаимодействует с галогенпроизводными, спиртами,
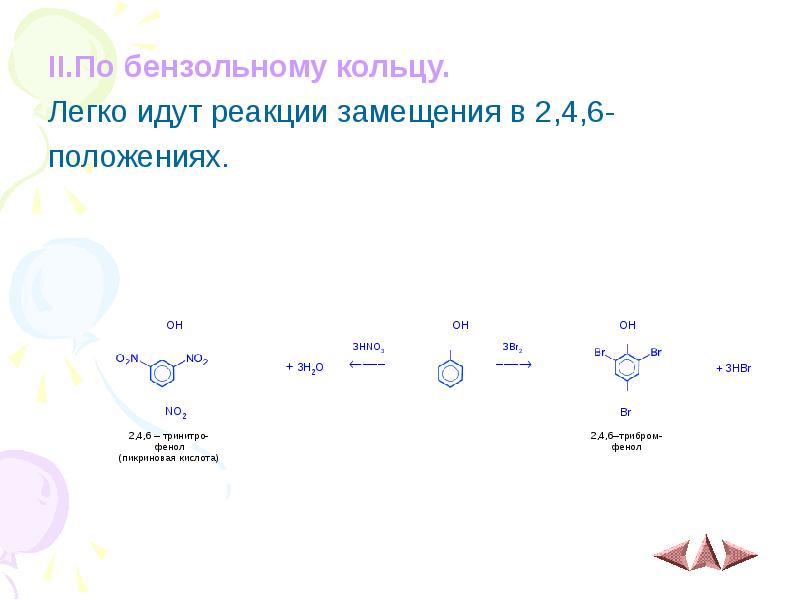
- 9. II.По бензольному кольцу. II.По бензольному кольцу. Легко идут реакции замещения в
- 10. 4) Под действием бромной воды образуется осадок белого цвета со специфическим
- 11. 6) При гидрировании в присутствии 6) При гидрировании в присутствии
- 12. 8) За счёт атомов водорода в 2,4,6-положениях фенол вступает в реакция
- 13. Получение Фенол в промышленности получают: 1) Сплавление сульфокислот с щелочами
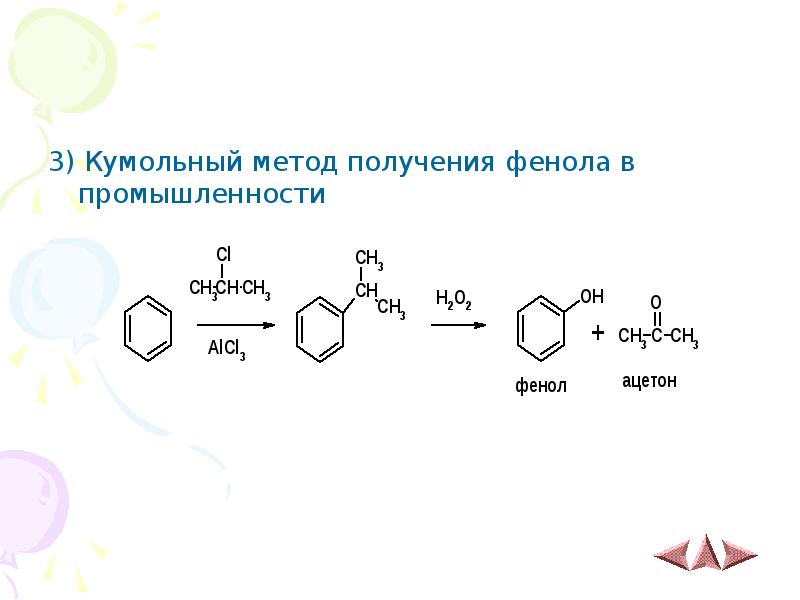
- 14. 3) Кумольный метод получения фенола в промышленности 3) Кумольный метод получения
- 15. Источники информации 1. Петров А.А., Бальян Х.В., Трощенко А.Т.
- 16. 5. Оганесян Э.Т. Руководство по химии 5. Оганесян Э.Т. Руководство
- 17. 9. Штремплер Г.И. Тесты, вопросы и ответы по химии: Книга для
- 18. Скачать презентацию














Слайды и текст этой презентации
Похожие презентации





























