Гибридизация электронных орбиталей и геометрия молекул презентация
Содержание
- 2. Повторение Определите вид химической связи, составьте электронные формулы образования веществ: NH3,
- 3. 5. Какие из приведённых утверждений верны? А. Вещества с молекулярной решёткой
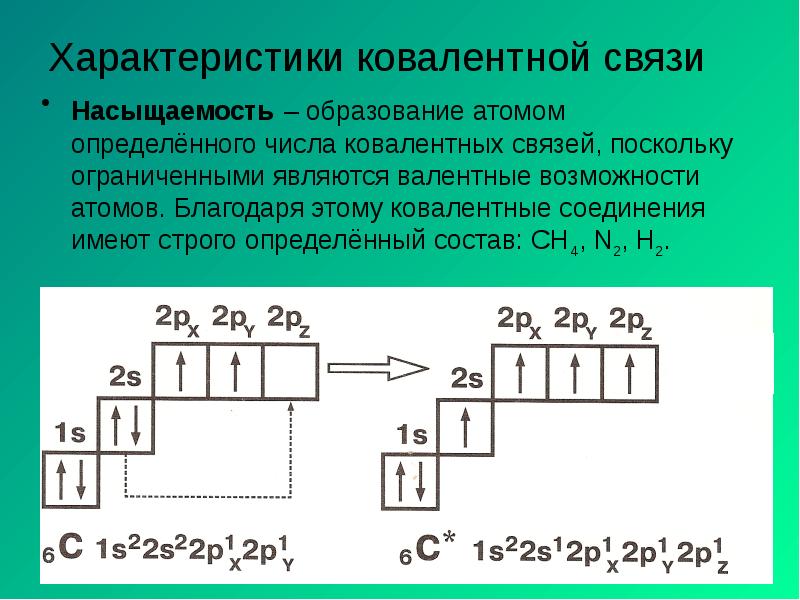
- 4. Характеристики ковалентной связи Насыщаемость – образование атомом определённого числа ковалентных связей,
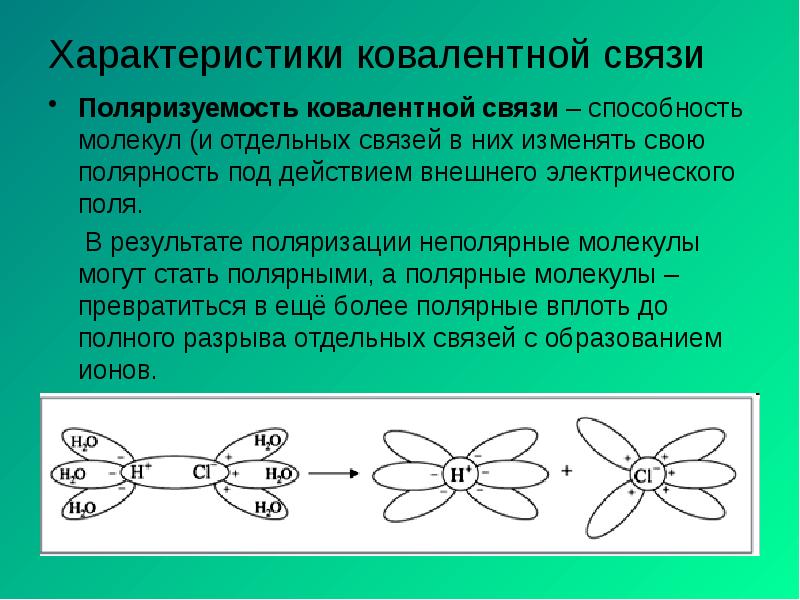
- 5. Характеристики ковалентной связи Поляризуемость ковалентной связи – способность молекул (и отдельных
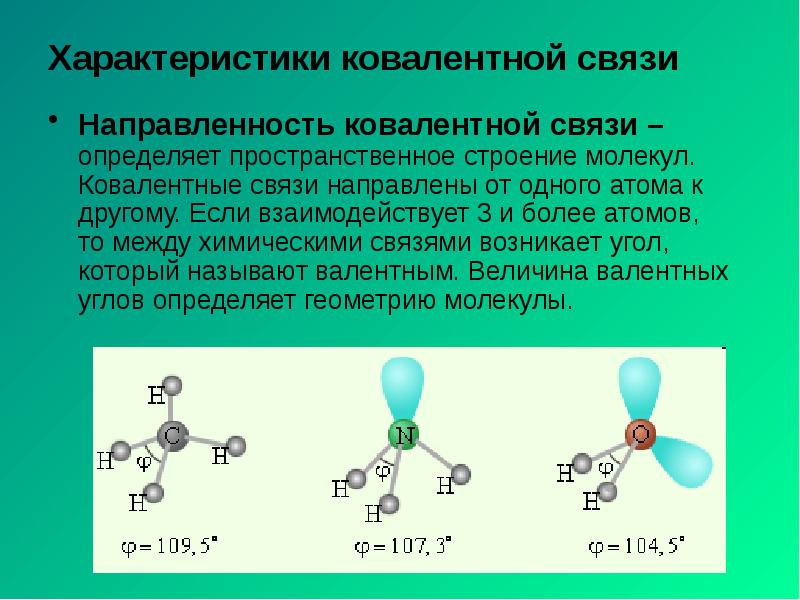
- 6. Характеристики ковалентной связи Направленность ковалентной связи – определяет пространственное строение молекул.
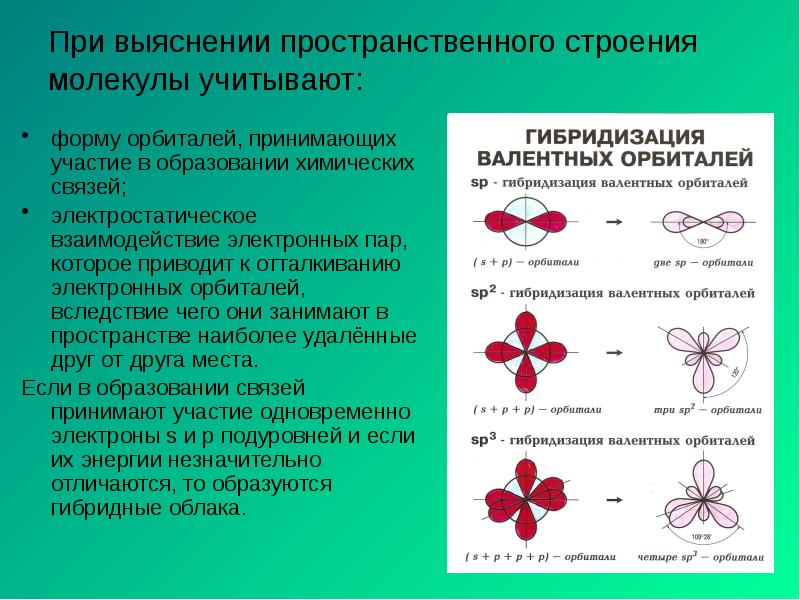
- 7. При выяснении пространственного строения молекулы учитывают: форму орбиталей, принимающих участие в
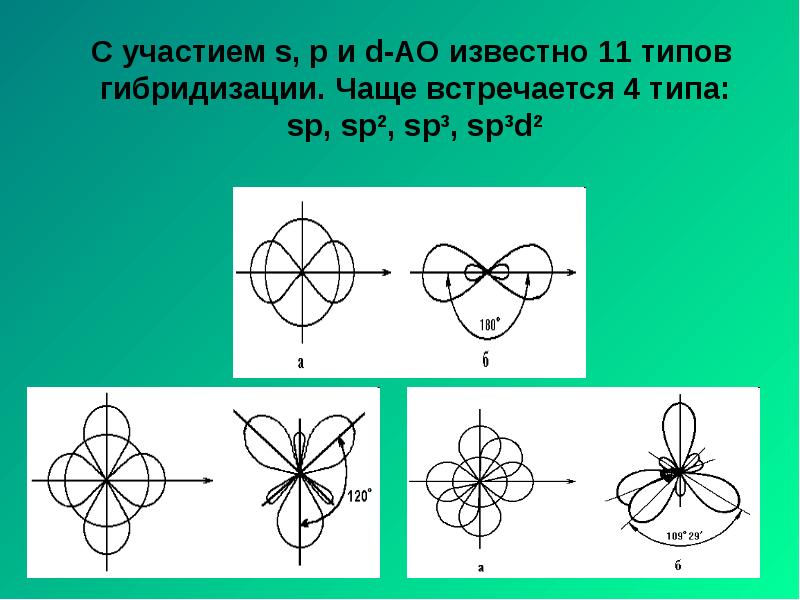
- 9. С участием s, p и d-АО известно 11 типов гибридизации. Чаще
- 10. Определение типа гибридизации на примере молекулы метана. 1.Написать полную структурную формулу
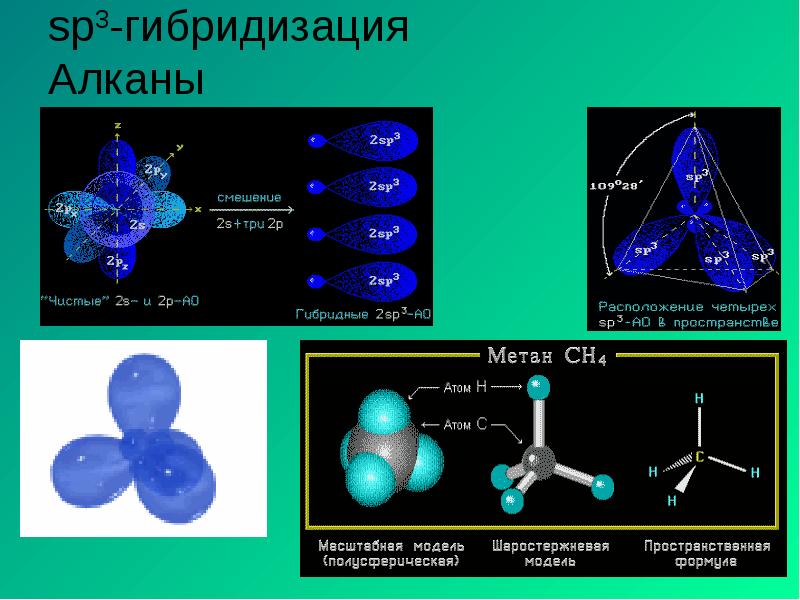
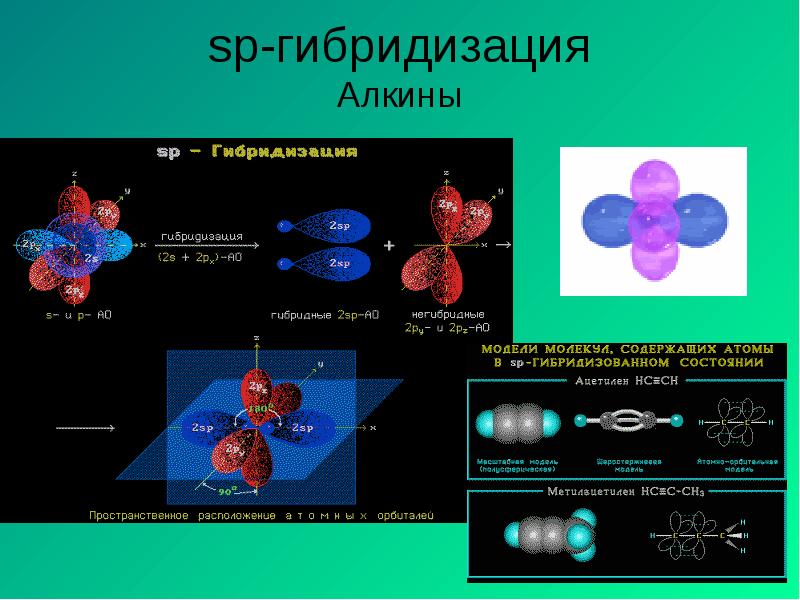
- 11. sp3-гибридизация Алканы
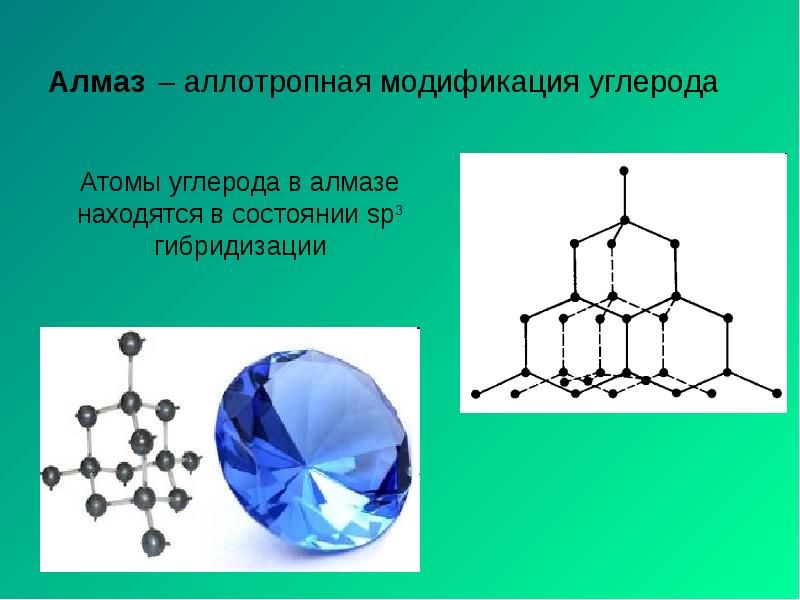
- 12. Алмаз – аллотропная модификация углерода
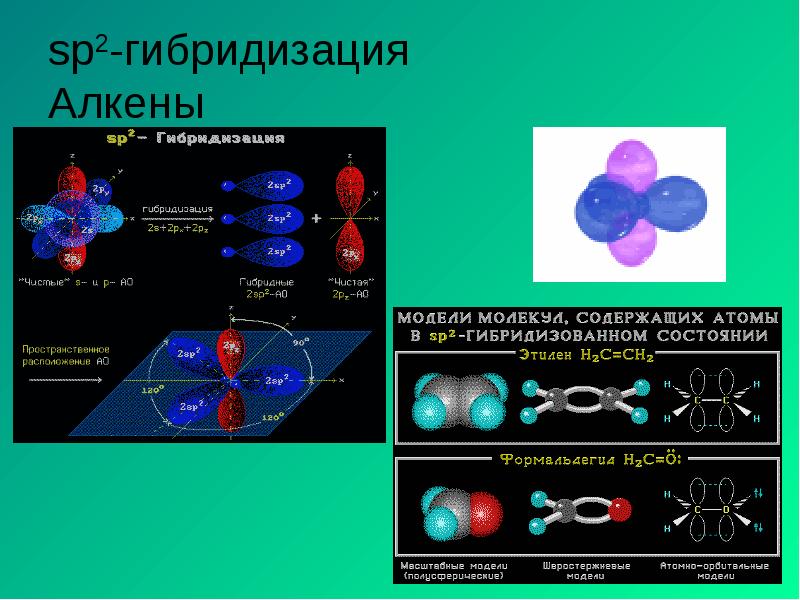
- 13. sp2-гибридизация Алкены
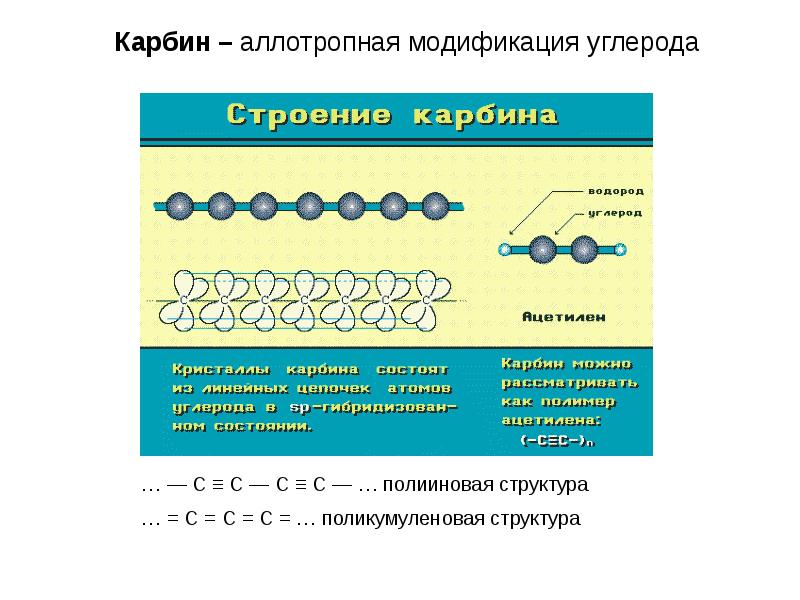
- 14. Графит – аллотропная модификация углерода.
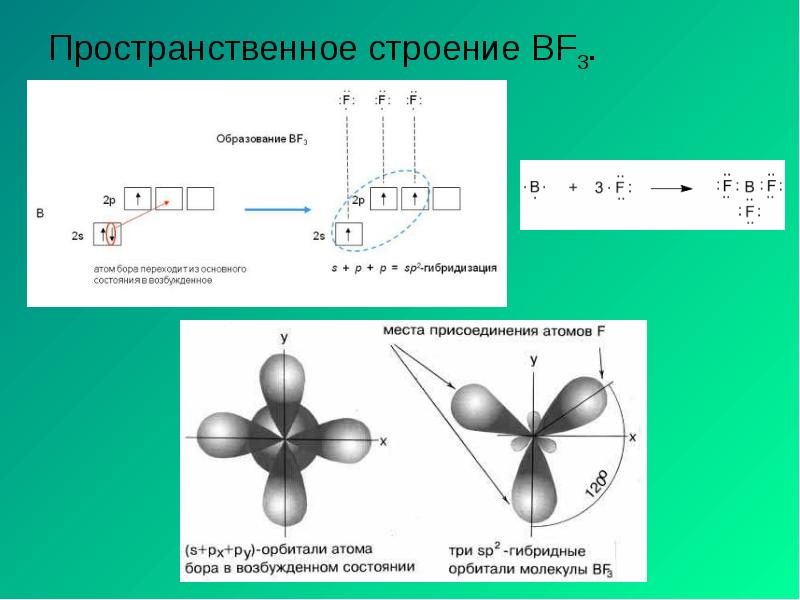
- 17. Пространственное строение BF3.
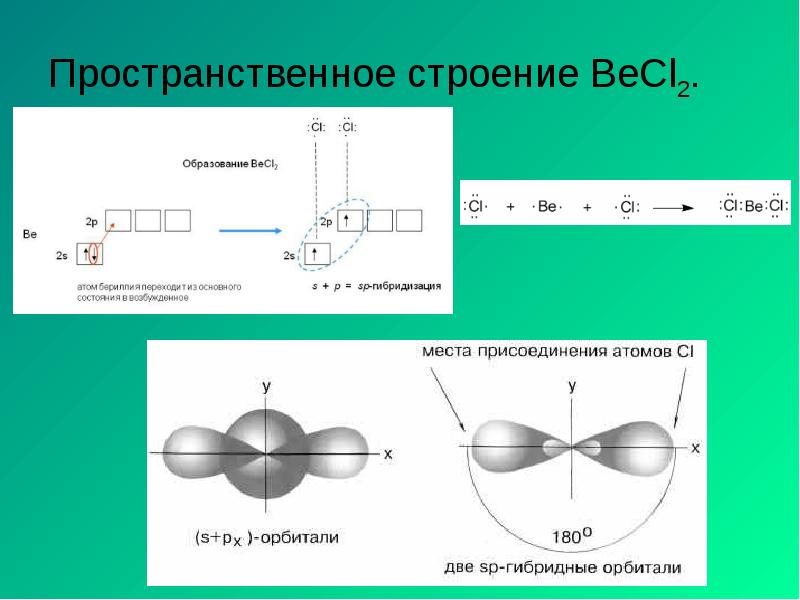
- 18. Пространственное строение BeCl2.
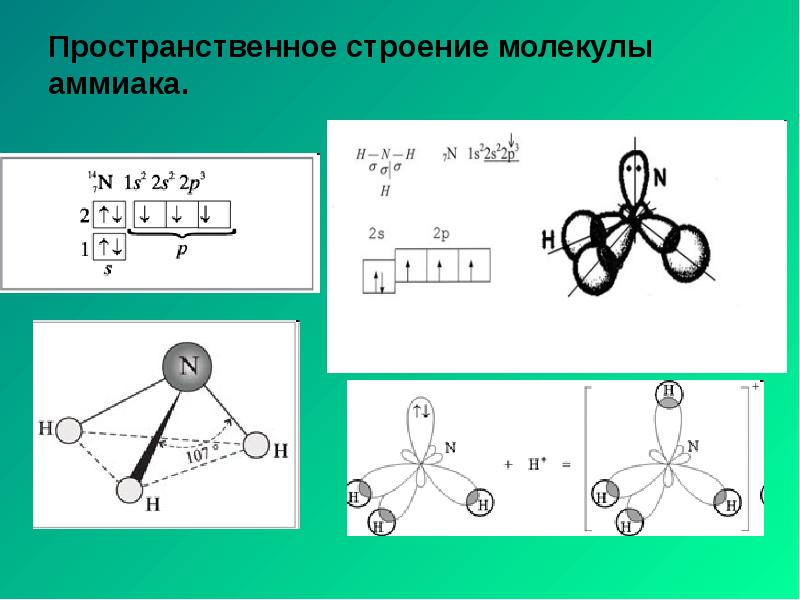
- 19. Пространственное строение молекулы аммиака.
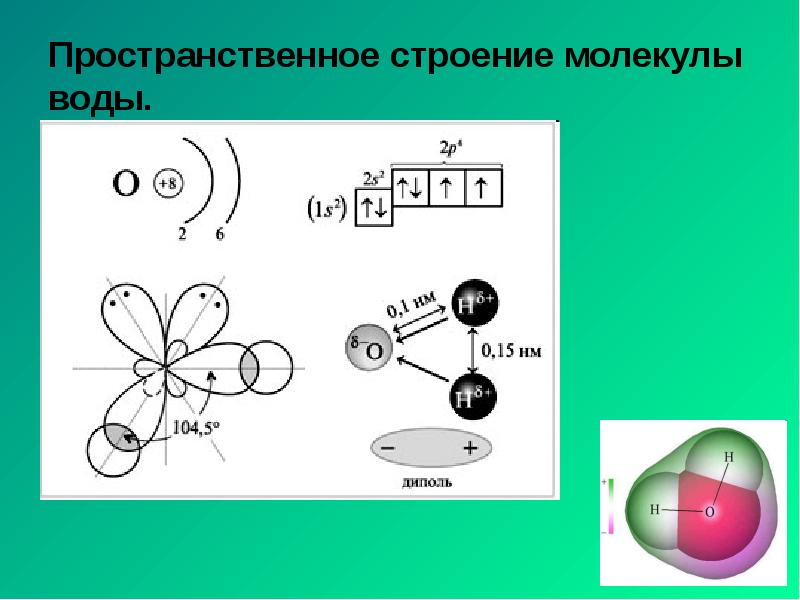
- 20. Пространственное строение молекулы воды.
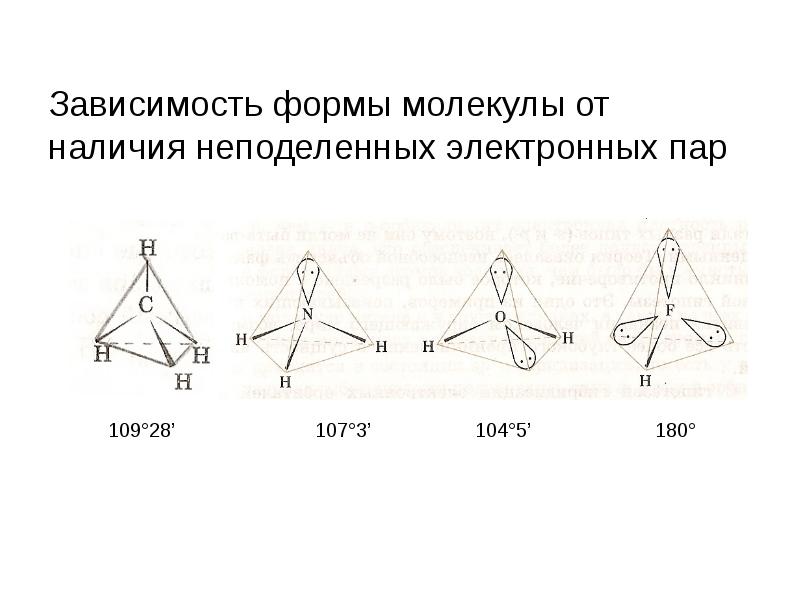
- 21. Зависимость формы молекулы от наличия неподеленных электронных пар
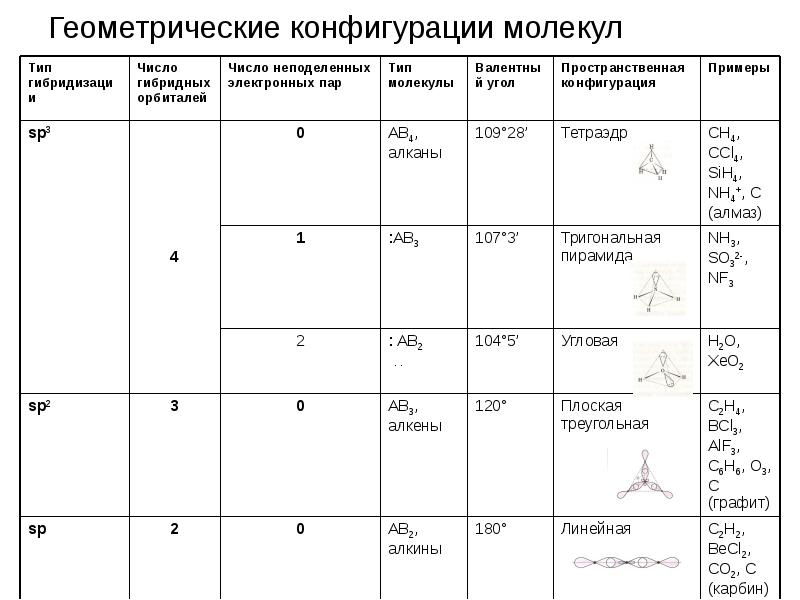
- 22. Геометрические конфигурации молекул
- 23. Вопросы для закрепления Даны формулы веществ: а) C2H4; г) Н2О;
- 24. 3. Анионы PO43-, SO42-, ClO4- имеют тетраэдрическое строение. 3. Анионы PO43-,
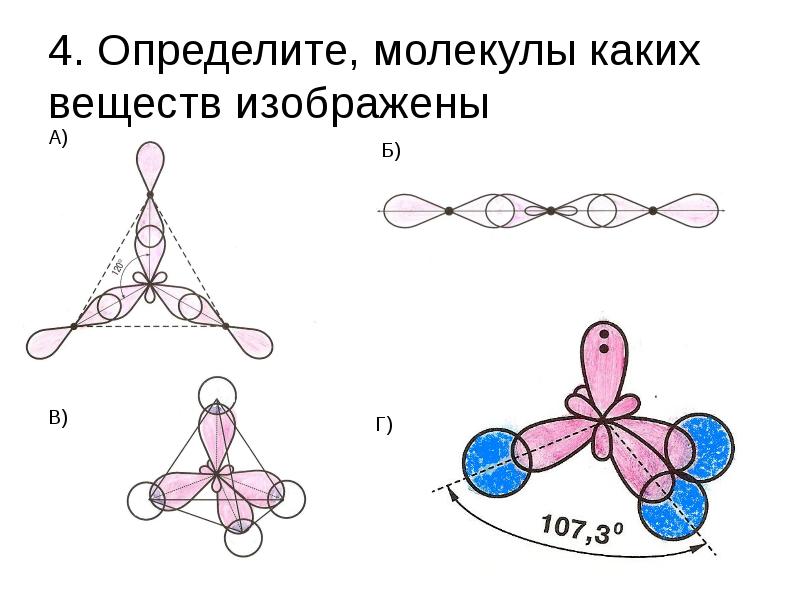
- 25. 4. Определите, молекулы каких веществ изображены
- 26. Скачать презентацию








Слайды и текст этой презентации
Скачать презентацию на тему Гибридизация электронных орбиталей и геометрия молекул можно ниже:
Похожие презентации





























