Гидролиз. Константа и степень гидролиза. рН растворов гидролизующих солей презентация
Содержание
- 2. Ионы растворенного вещества могут по-разному взаимодействовать с молекулами растворителя (сольвата)
- 3. Гидролиз солей является обратимым процессом: он рассматривается как частный случай химического
- 4. Механизм гидролиза Гидролиз электролитов распадающихся на ионы, рассматривается как результат
- 5. Чем сильнее поляризующее действие ионов электролита (соли), тем в большей степени
- 6. В процессе гидротации анионов, молекулы воды выступают в качестве доноров протонов.
- 7. В зависимости от донорной активности A- выделяют 2 случая: 1.
- 8. Типы гидролиза Соли, образованные сильной кислотой и сильным основанием. NаCl→ Na++CL-
- 9. Соли, образованные сильными кислотами и слабыми основаниями гидролизуется по K+.
- 10. Соли, образованные сильными основаниями и слабыми кислотами гидролизуется по A- .
- 11. Соли, образованные слабыми основаниями и слабыми кислотами, которые гидролизуются по K+
- 12. Гидролиз по катиону соли Реакции гидролиза иногда мешают проведению анализа. В
- 13. Гидролиз по катиону Для подавления гидролиза вводят HCl, которая смещает равновесие
- 14. Гидролиз по катиону Определение серебра с помощью тиосульфатов ведут в присутствии
- 15. Гидролиз по катиону Для подавления гидролиза FeOH2+ в раствор добавляют кислоту.
- 16. Гидролиз по аниону Если гидролизуется
- 17. Количественные характеристики гидролиза Иногда необходимо увеличить глубину протекания гидролиза. Поэтому
- 18. CH3COONa – соль, образованная слабой кислотой и сильным основанием. CH3COONa →
- 19. Расчет константы равновесия Любой равновесный процесс характеризуется константой равновесия( Кр) Согласно
- 20. Константа гидролиза Чем больше Кг , следовательно, тем слабее
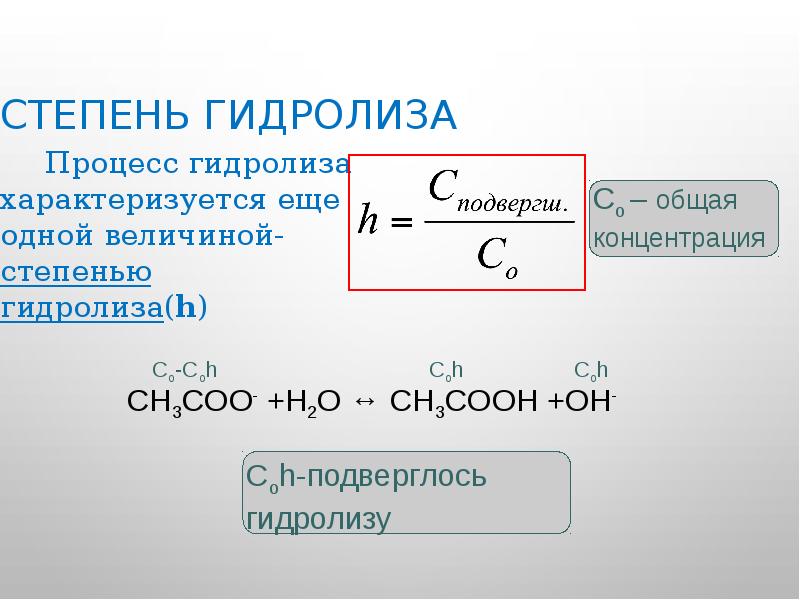
- 21. Степень гидролиза Процесс гидролиза характеризуется еще одной величиной-степенью гидролиза(h)
- 22. Расчет константы гидролиза
- 23. рН раствора В результате гидролиза меняется рН раствора
- 24. рН раствора
- 25. Задача Нам дан раствор Na2CO3 c молярной концентрацией 0,1М. Ка=4,5*10-7 -lgKa=6,35
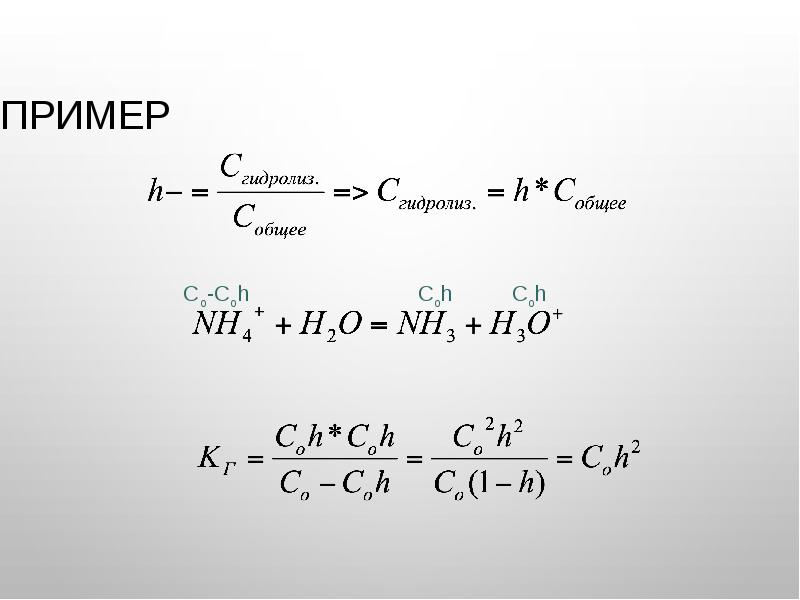
- 26. Гидролиз Соль, образованная сильной кислотой и слабым основанием: NH4Cl → NH4+
- 27. Гидролиз Концентрация гидрализующейся соли не значительна, а концентрация воды не изменяется.
- 28. Гидролиз Домножим наше уравнение на
- 29. Пример
- 30. Расчет pH
- 31. Гидролиз соли, содержащей катион слабого основания и анион слабой кислоты .
- 32. Гидролиз Как сильный электролит ацетат аммония диссоциирует на ионы: CH3COONH4
- 33. Гидролиз Суммарное уравнение: CH3COO+NH4++HOH=NH3+CH3COOH+H3O+ + OH- В этом случае константа
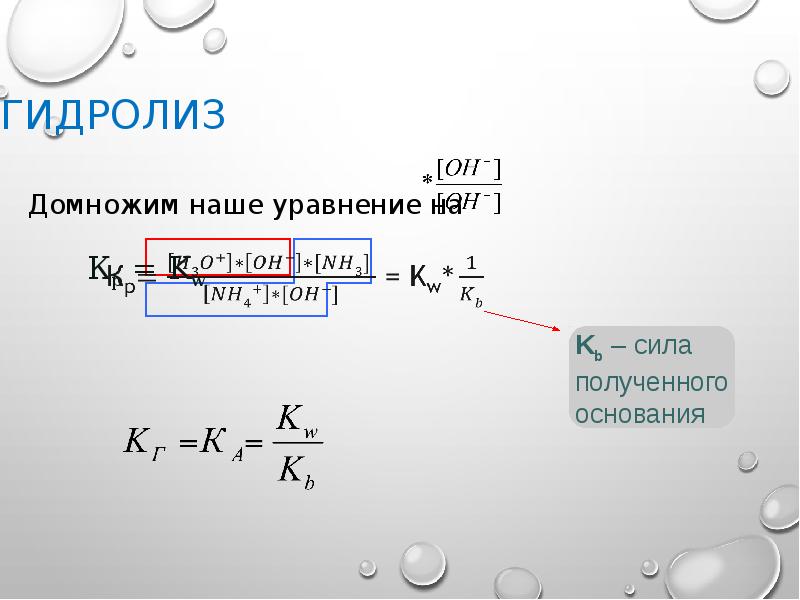
- 34. Гидролиз Если числитель и знаменатель умножить на ионное произведение воды, получим:
- 35. Гидролиз
- 36. Гидролиз
- 37. Гидролиз Выражение константы гидролиза по уравнению имеет вид: CH3COO- + NH4+
- 38. Гидролиз Следовательно константа гидролиза равна: и
- 39. Гидролиз Из константы ионизации выражаем концентрацию уксусной кислоты:
- 40. Гидролиз
- 41. Гидролиз Т.к. Ка = Кb, pH=7.
- 51. Скачать презентацию















































Слайды и текст этой презентации
Скачать презентацию на тему Гидролиз. Константа и степень гидролиза. рН растворов гидролизующих солей можно ниже:
Похожие презентации





























