Карбоновые кислоты: классификация, номенклатура, изомерия презентация
Содержание
- 2. Историческая справка 1789 г. Товий Егорович Ловиц Дж. Рей – муравьиная
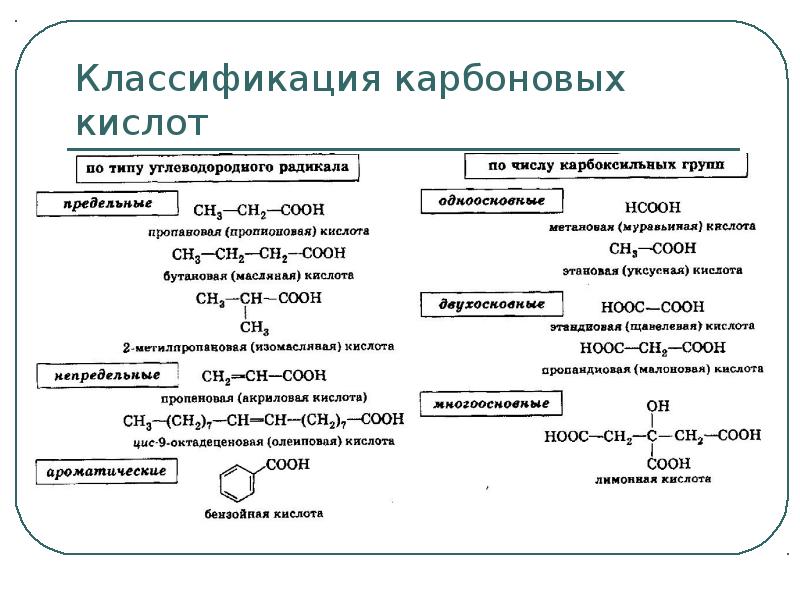
- 3. Классификация карбоновых кислот
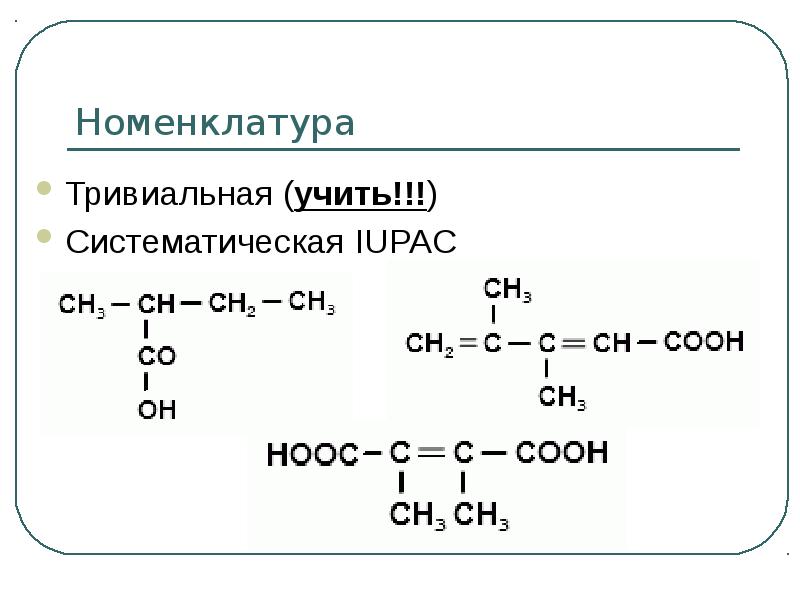
- 4. Номенклатура Тривиальная (учить!!!) Систематическая IUPAC
- 5. Изомерия Углеродного скелета Между классами Сложные эфиры С5Н10О2 Кетоспирты Альдегидоспирты Кетоэфиры Альдегидоэфиры
- 6. Домашнее задание: §20 (стр. 206 – 209). Упр. 1, 15, 16,
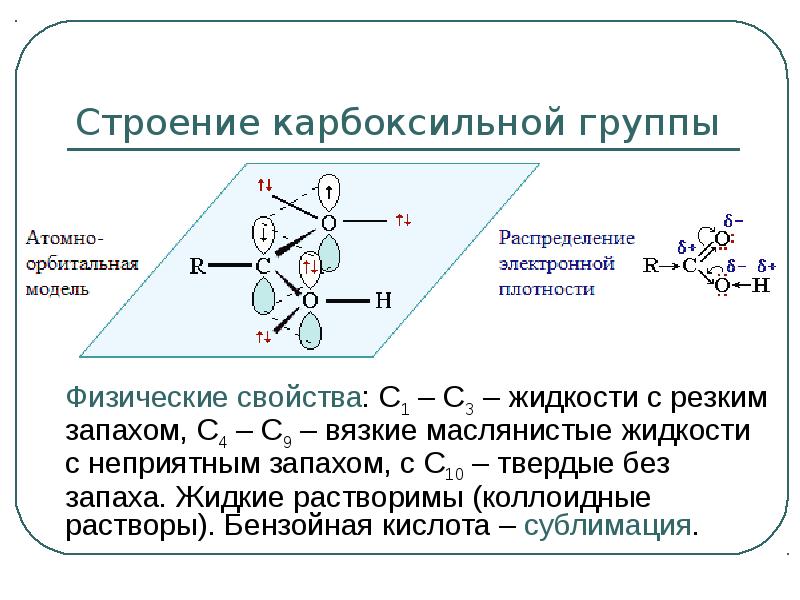
- 7. Строение карбоксильной группы Физические свойства: С1 – С3 – жидкости с
- 8. Химические свойства Общие с другими кислотами Диссоциация, изменение окраски индикаторов (слабые
- 9. Химические свойства Особенные свойства (образование производных) Ангидрид Хлорангидрид Амид Нитрил
- 10. Химические свойства Восстановление Окисление Горение Муравьиная кислота (KMnO4, [Ag(NH3)2]OH) Щавелевая кислота
- 11. Получение В промышленности Окисление алканов, первичных спиртов, альдегидов Оксосинтез В лаборатории
- 12. Задачи на вывод формулы по уравнению и формуле класса На нейтрализацию
- 13. Задание 35 Некоторое органическое соединение содержит 13,3% водорода и 26,7% кислорода
- 14. Домашнее задание: §20 Упр. 5 – 9, 11, 17, 18, 19
- 15. Скачать презентацию





![Химические свойства
Восстановление
Окисление
Горение
Муравьиная кислота (KMnO4, [Ag(NH3)2]OH)
Щавелевая кислота Химические свойства
Восстановление
Окисление
Горение
Муравьиная кислота (KMnO4, [Ag(NH3)2]OH)
Щавелевая кислота](/documents_7/a07b0cbe64fbd4eca3fa3e1e50a63b9b/img9.jpg)




Слайды и текст этой презентации
Скачать презентацию на тему Карбоновые кислоты: классификация, номенклатура, изомерия можно ниже:
Похожие презентации





























