Молекулярные механизмы апоптоза презентация
Содержание
- 3. Термин «апоптоз» впервые введен в 1972 г. J.Kerr, A.Wyllie, A.Currie при
- 7. Нобелевская премия 2002 г. «за открытия, посвященные генетической регуляции развития органов
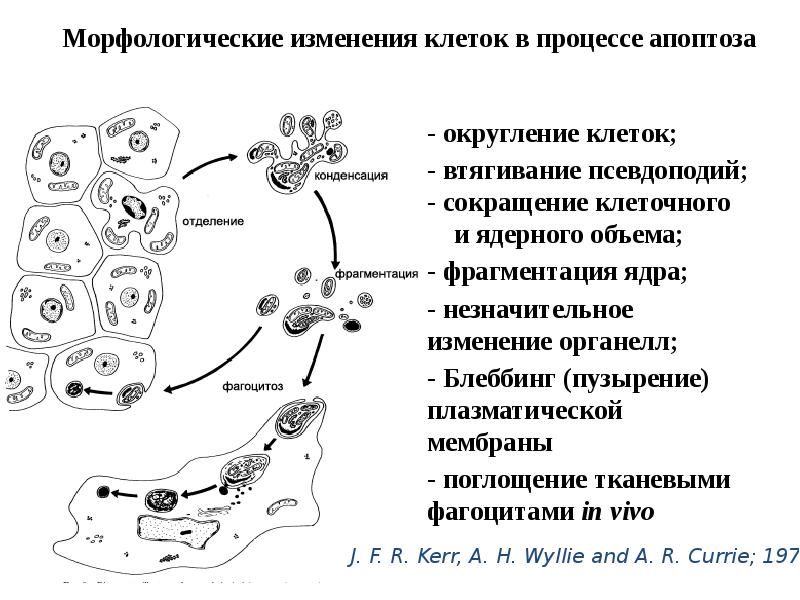
- 12. Выделяют 4 вида программированной гибели клеток (ПГК), основанные на морфо-физиологических изменениях
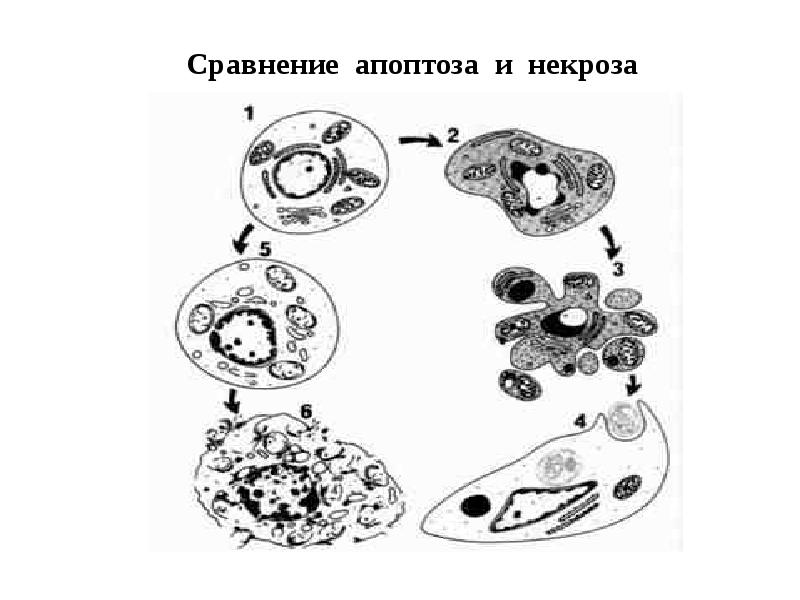
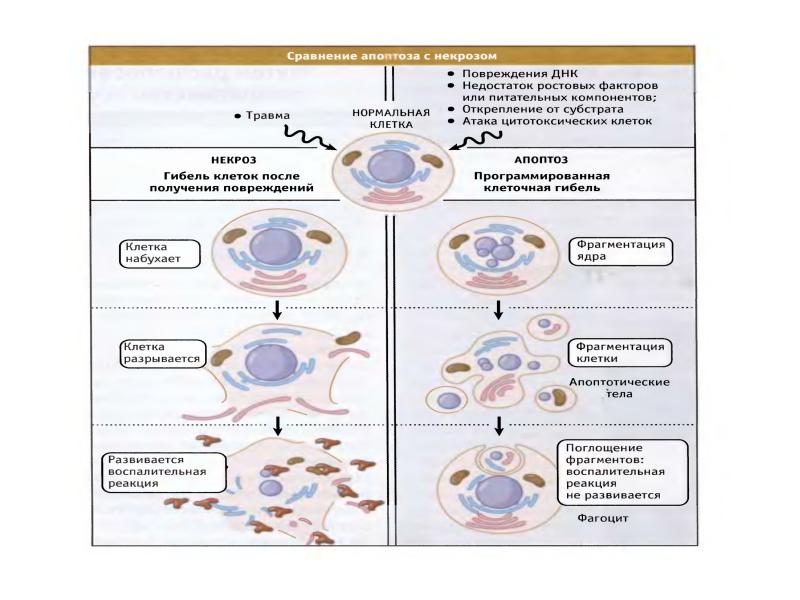
- 14. Сравнение апоптоза и некроза
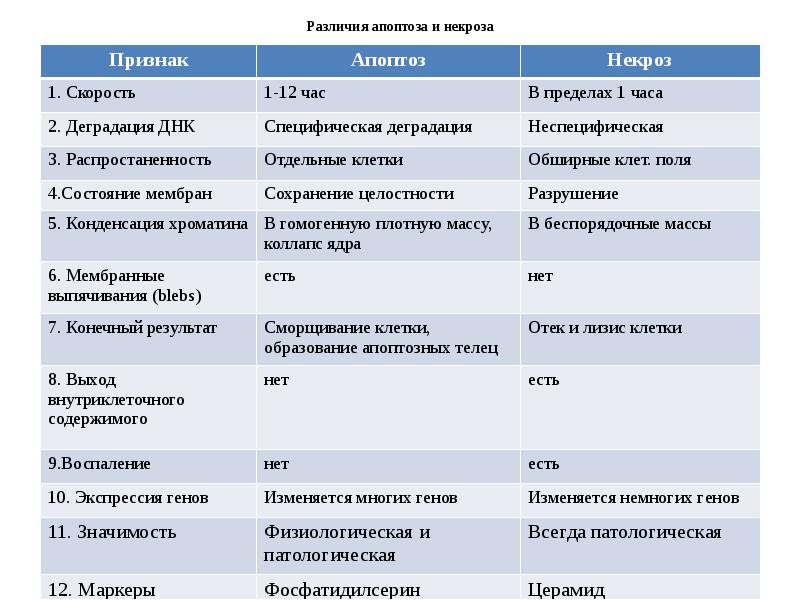
- 15. Различия апоптоза и некроза
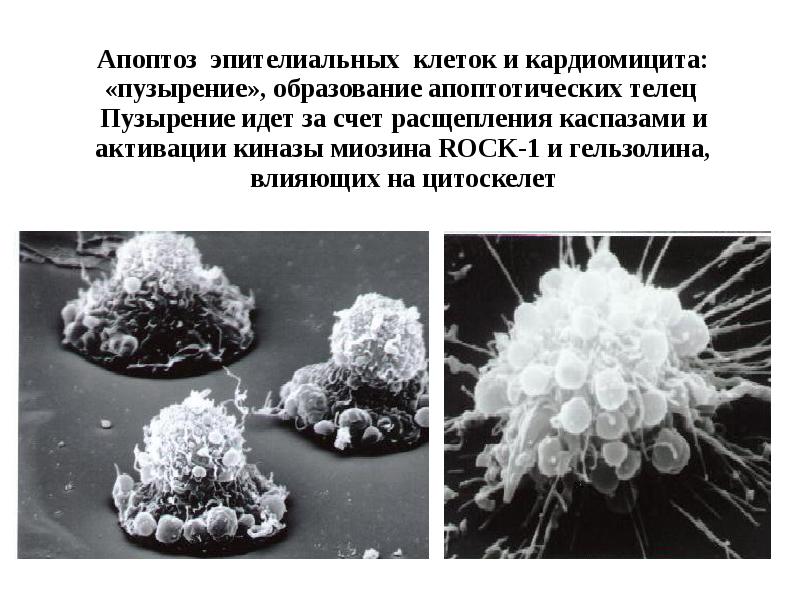
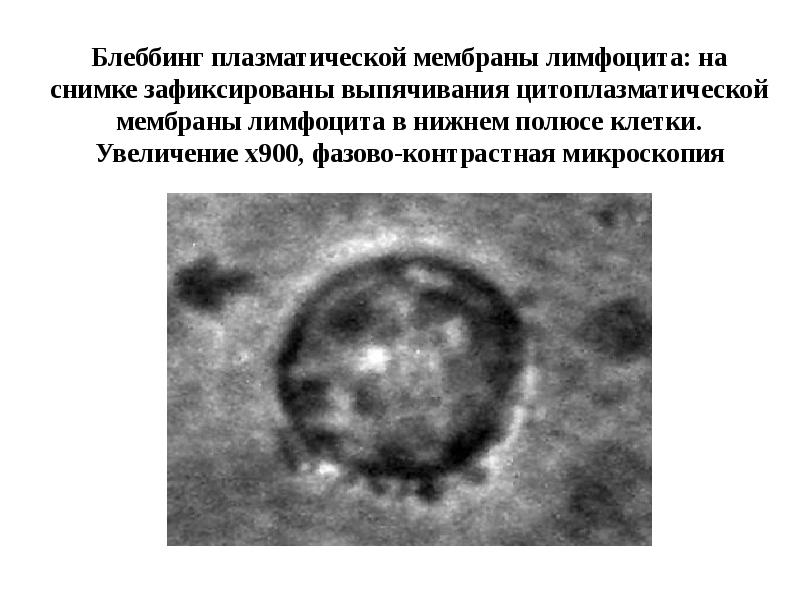
- 18. Апоптоз эпителиальных клеток и кардиомицита: «пузырение», образование апоптотических телец Пузырение идет
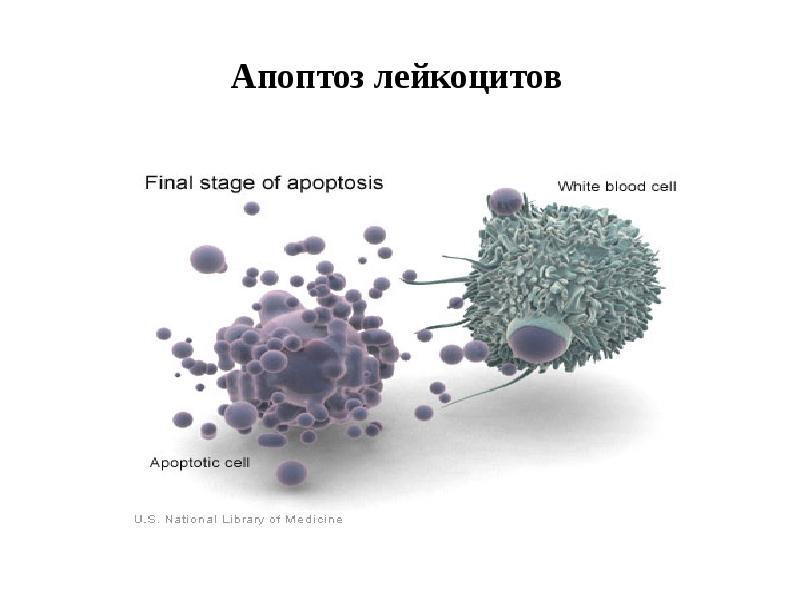
- 20. Апоптоз лейкоцитов
- 22. Роль апоптоза
- 23. Роль апоптоза
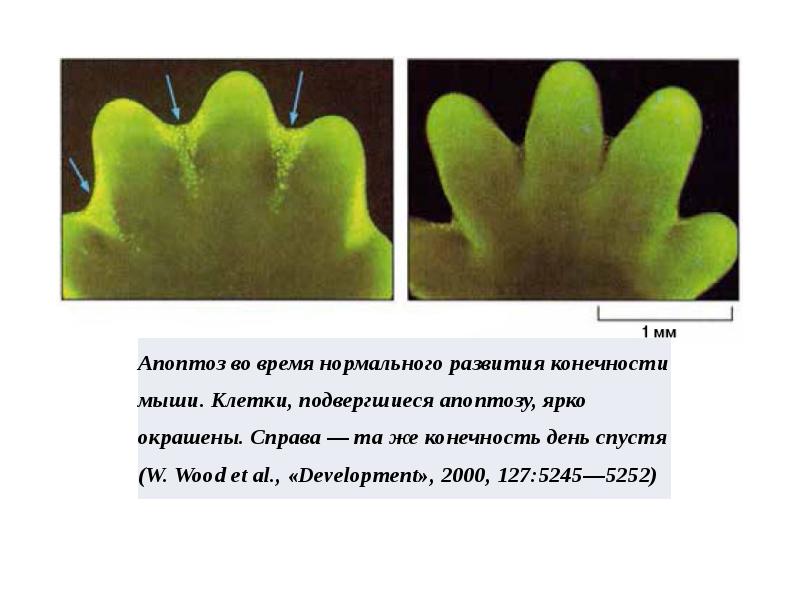
- 26. Роль апоптоза при протекании физиологических процессов: Роль апоптоза при протекании
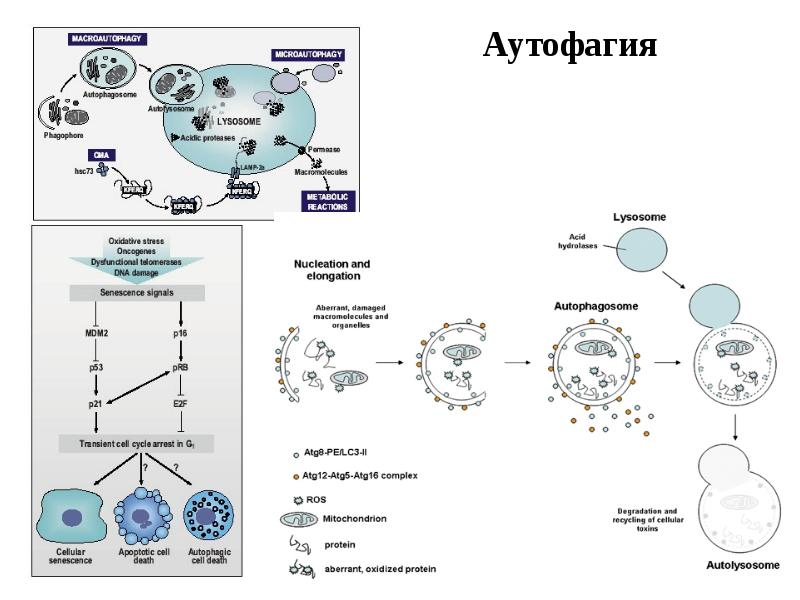
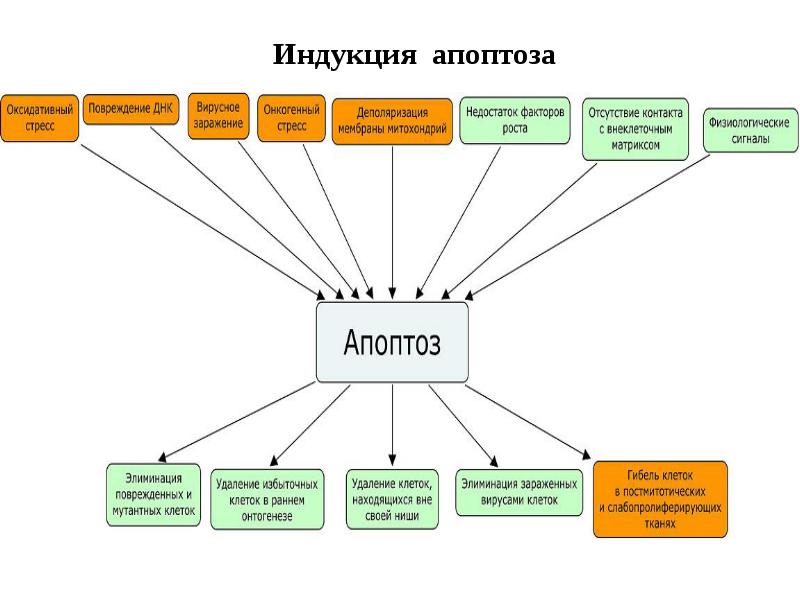
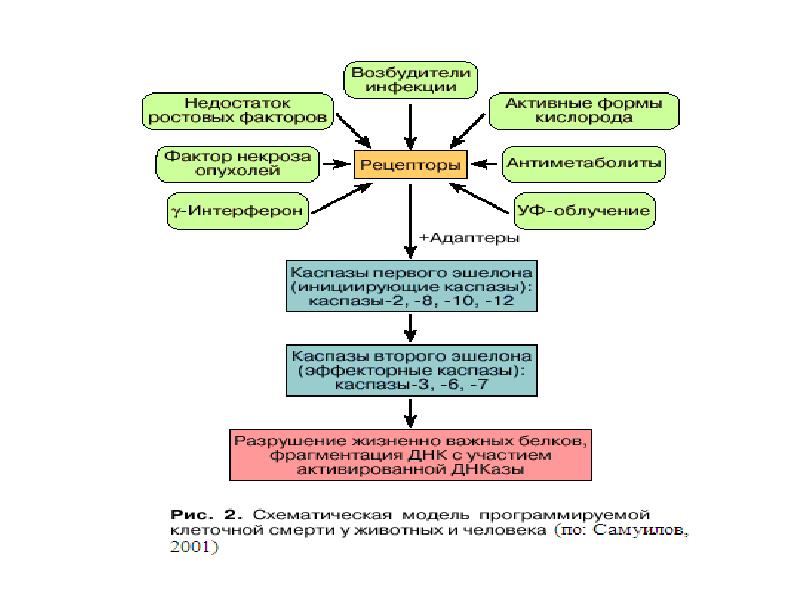
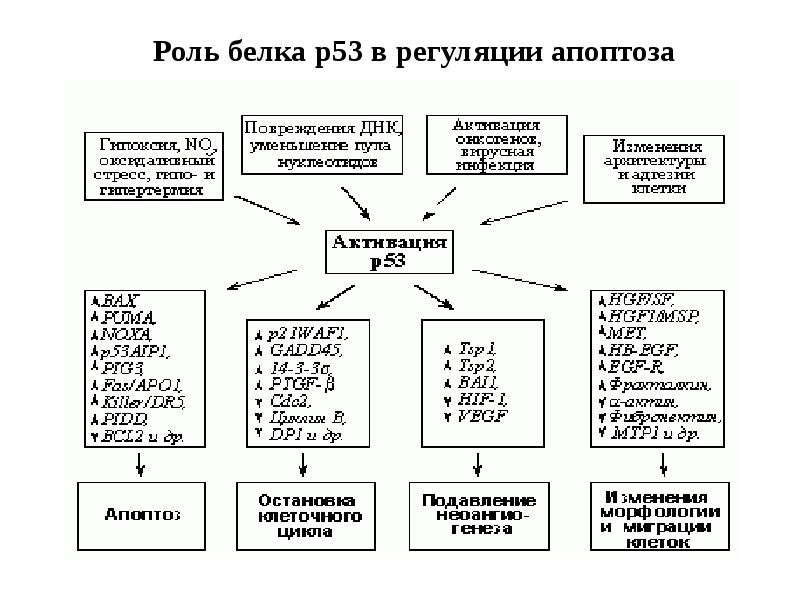
- 27. Индукция апоптоза
- 32. Стадии апоптоза 1.Индукция апоптоза: рецепция сигнала и начальные этапы его передачи
- 33. Индукция апоптоза : Главные пути: 1.Митохондриальный ( внутренний) путь, приводящий к
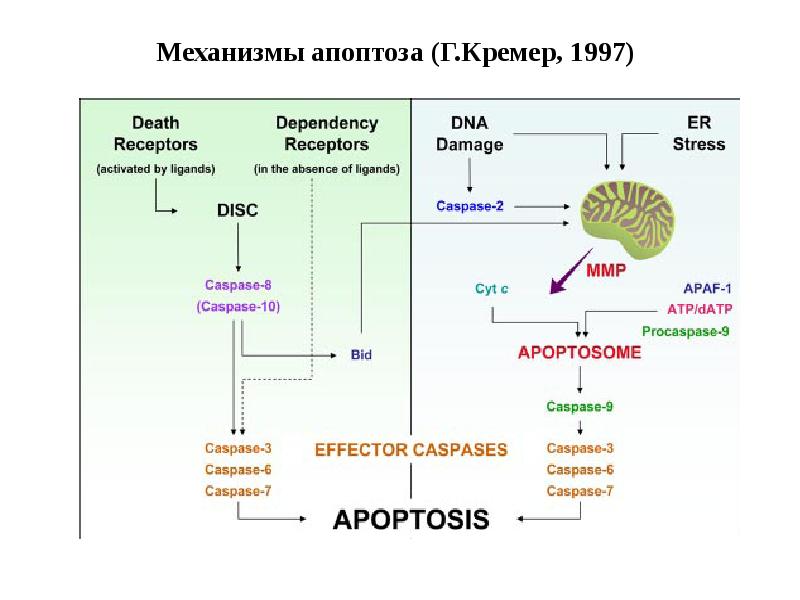
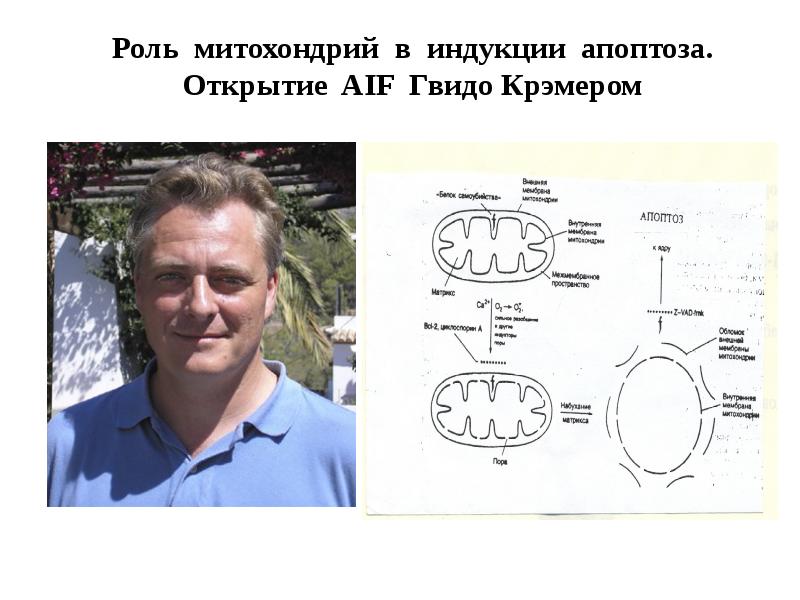
- 34. Механизмы апоптоза (Г.Кремер, 1997)
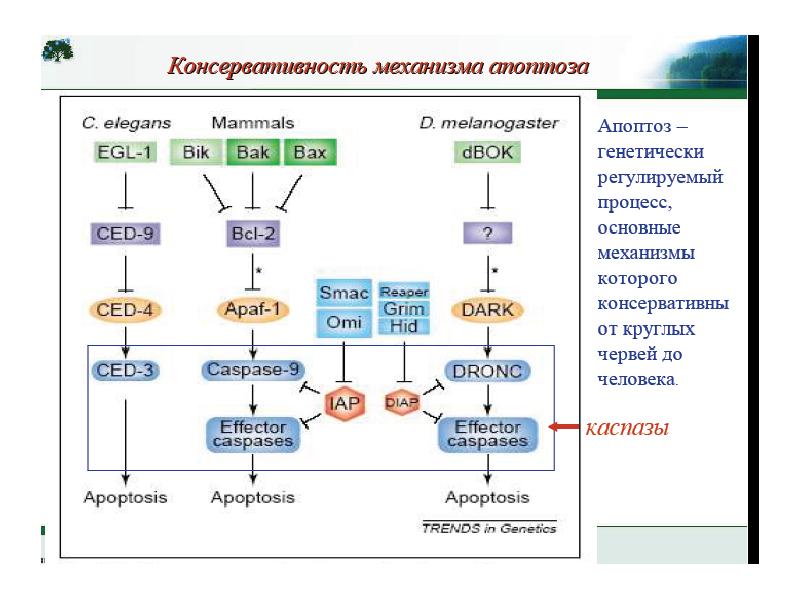
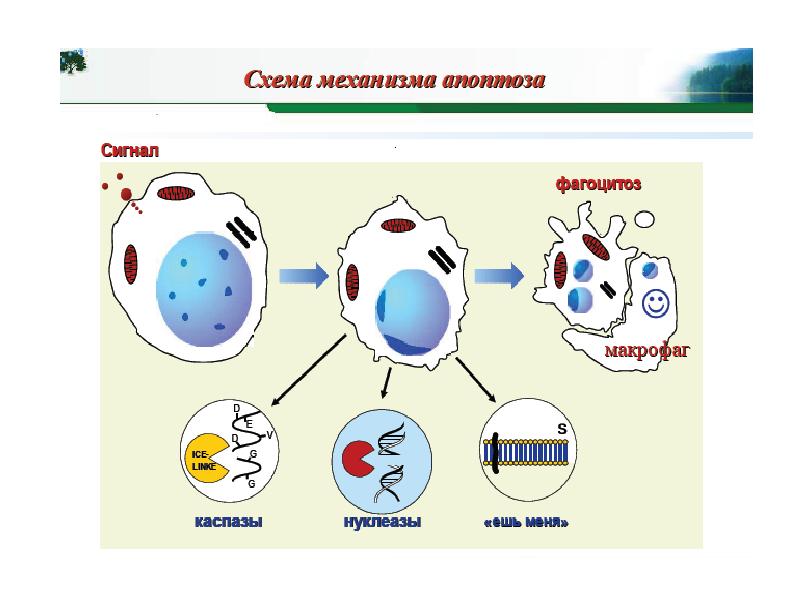
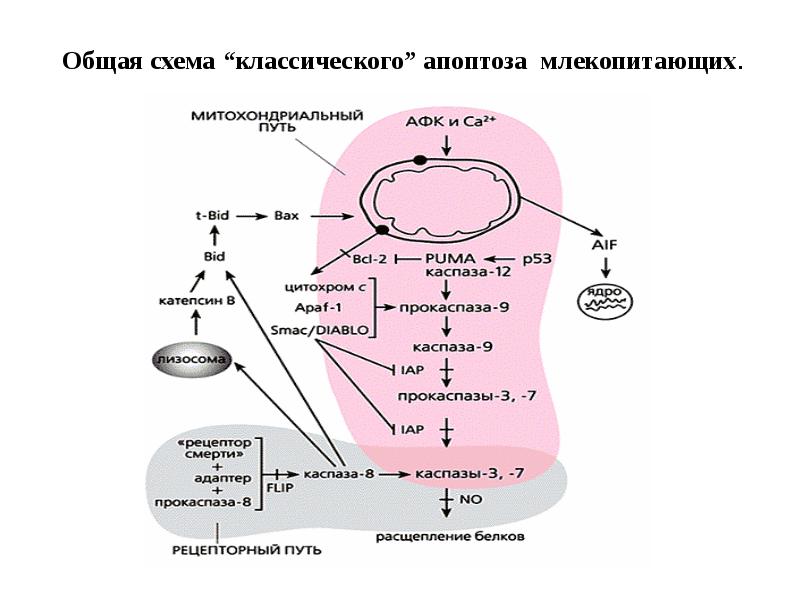
- 35. Общая схема “классического” апоптоза млекопитающих.
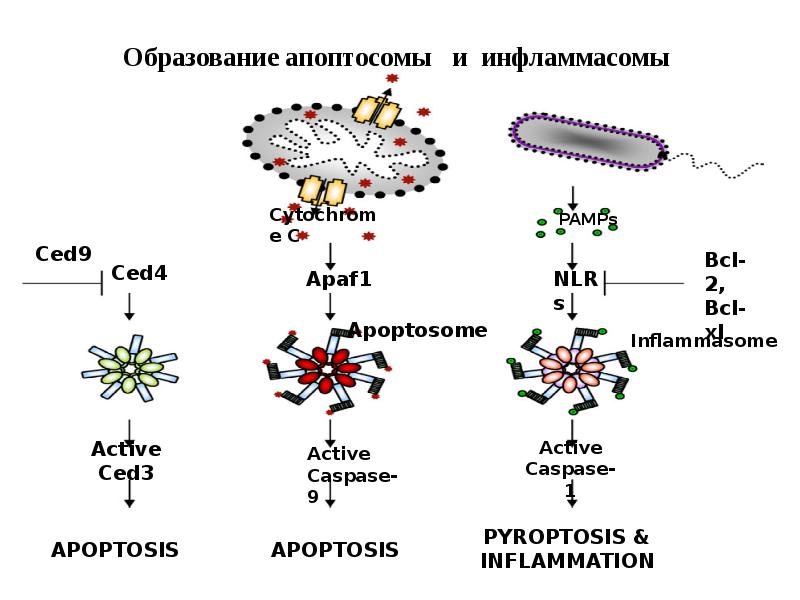
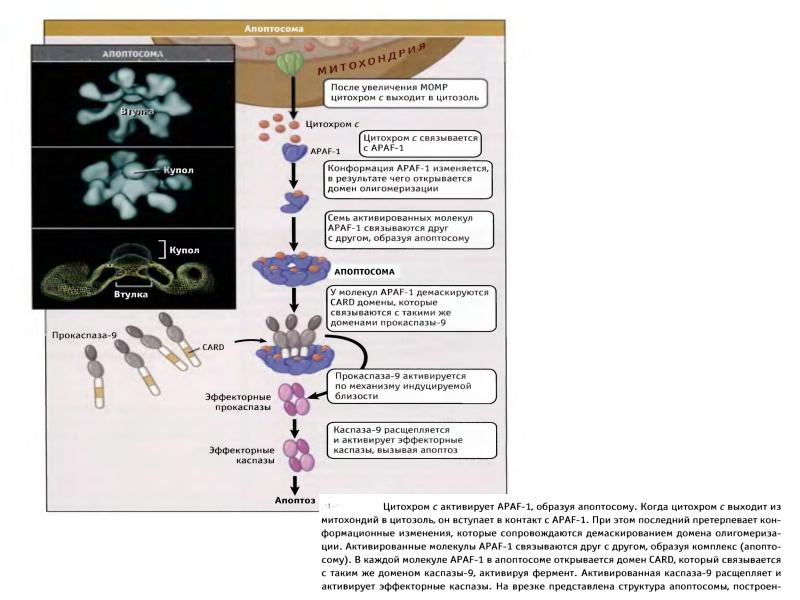
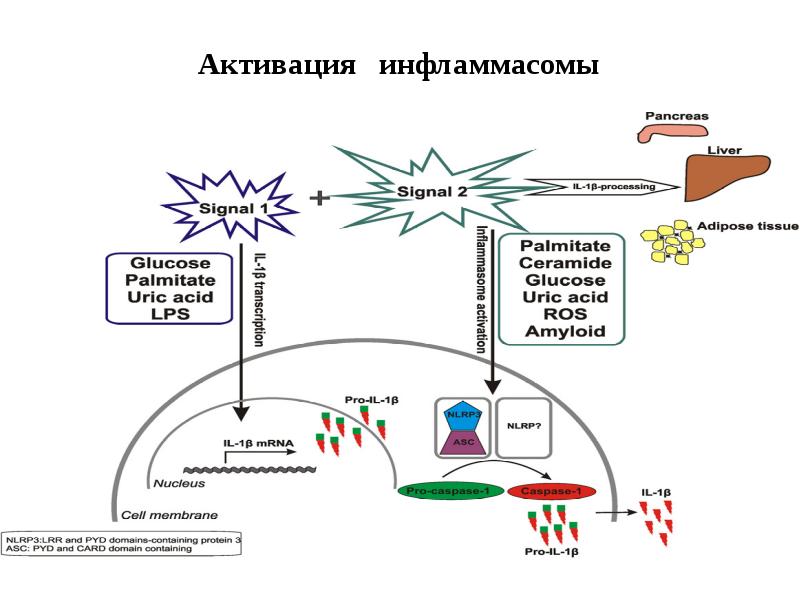
- 38. Образование апоптосомы и инфламмасомы
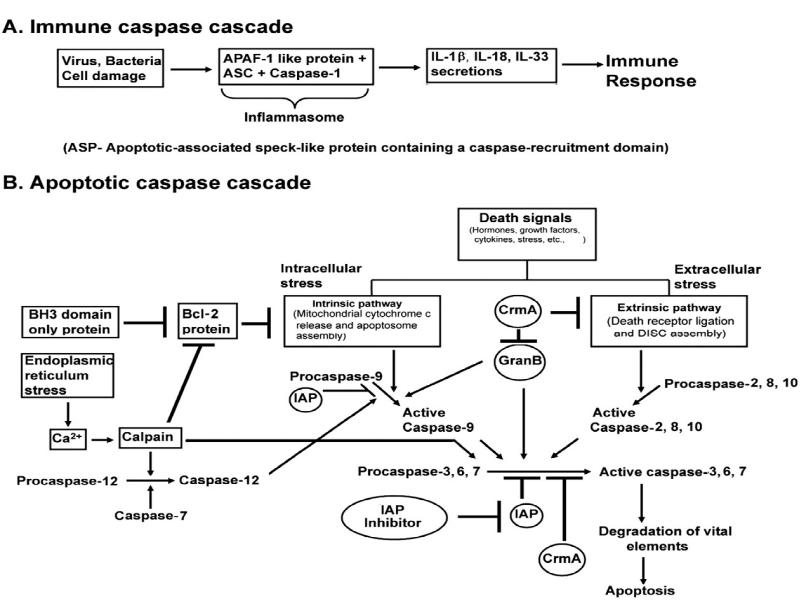
- 39. Общая характеристика каспаз: Каспазы – цистеин содержащие специфические протеазы, расщепляющие субстраты
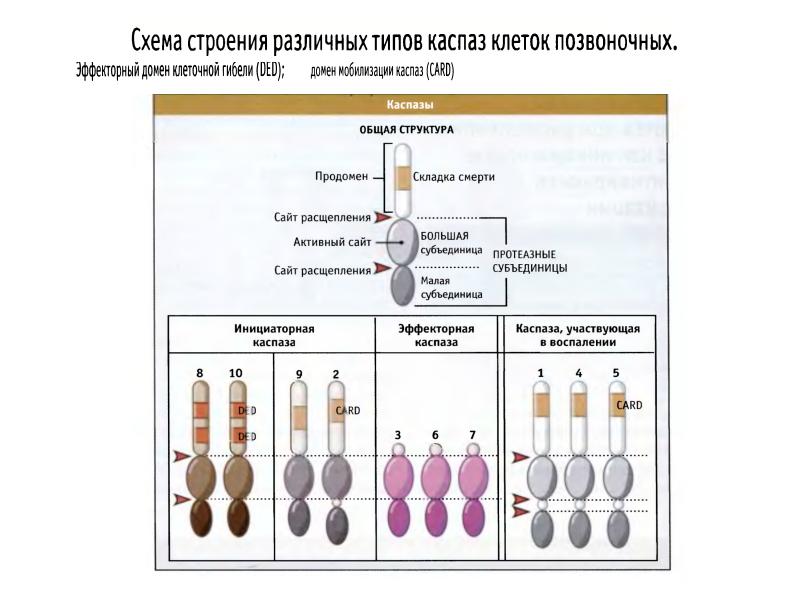
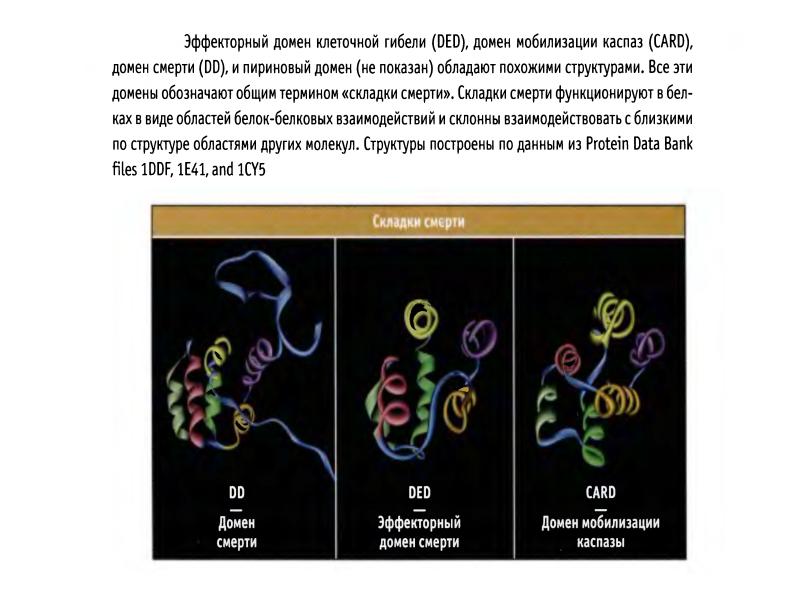
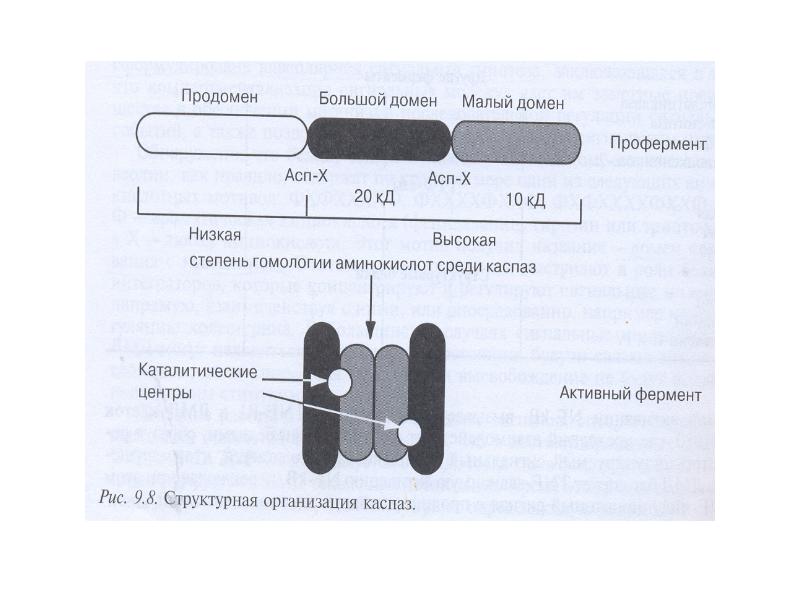
- 41. Структура каспаз Прокаспазы представлены мономерами, которые содержат 3 домена: N-концевой
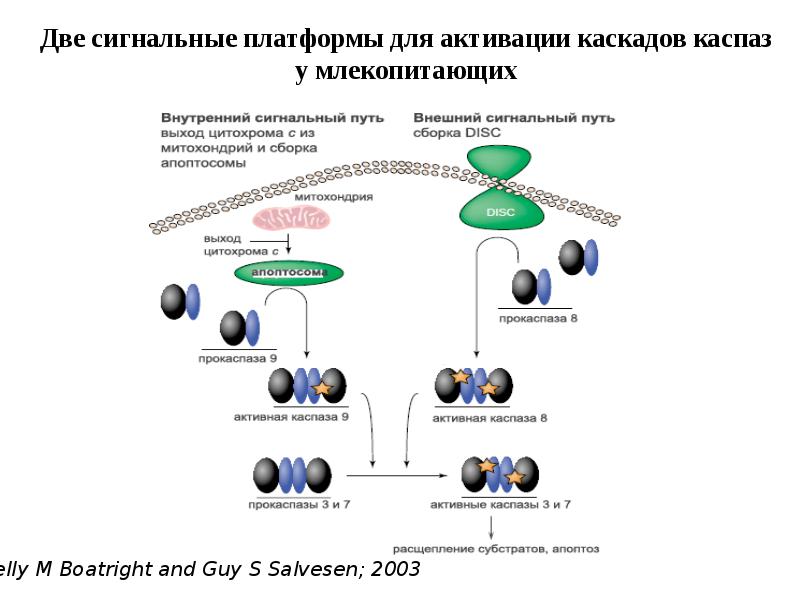
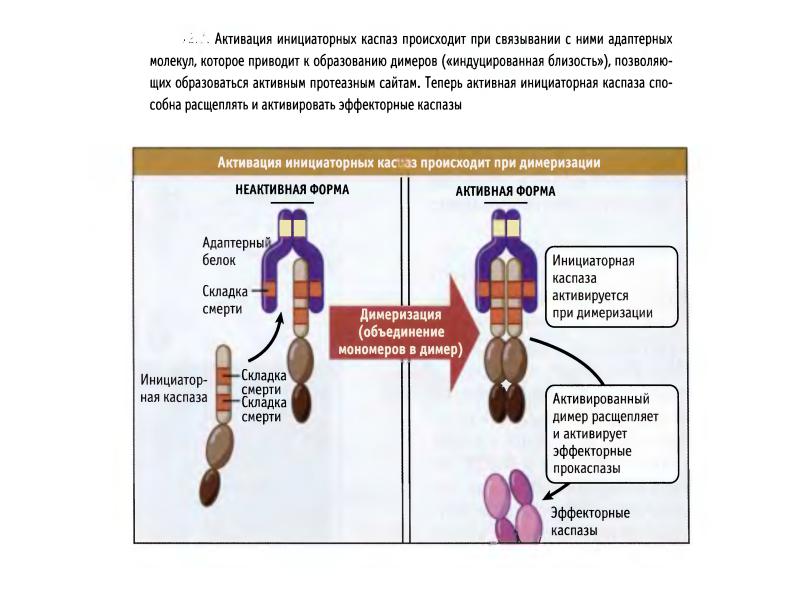
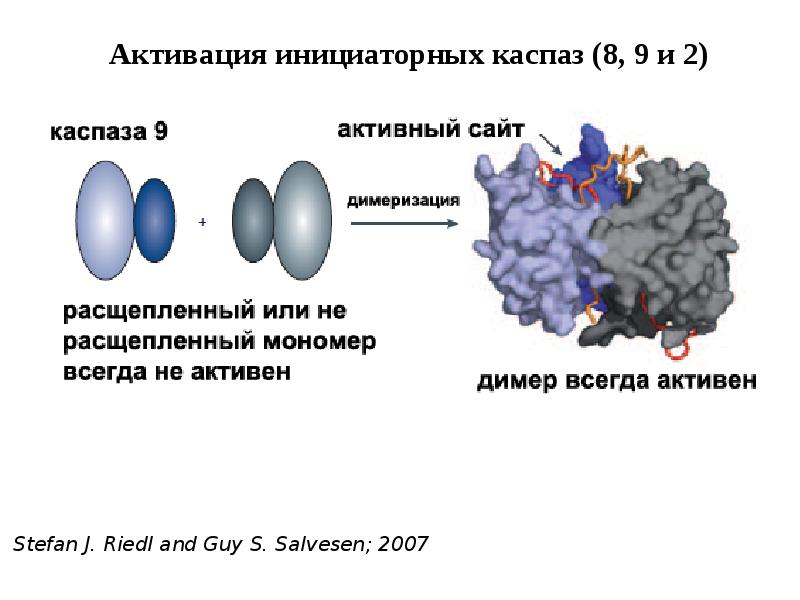
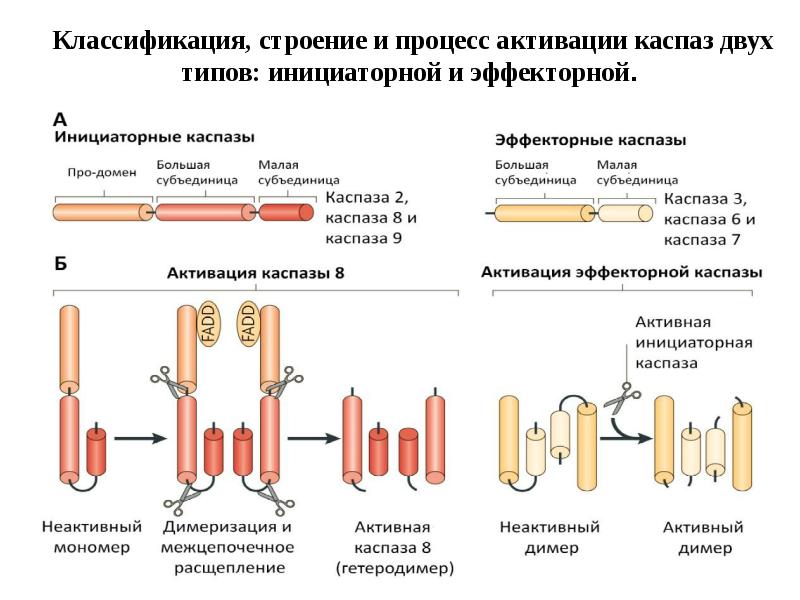
- 44. Активация инициаторных каспаз происходит по механизму индуцированного сближения 1. Инициаторные каспазы
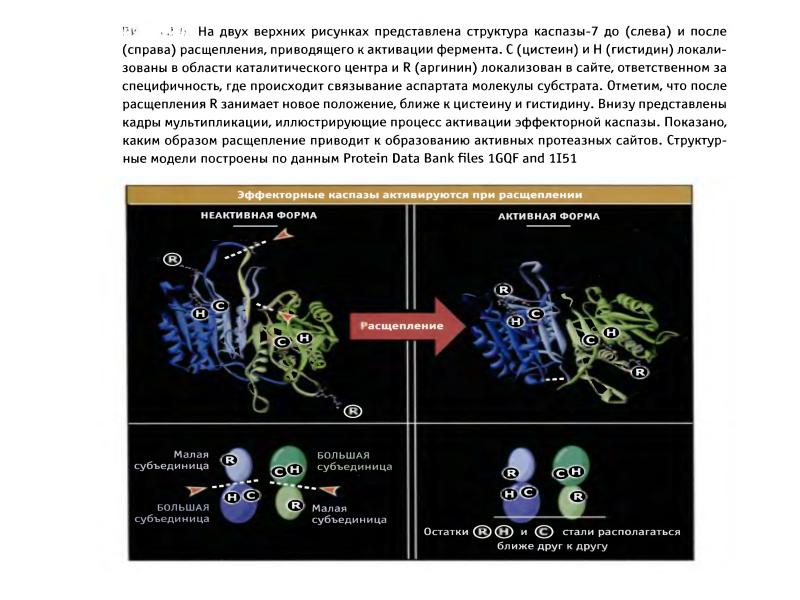
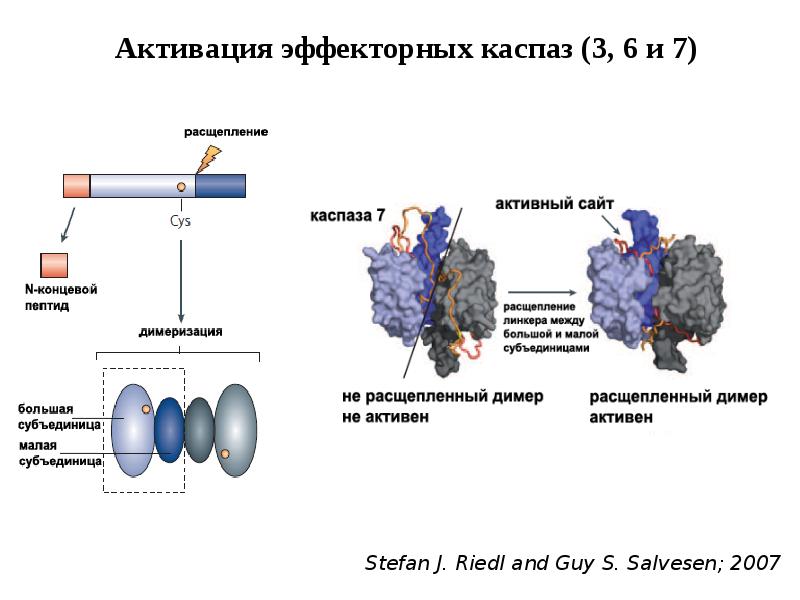
- 47. Активация эффекторных каспаз 1.Эффекторные каспазы (-7,-3,-6) присутствуют в клетках в виде
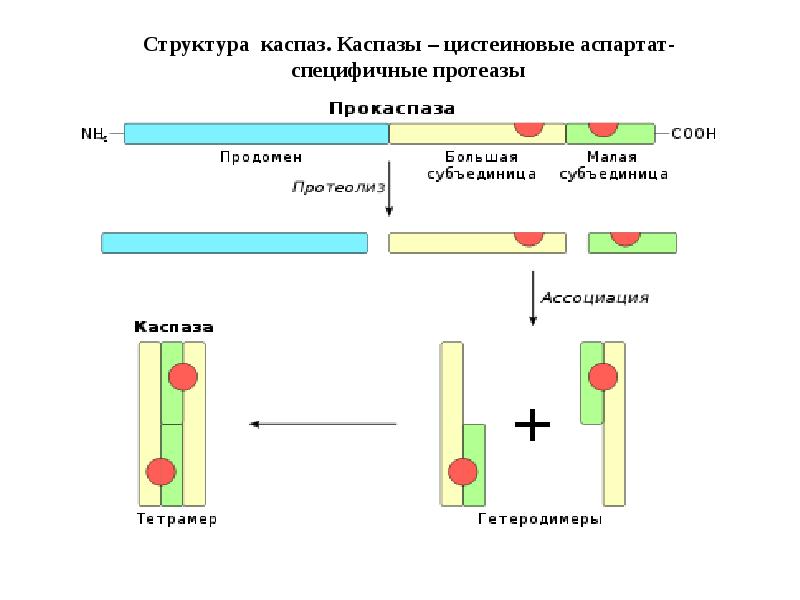
- 50. Структура каспаз. Каспазы – цистеиновые аспартат-специфичные протеазы
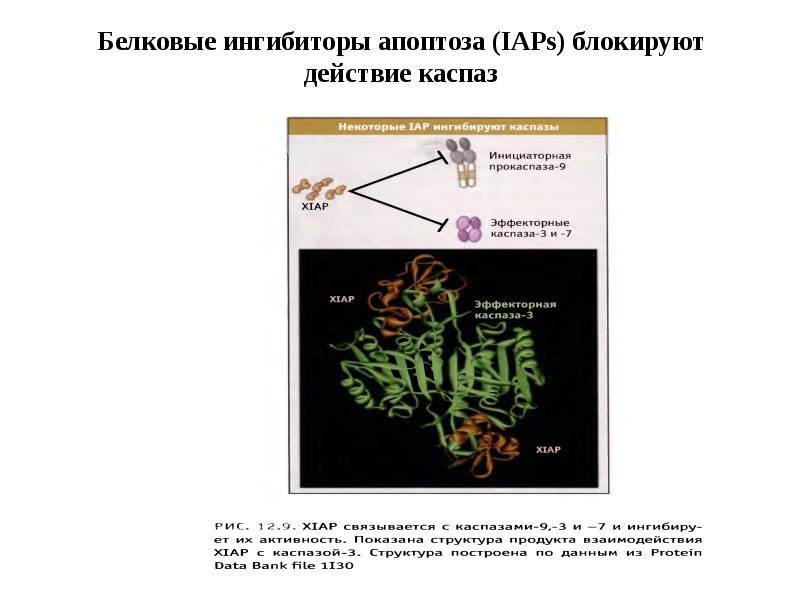
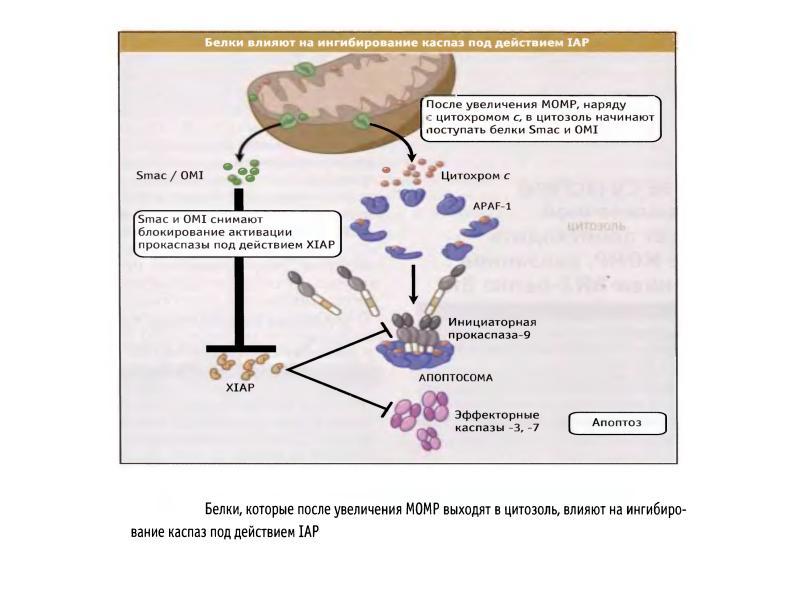
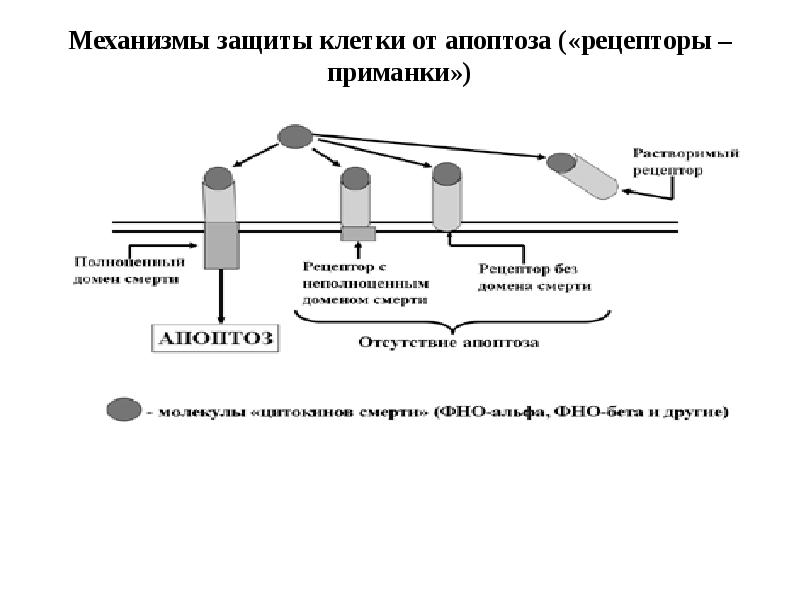
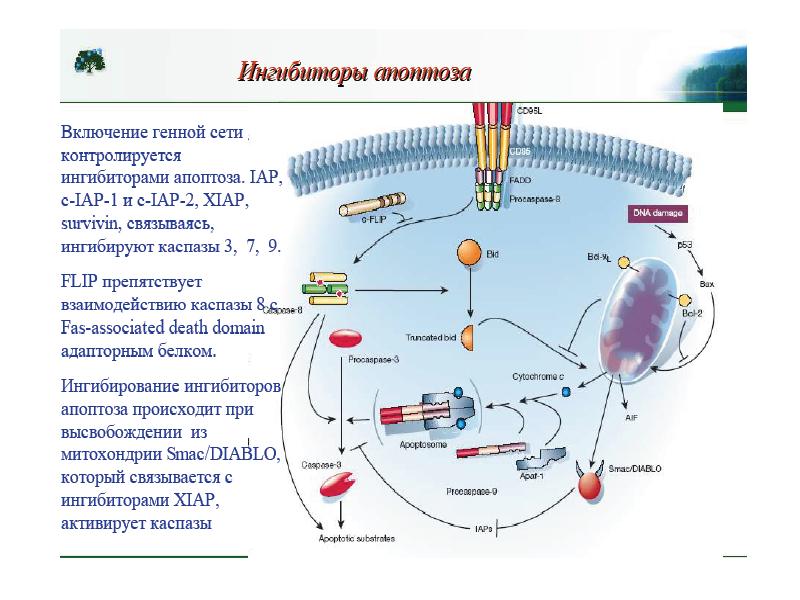
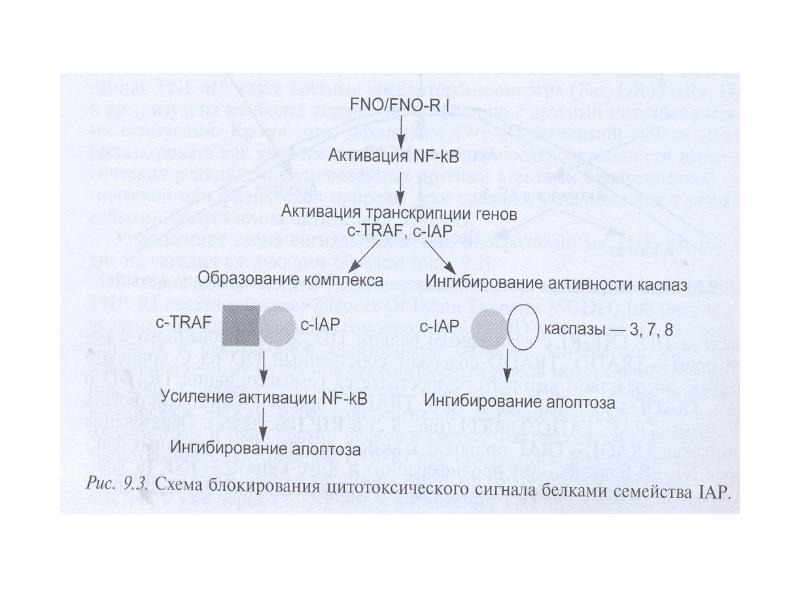
- 56. Белковые ингибиторы апоптоза (IAPs) блокируют действие каспаз
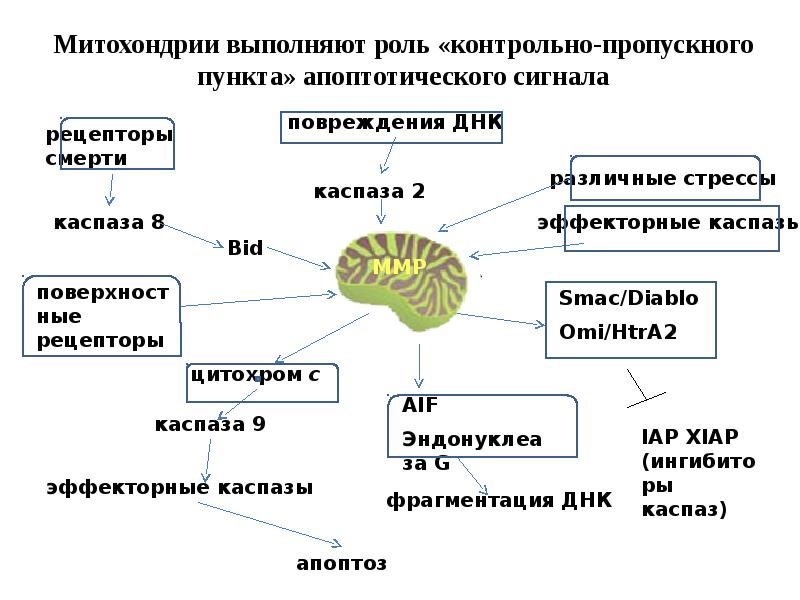
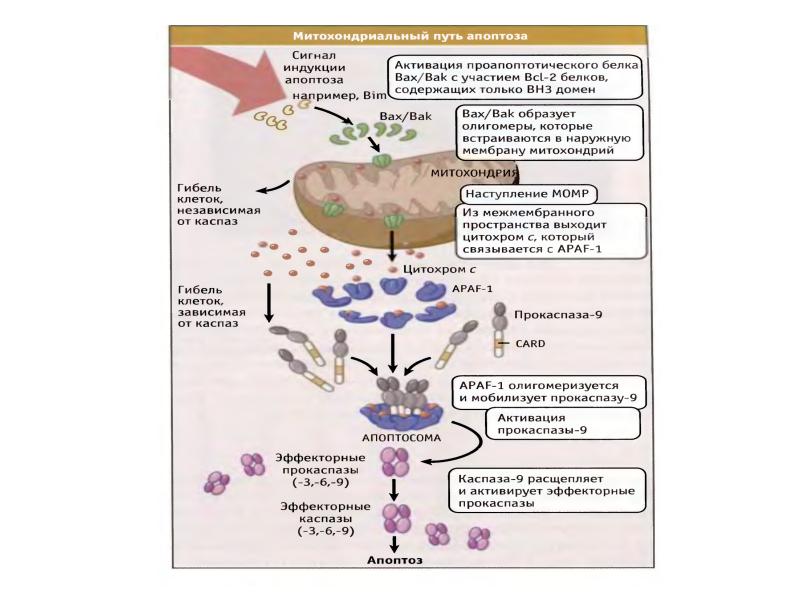
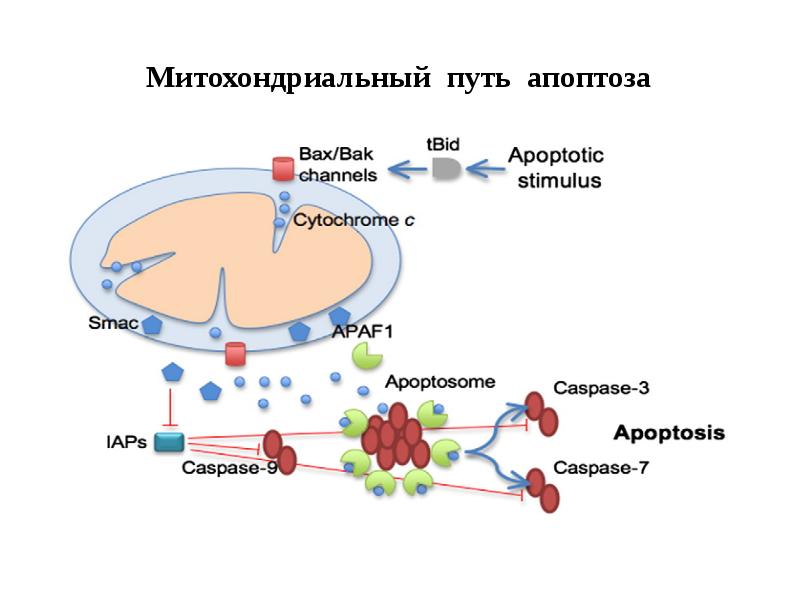
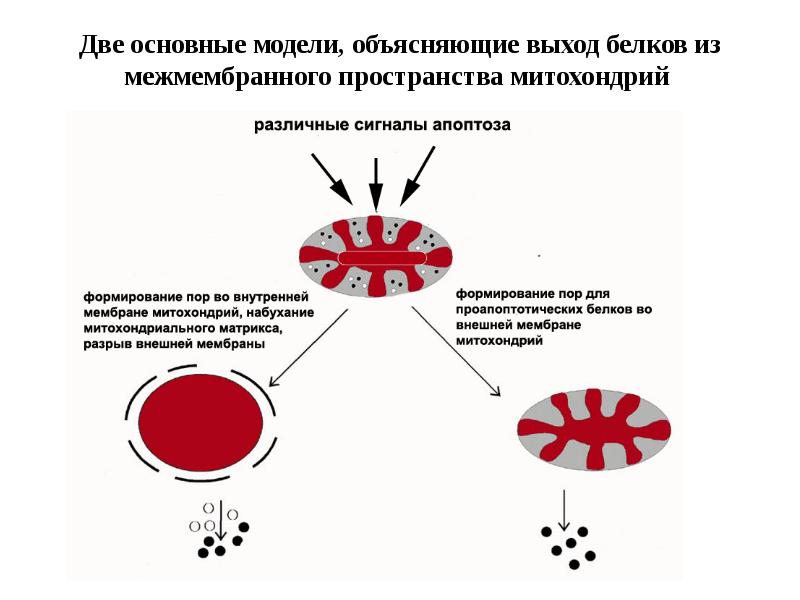
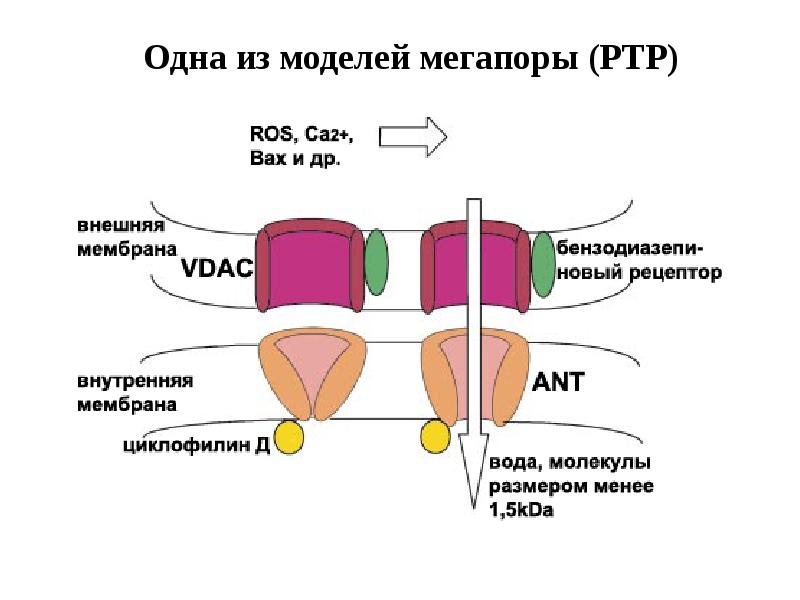
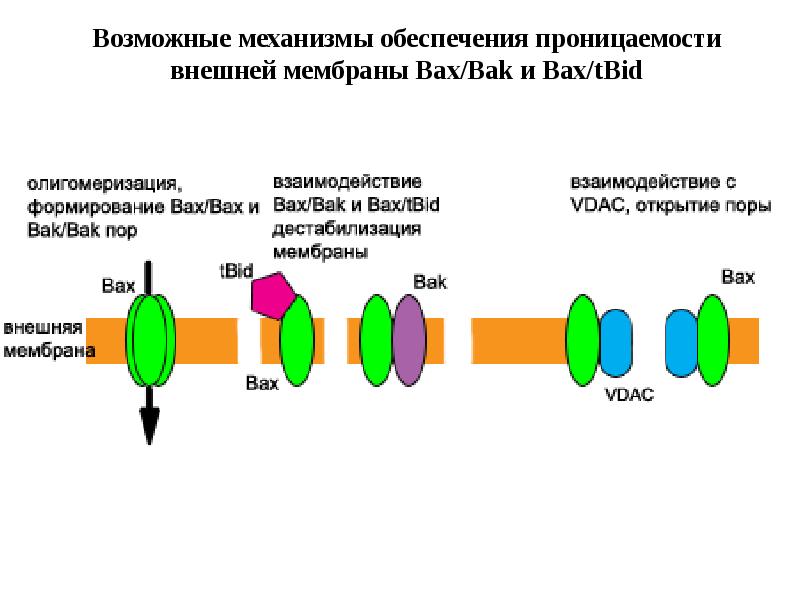
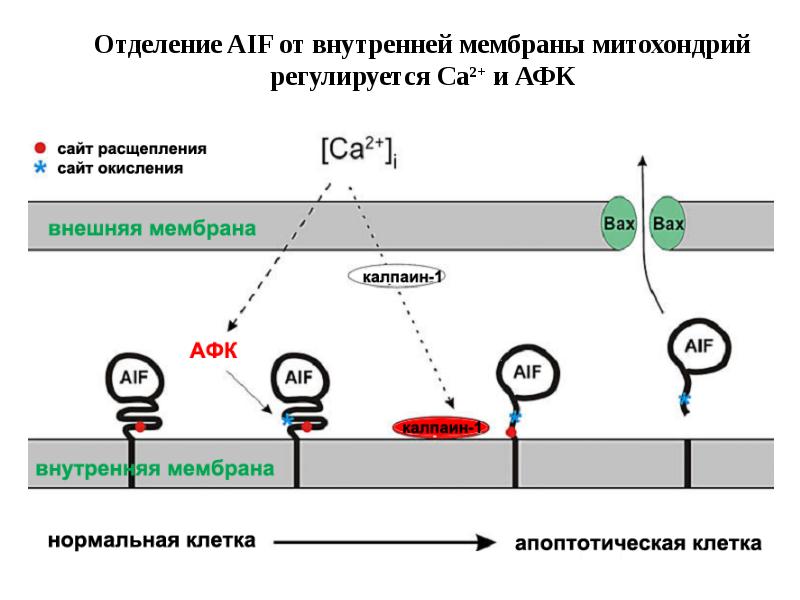
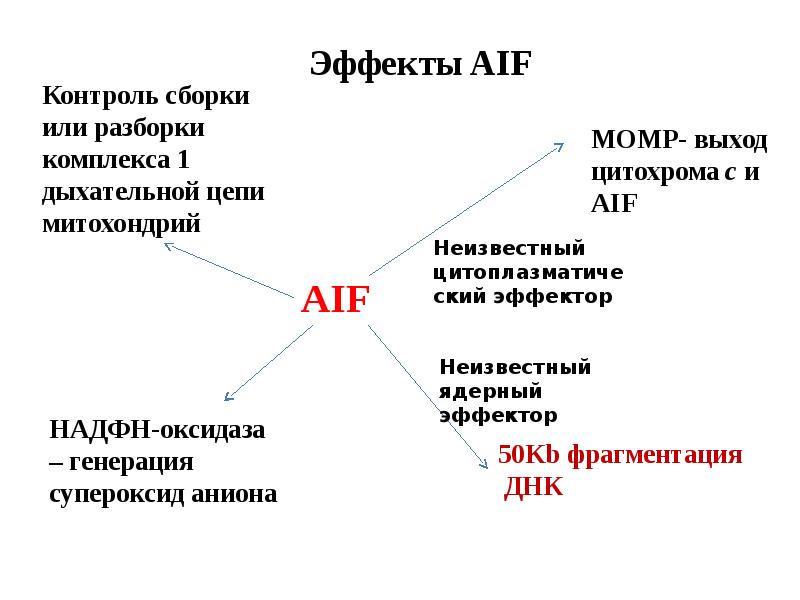
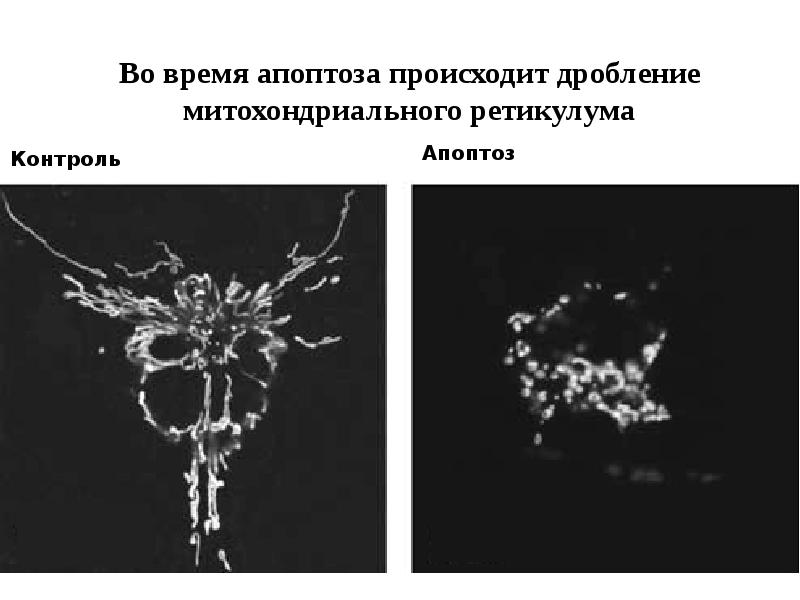
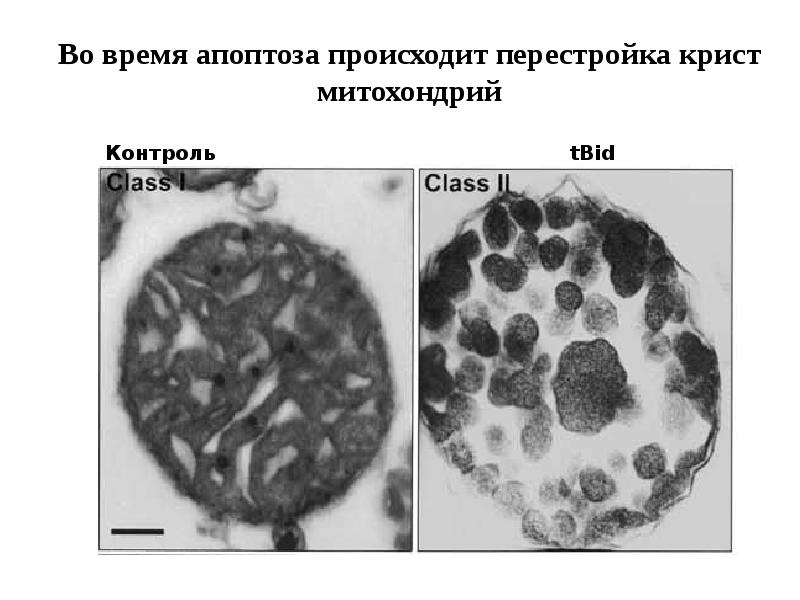
- 61. Митохондриальный путь апоптоза
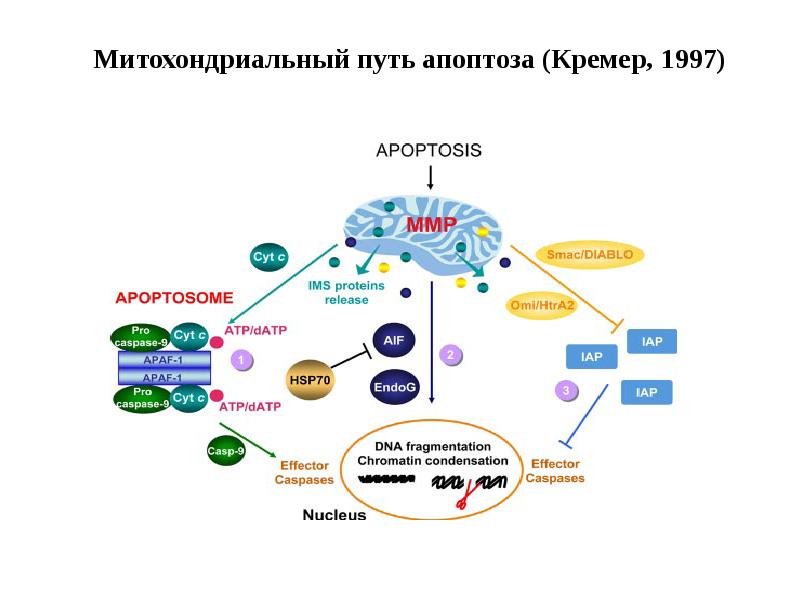
- 62. Митохондриальный путь апоптоза (Кремер, 1997)
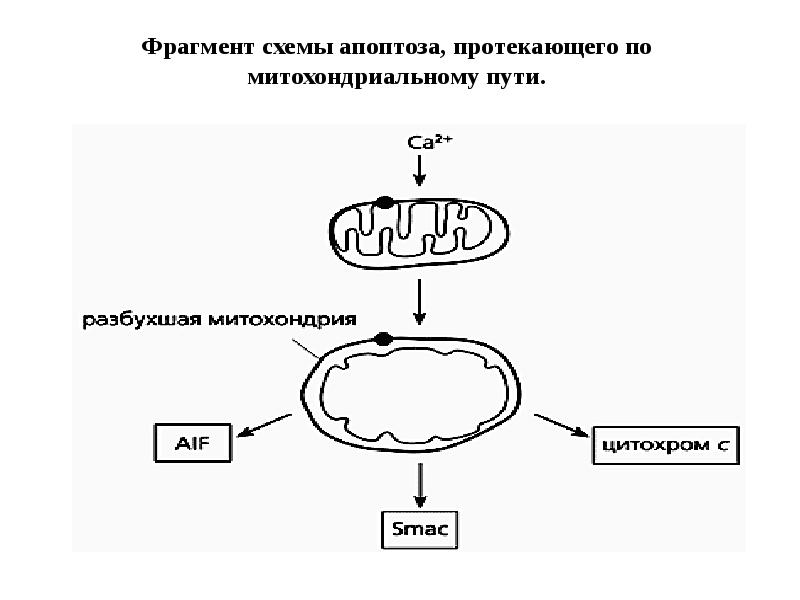
- 64. Фрагмент схемы апоптоза, протекающего по митохондриальному пути.
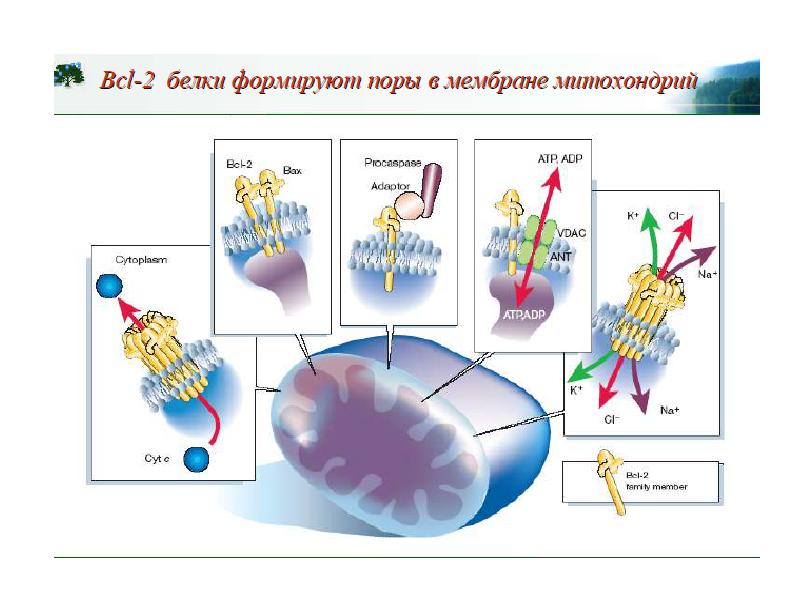
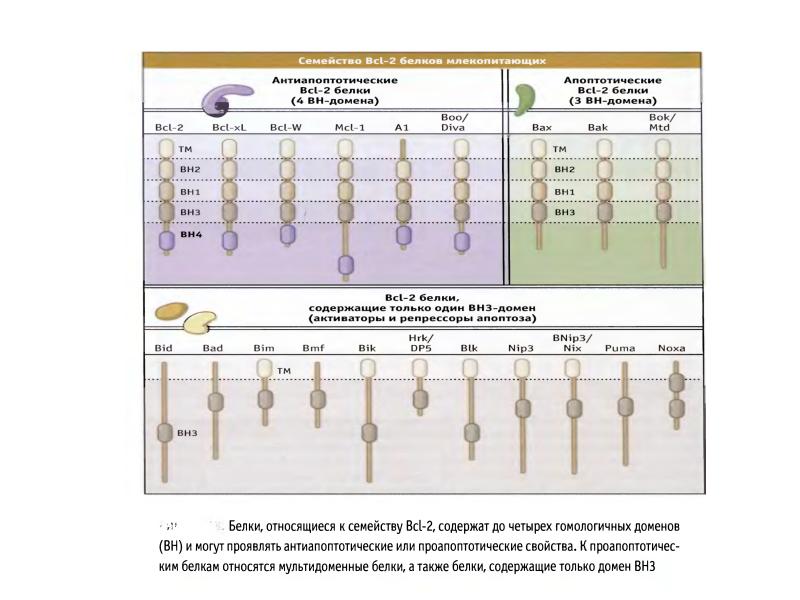
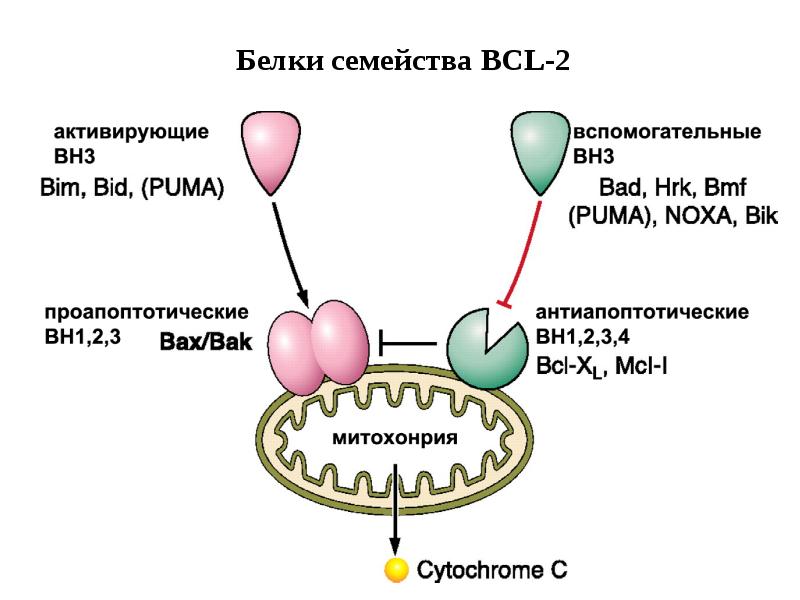
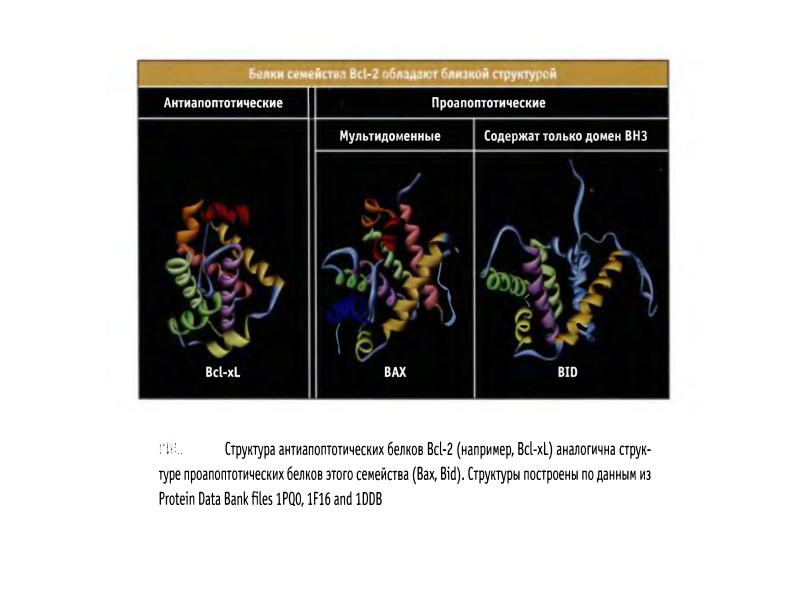
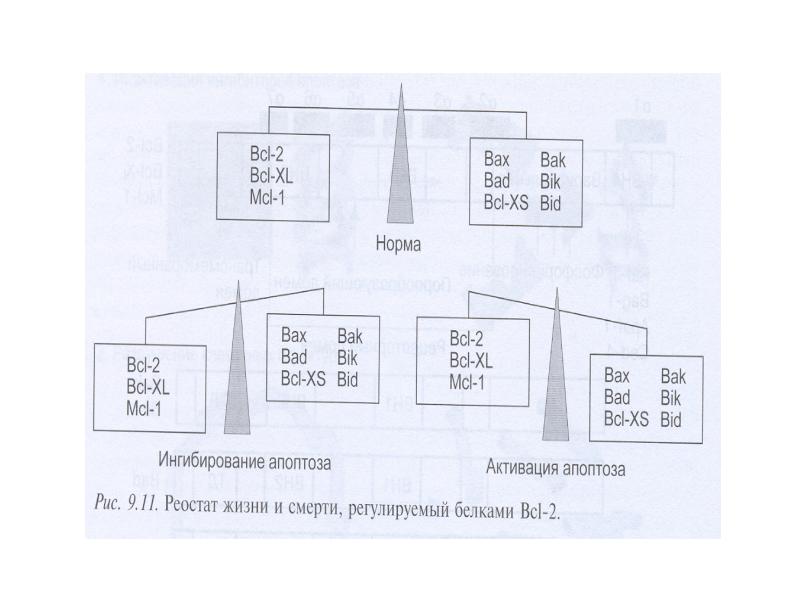
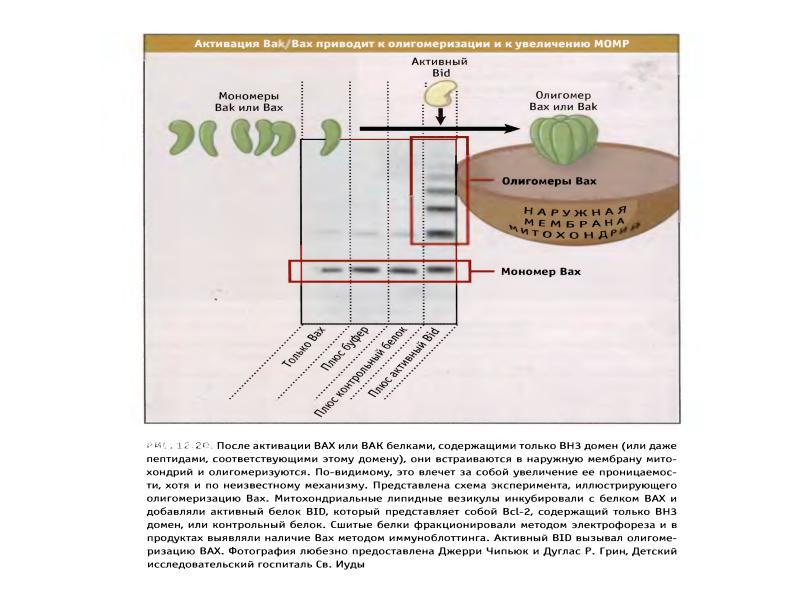
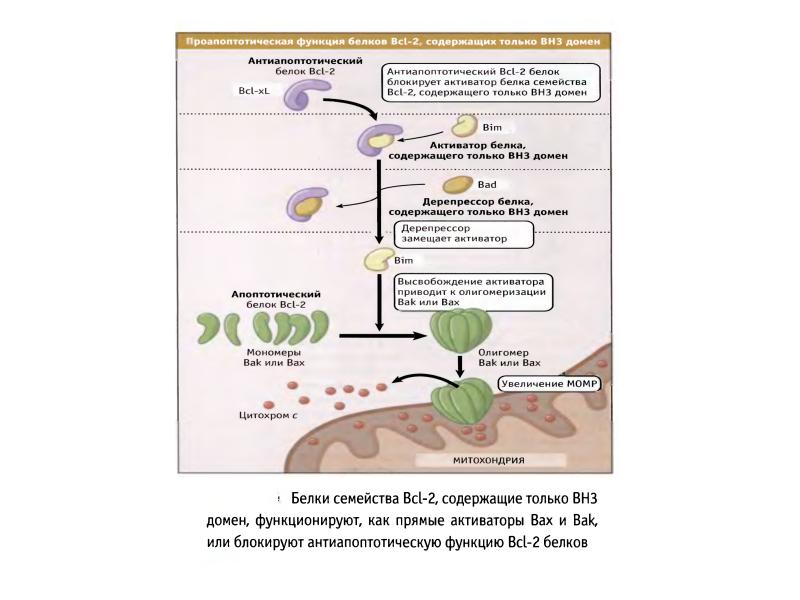
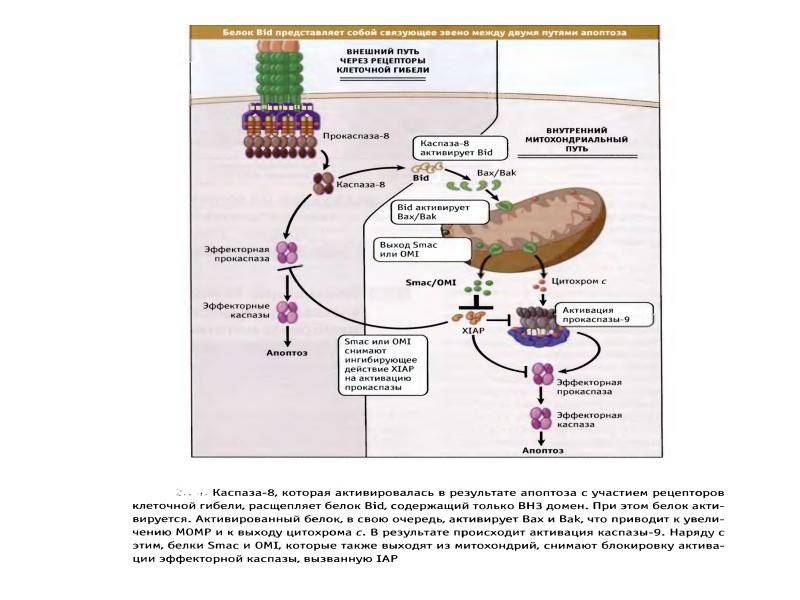
- 70. Белки сем Bcl-2 участвуют в апоптозе Белки сем.Bcl-2 играют главную роль
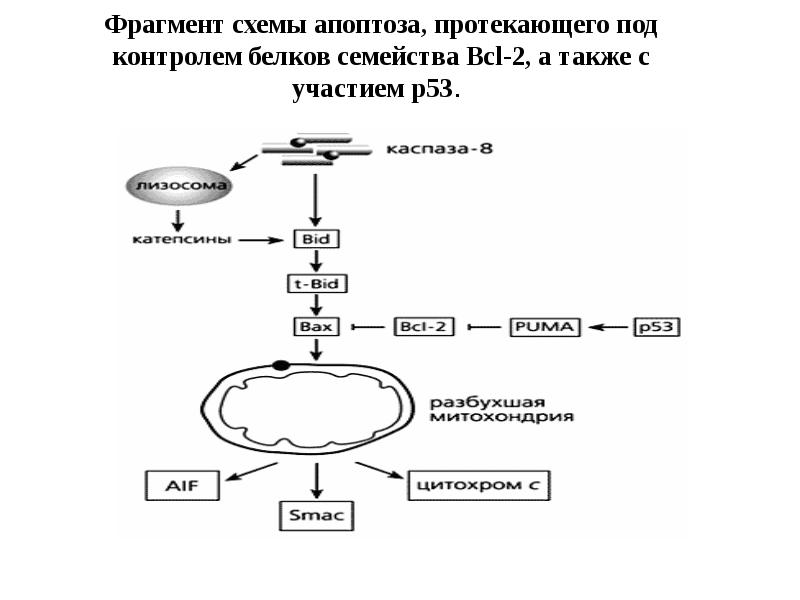
- 81. Фрагмент схемы апоптоза, протекающего под контролем белков семейства Bcl-2, а также
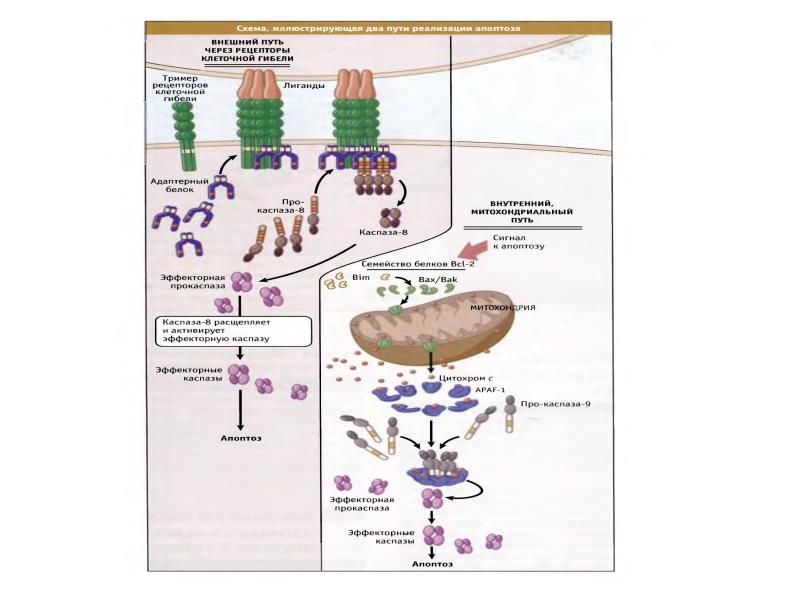
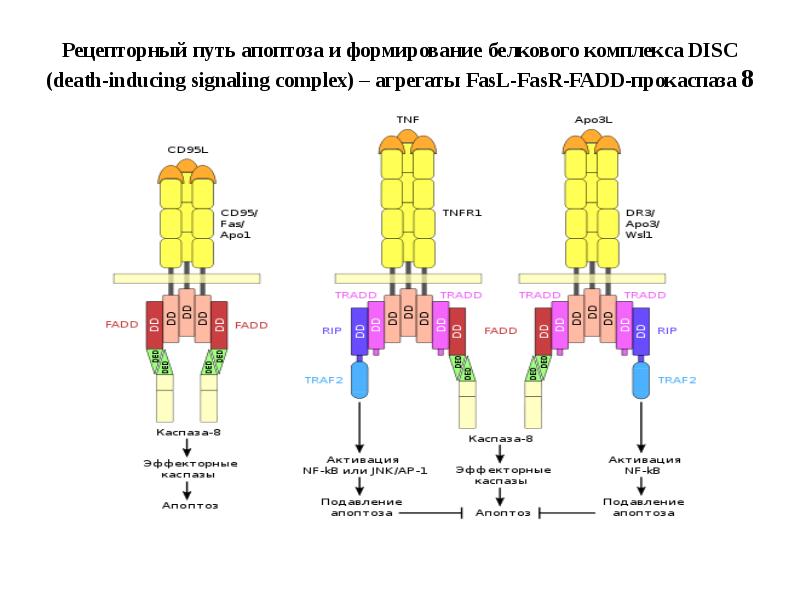
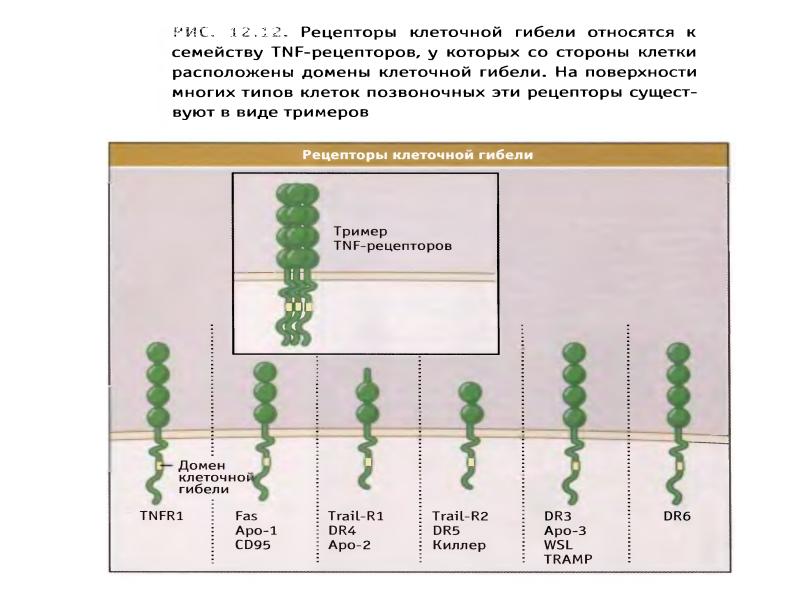
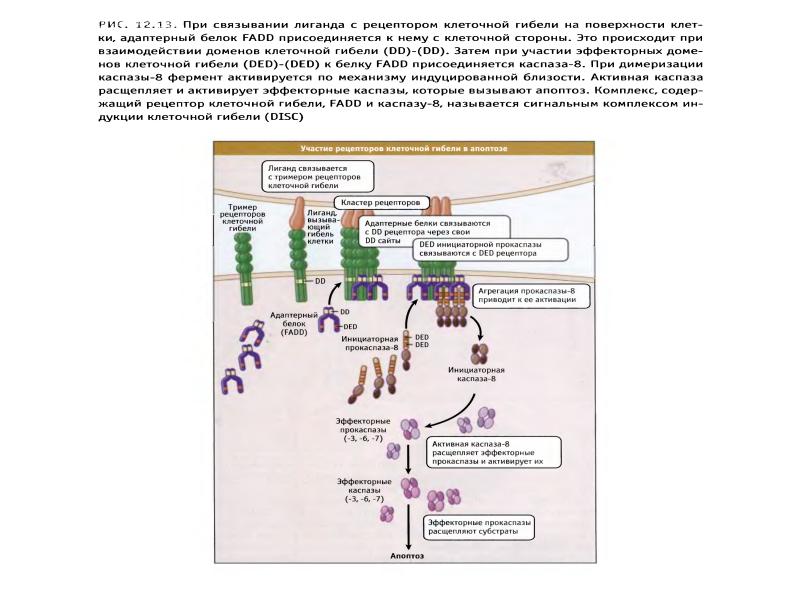
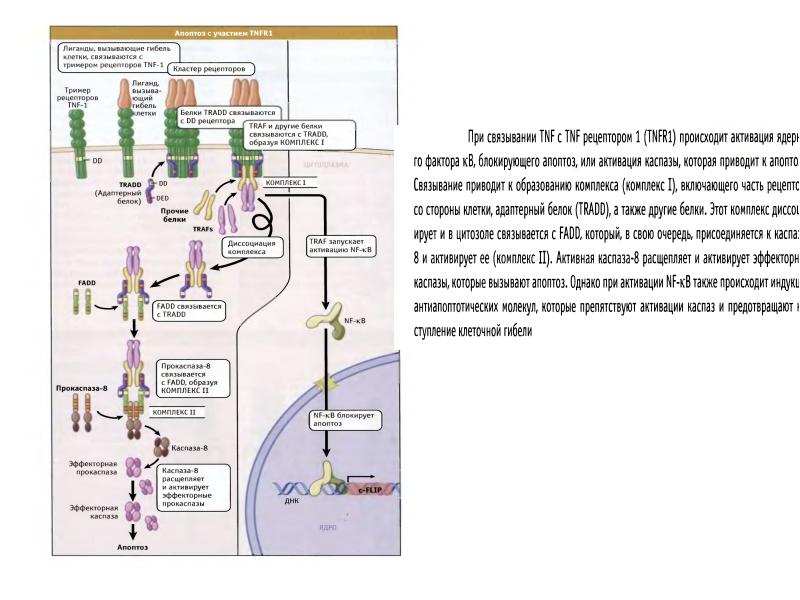
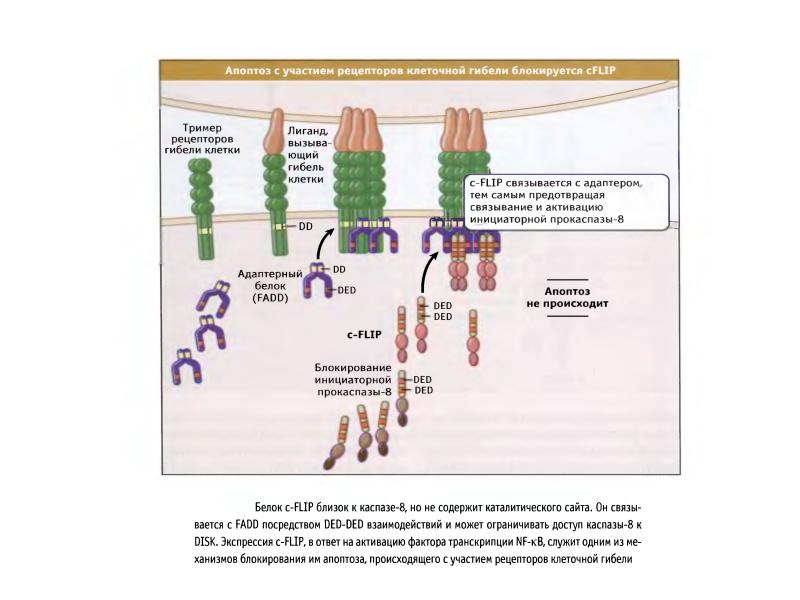
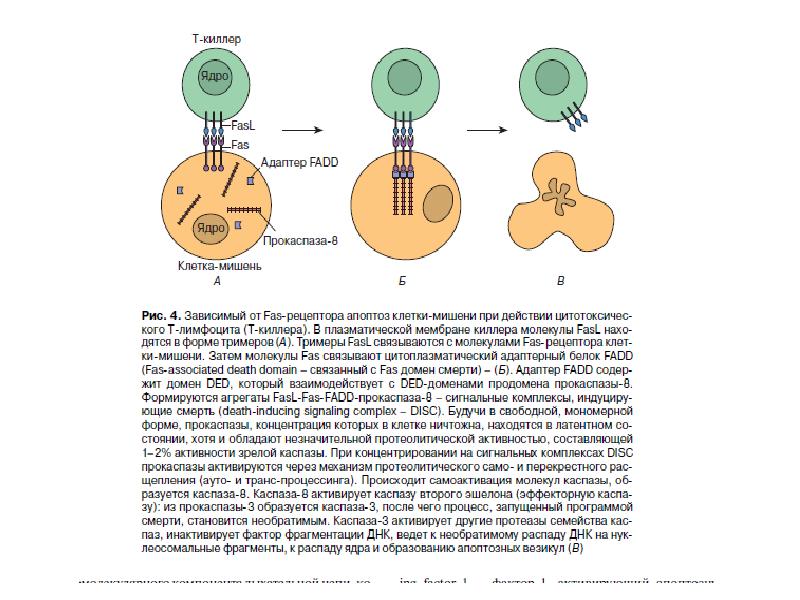
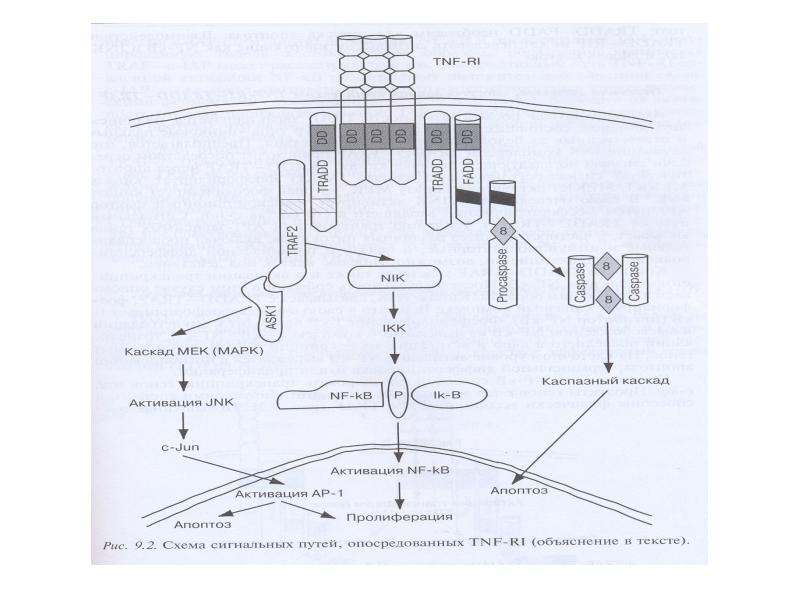
- 89. Рецепторный путь апоптоза и формирование белкового комплекса DISC (death-inducing signaling complex)
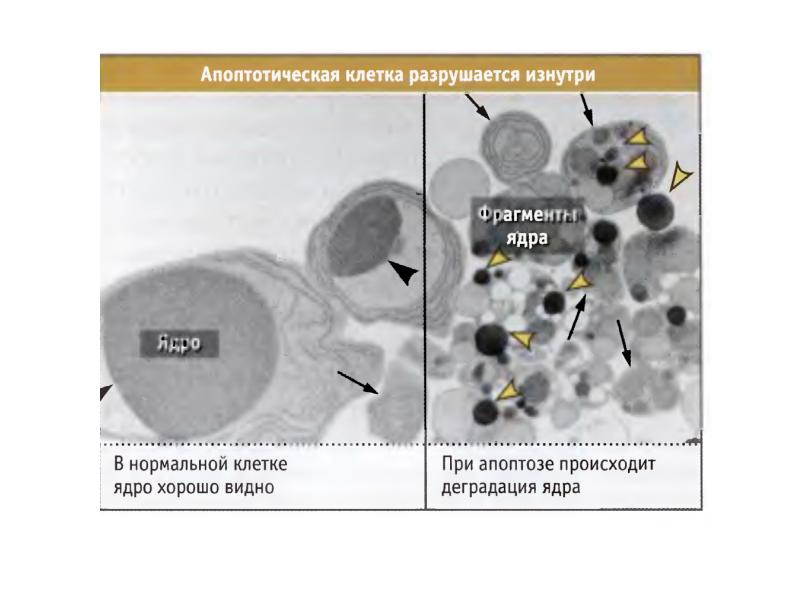
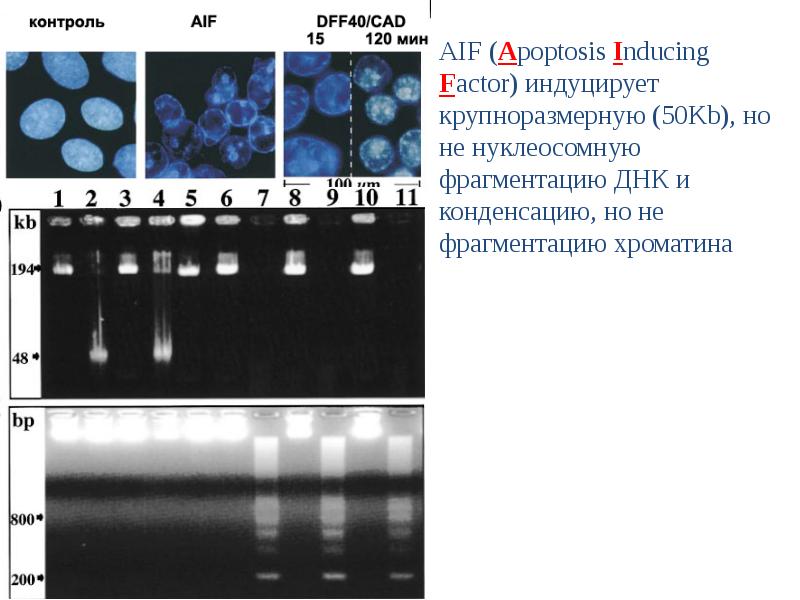
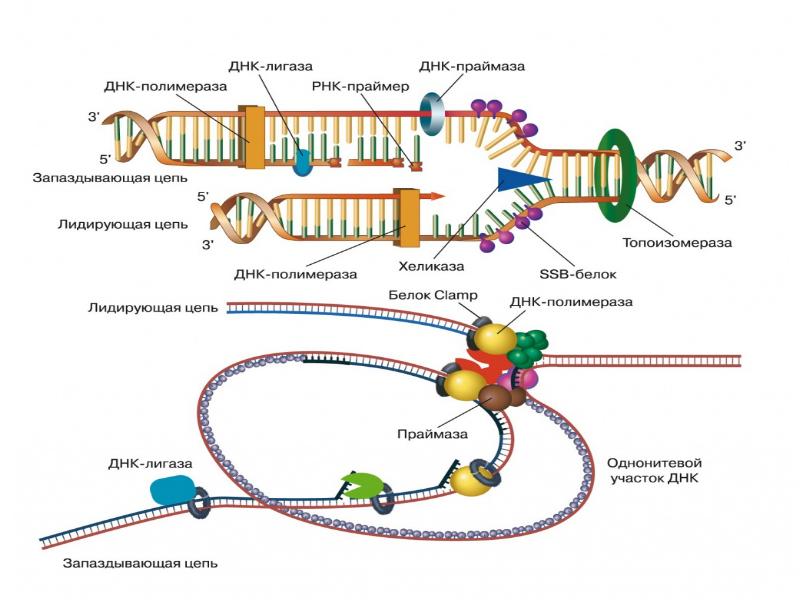
- 96. Деградация ДНК идет поэтапно 1 этап. Образование крупных фрагментов, содержащих 300
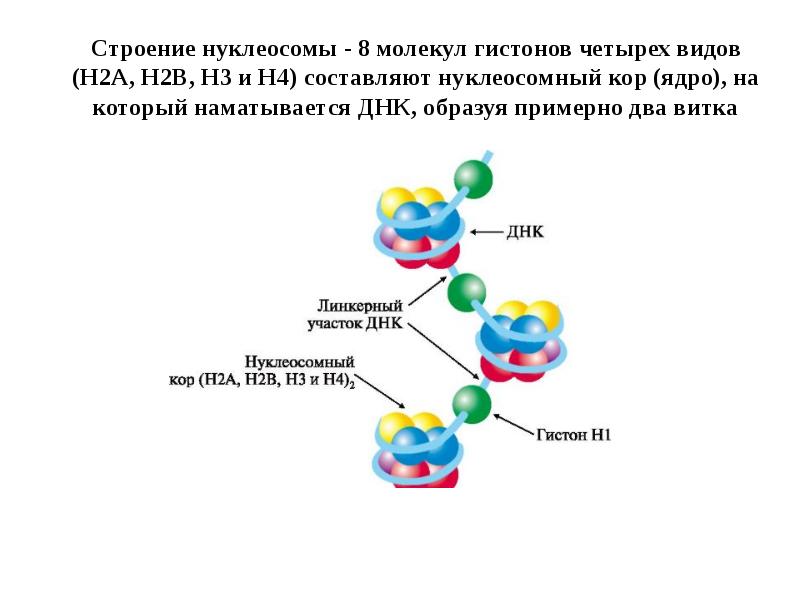
- 97. Строение нуклеосомы - 8 молекул гистонов четырех видов (Н2А, Н2В, Н3
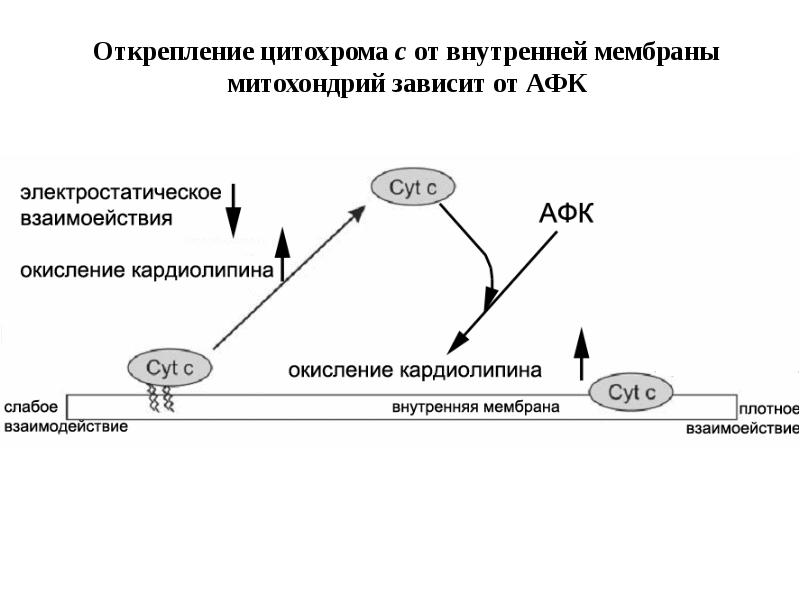
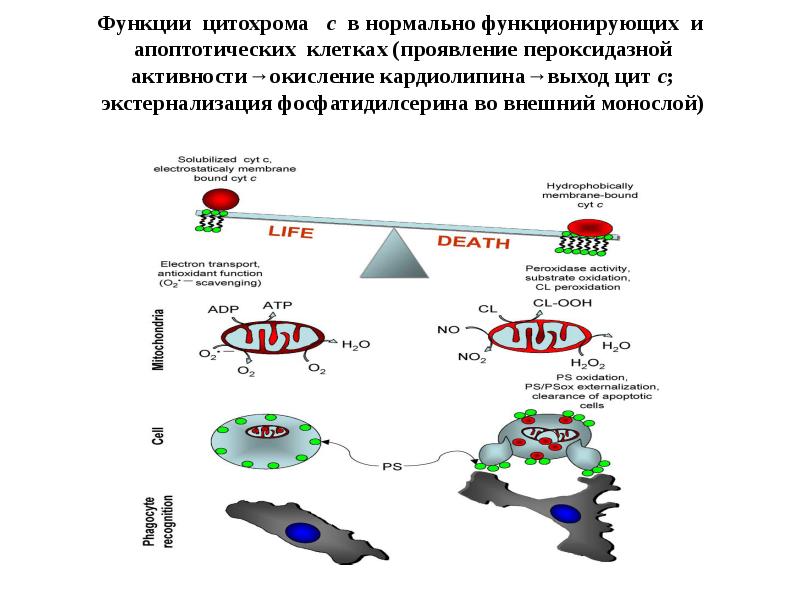
- 99. Функции цитохрома с в нормально функционирующих и апоптотических клетках (проявление пероксидазной
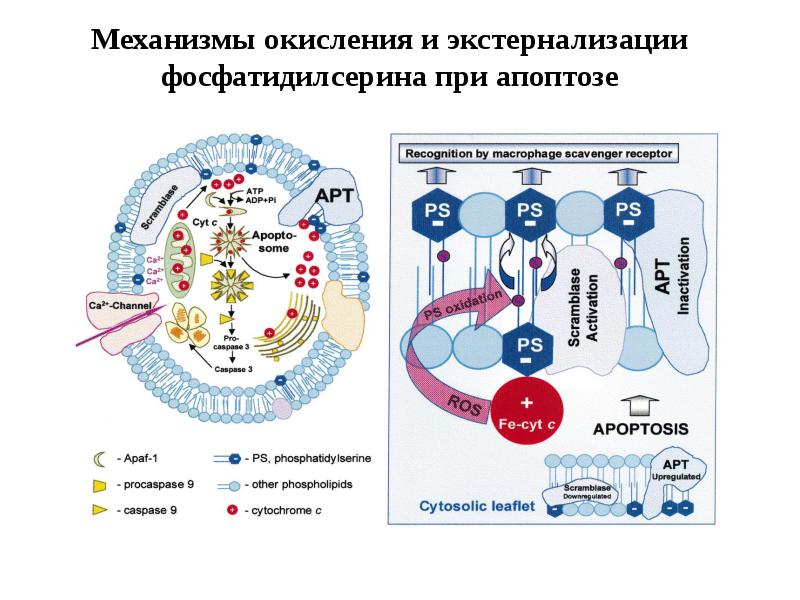
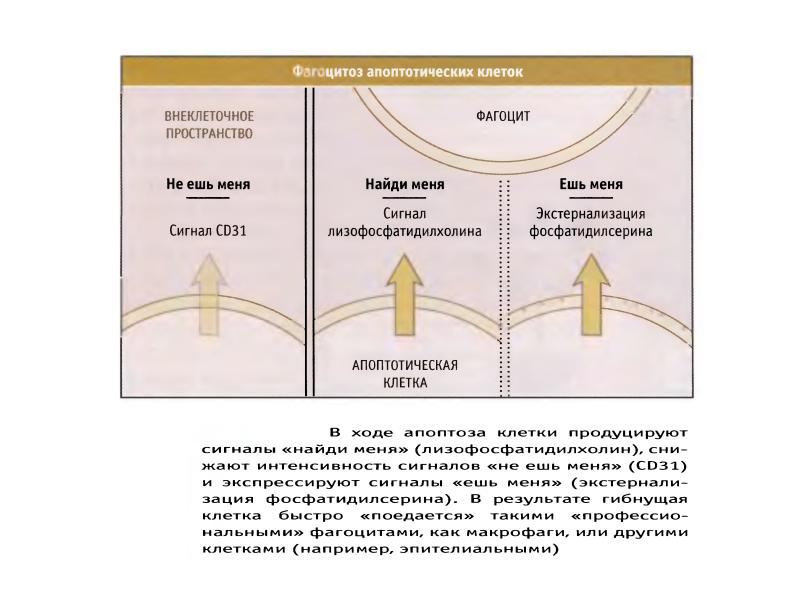
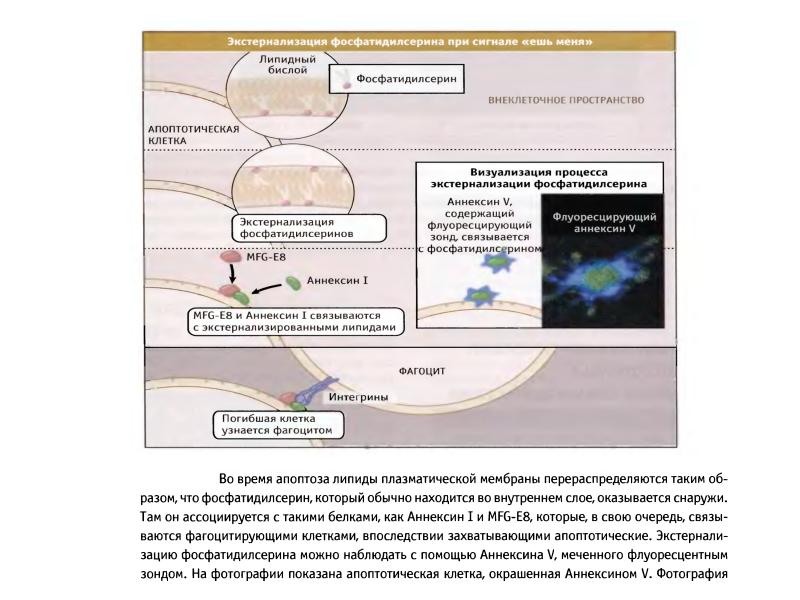
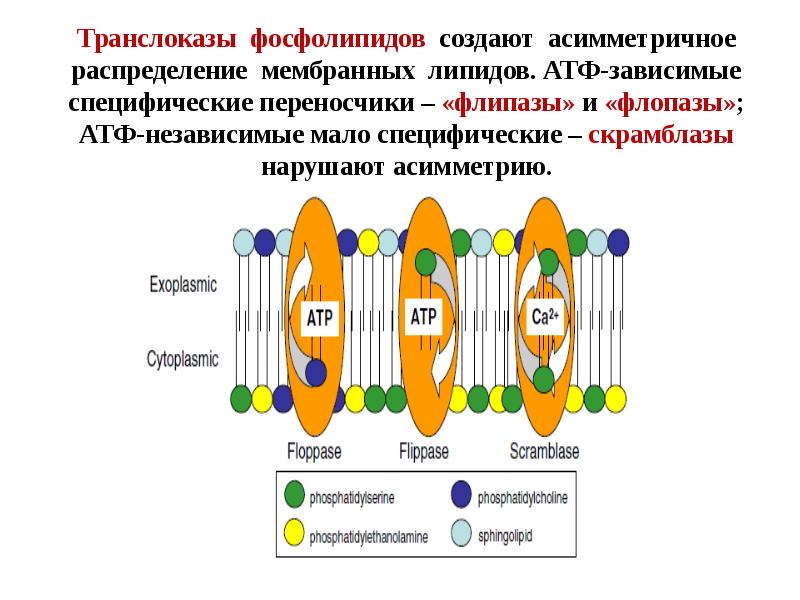
- 100. Механизмы окисления и экстернализации фосфатидилсерина при апоптозе
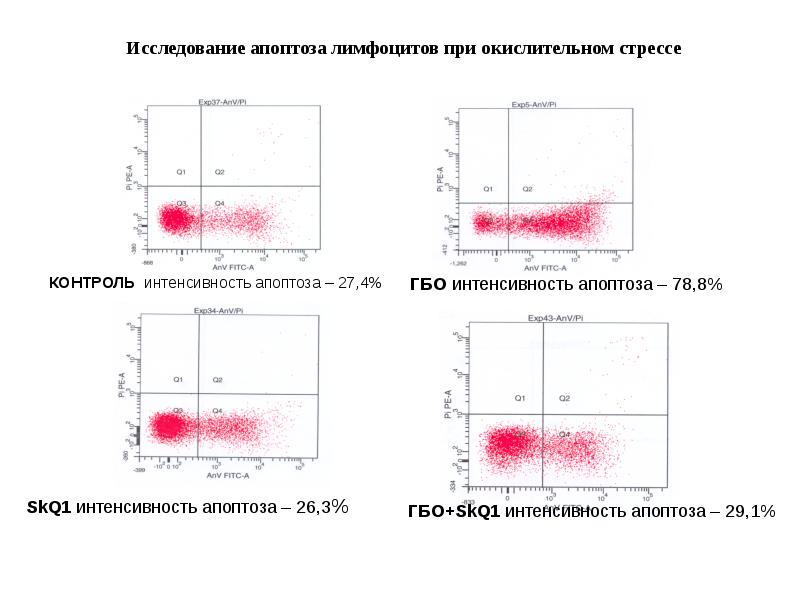
- 103. Исследование апоптоза лимфоцитов при окислительном стрессе
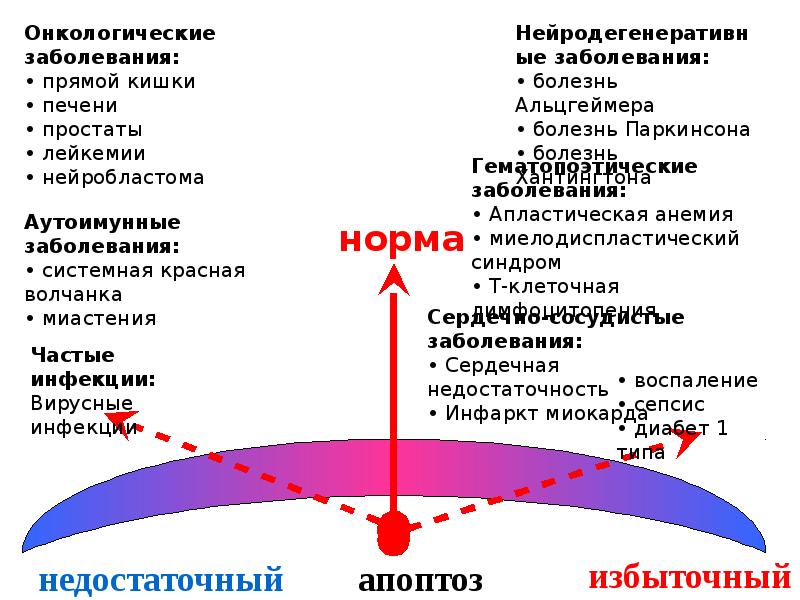
- 113. Изменение уровня апоптоза при патологиях
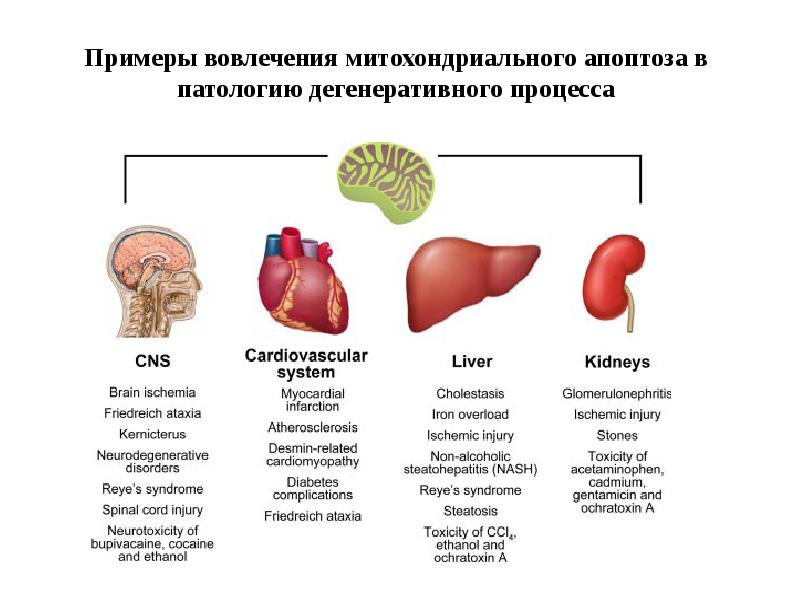
- 114. Примеры вовлечения митохондриального апоптоза в патологию дегенеративного процесса
- 119. Активация инфламмасомы
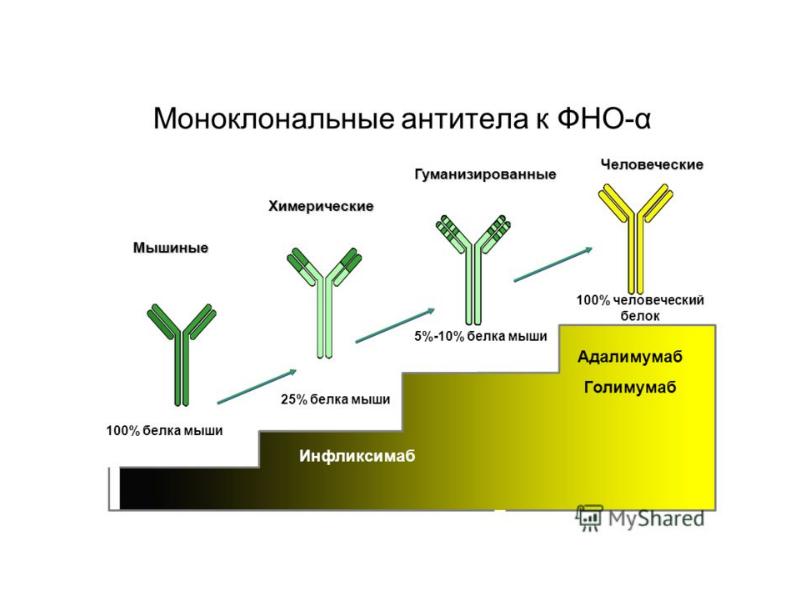
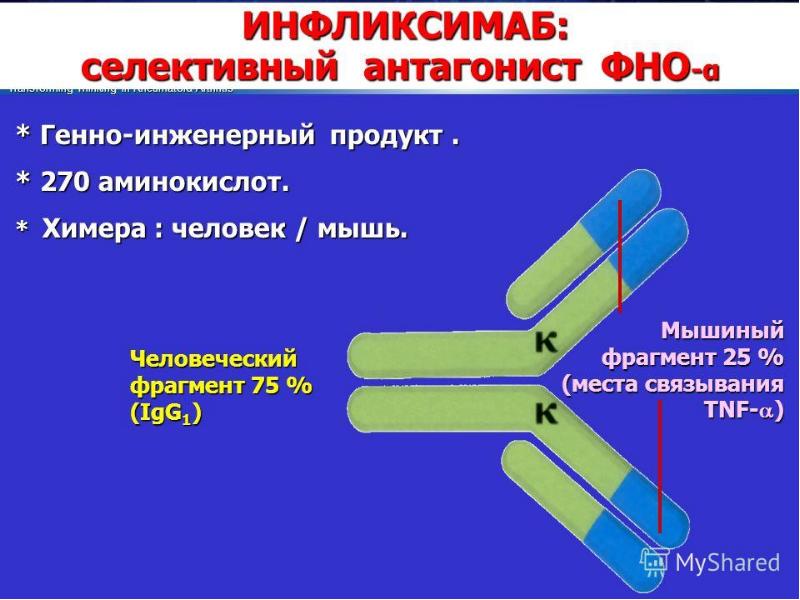
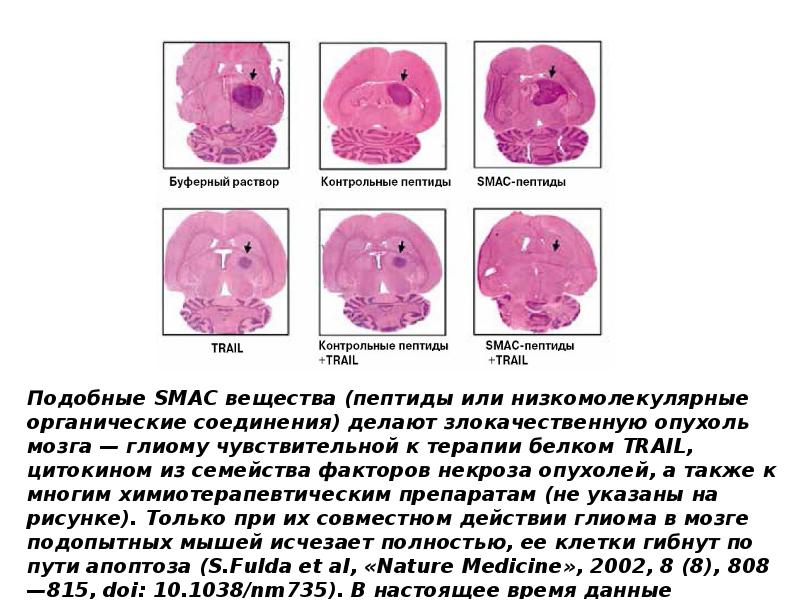
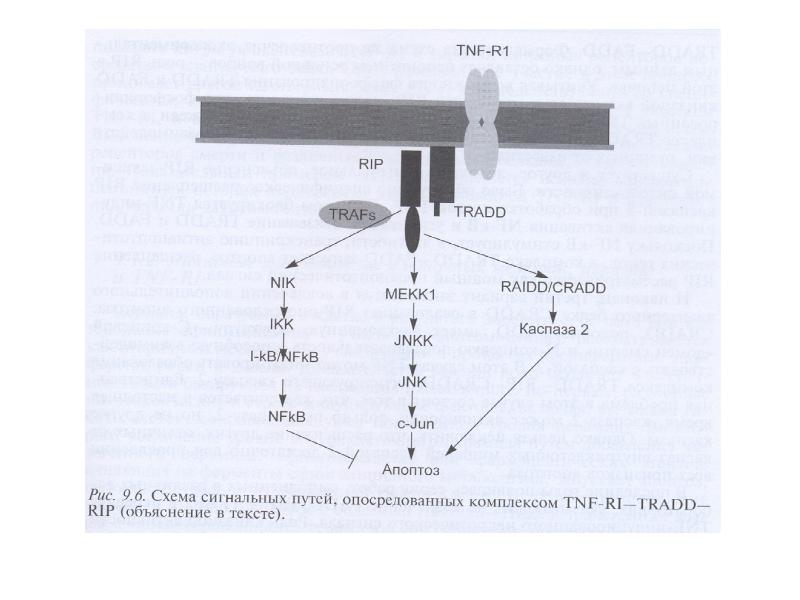
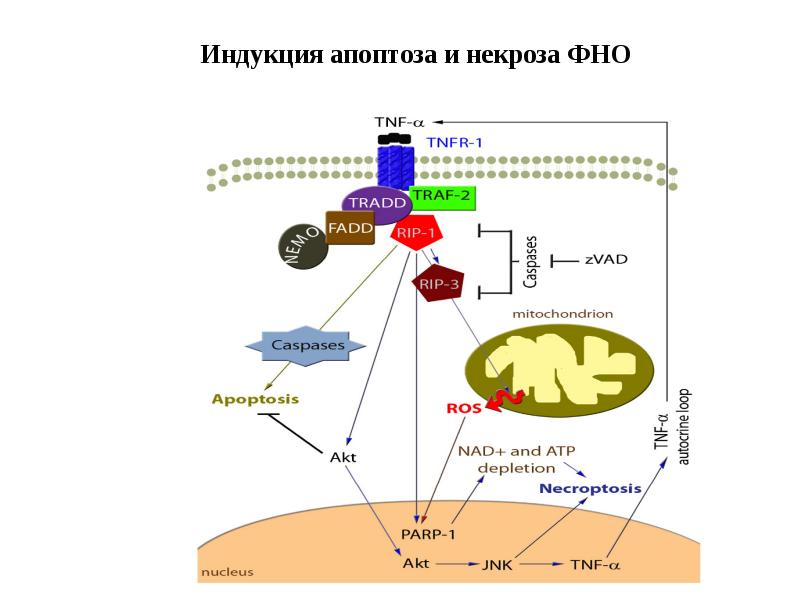
- 121. Индукция апоптоза и некроза ФНО
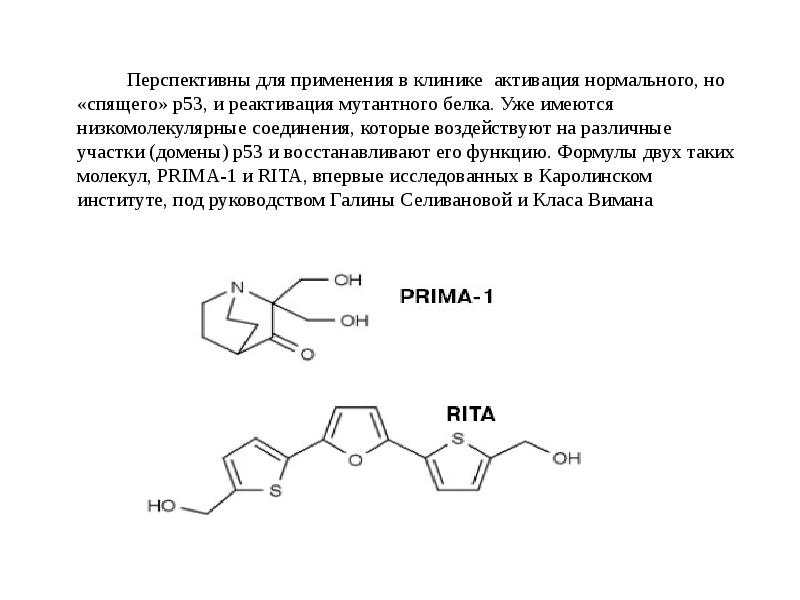
- 122. Скачать презентацию




































Слайды и текст этой презентации
Похожие презентации





























