ОСНОВЫ ЭЛЕКТРОХИМИИ презентация
Содержание
- 2. Окислительно-восстановительные процессы. Окислительно-восстановительными (ОВР) называются процессы, в результате которых происходит изменение
- 3. Окисление – процесс отдачи электронов, при этом с.о. увеличивается. Восстановитель –
- 4. Восстановление – процесс присоединения электронов, сопровождающийся понижением с.о. Окислитель –
- 5. Нередко в ОВР взаимодействуют непосредственно окислители и восстановители. Но в водных
- 6. Любую ОВР можно условно разделить на две полуреакции (например: 2KMnO4 +
- 7. Суммируем эти две полуреакции, уравняв число отданных и принятых электронов с
- 8. Таким образом, в основе метода полуреакций составления ОВР лежат следующие правила:
- 9. В процессах окисления восстановления могут принимать участие молекулы Н2О, ионы Н+
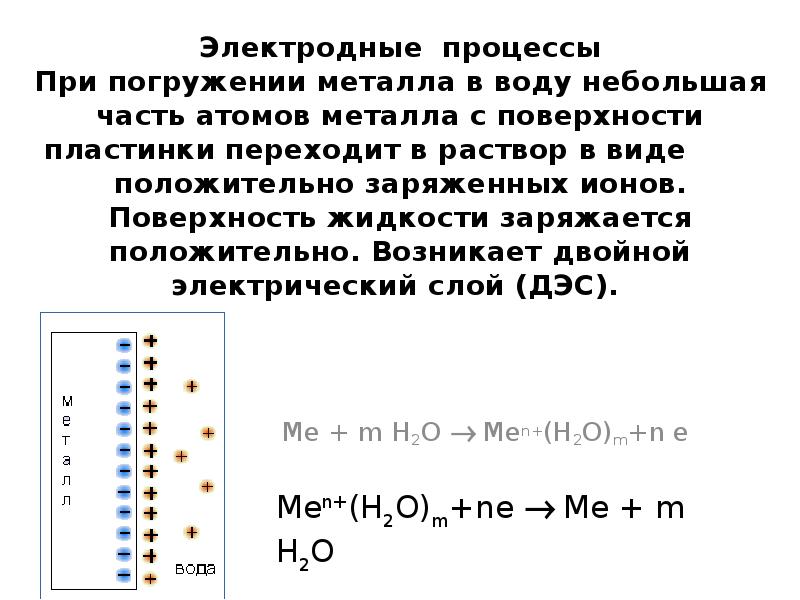
- 10. Электродные процессы При погружении металла в воду небольшая часть атомов металла
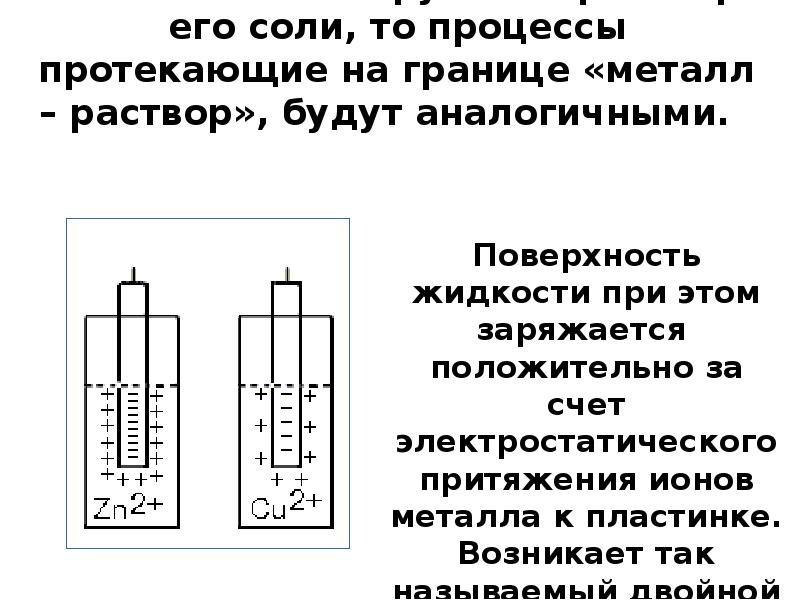
- 11. Если металл погрузить в раствор его соли, то процессы протекающие на
- 13. - Электродный –потенциал, возникающий на границе металл-раствор; - Окислительно-восстановительный (редокс) –
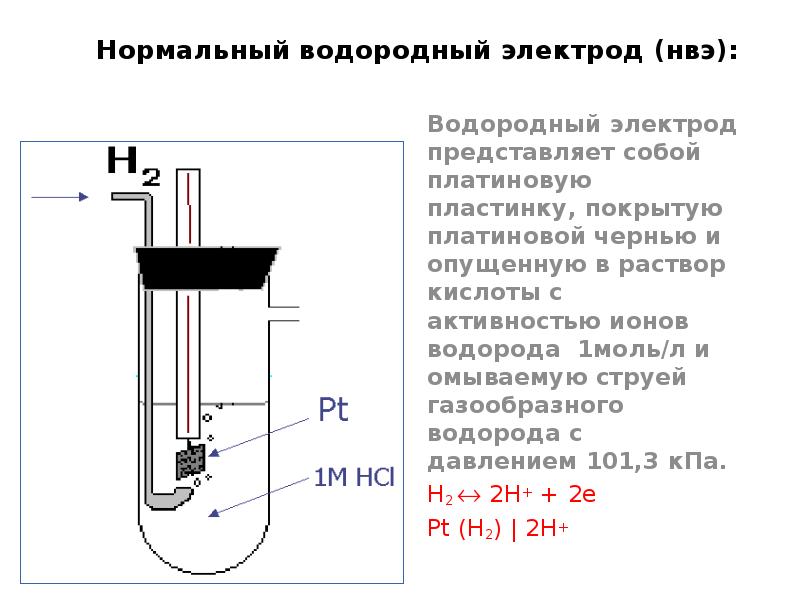
- 16. Нормальный водородный электрод (нвэ): Водородный электрод представляет собой платиновую пластинку, покрытую
- 18. .
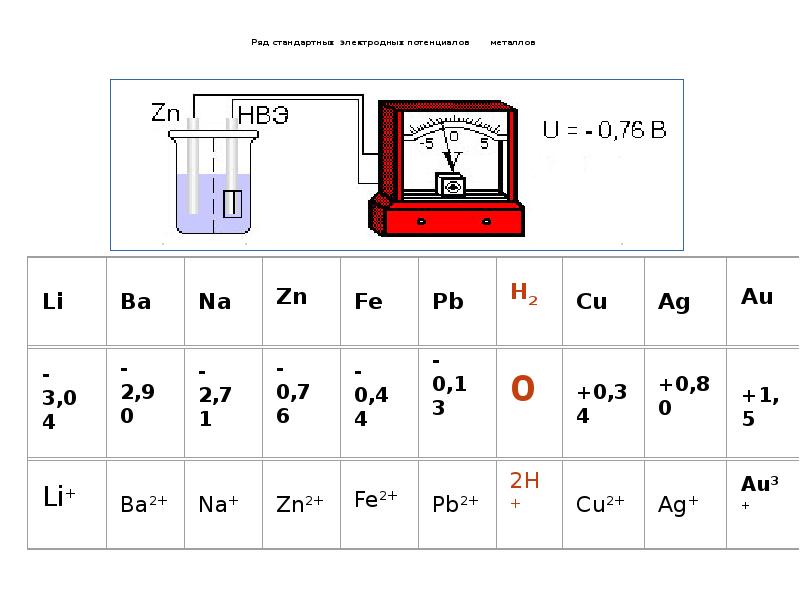
- 19. Ряд стандартных электродных потенциалов металлов
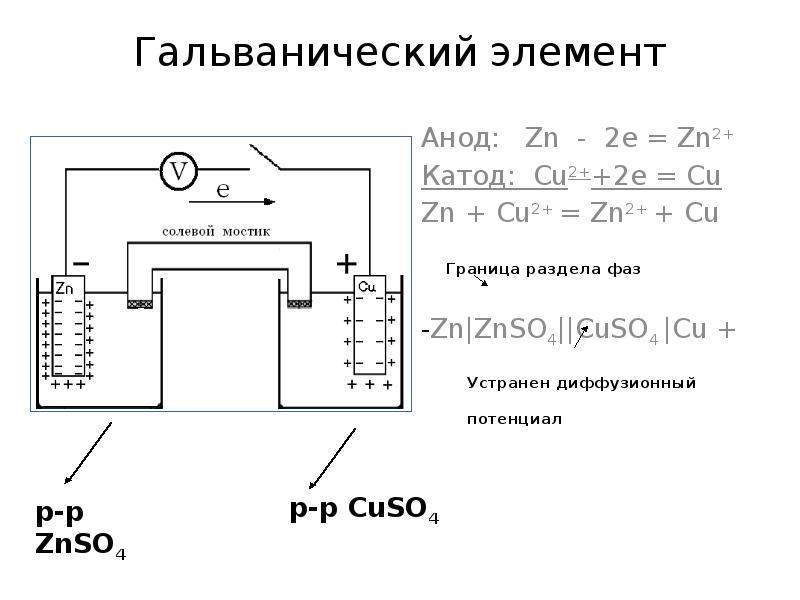
- 24. Гальванический элемент Анод: Zn - 2e = Zn2+ Катод: Cu2++2e =
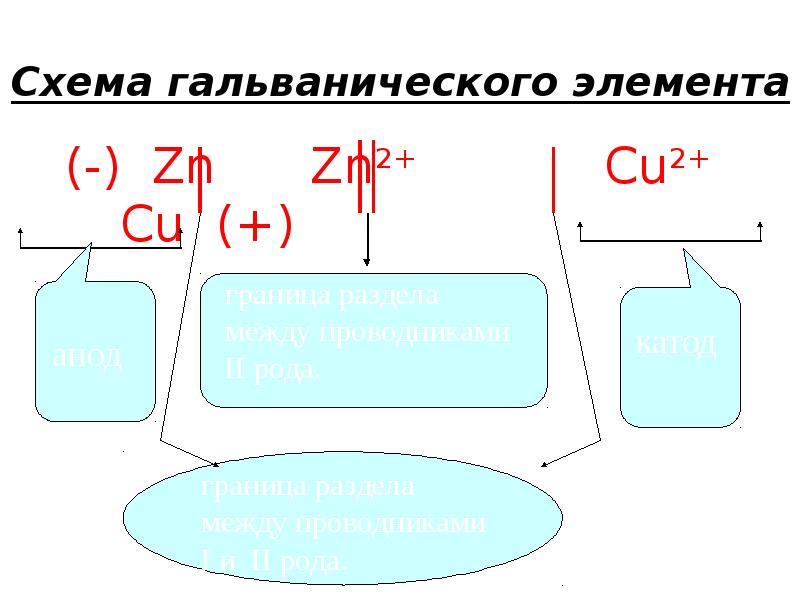
- 25. Схема гальванического элемента (-) Zn Zn2+ Cu2+
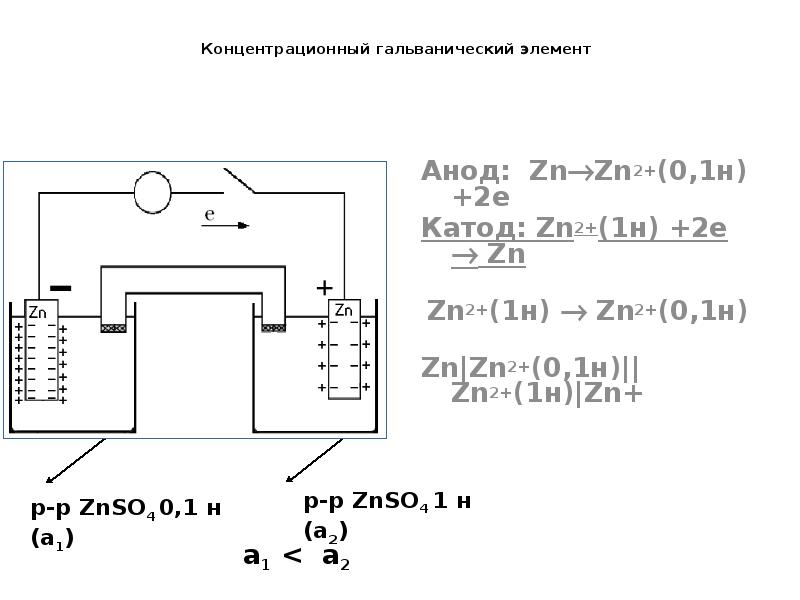
- 26. Концентрационный гальванический элемент Анод: ZnZn2+(0,1н) +2e Катод: Zn2+(1н) +2e
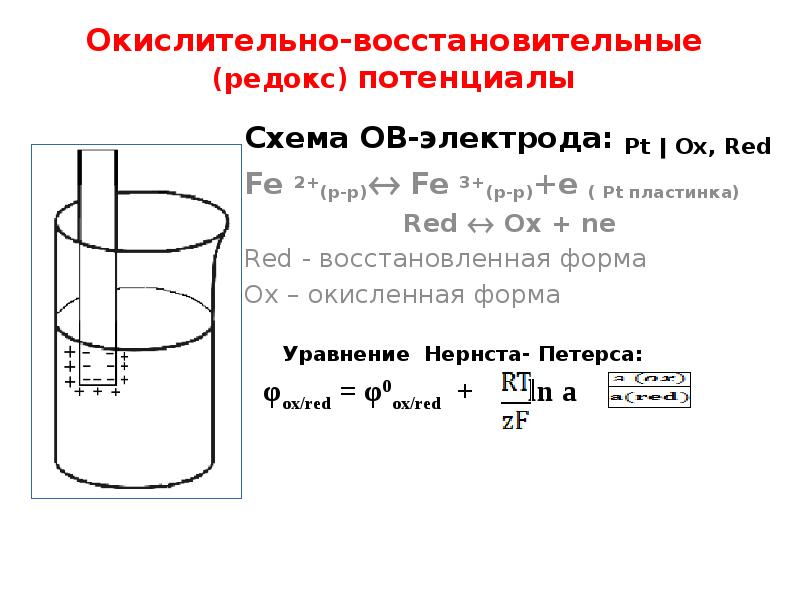
- 27. Окислительно-восстановительные (редокс) потенциалы Схема ОВ-электрода: Pt ǀ Ох, Red Fe
- 28. ОВ потенциал зависит от: температуры природы окислителя и
- 29. Стандартный ОВ потенциал
- 30. Если составить ГЭ из MnO4-/Mn2+ и (Pt),H2|2H+, то стандартный ОВ потенциал
- 31. В реальных условиях расчет ОВ потенциала системы MnO4-/Mn2+ производится по уравнению
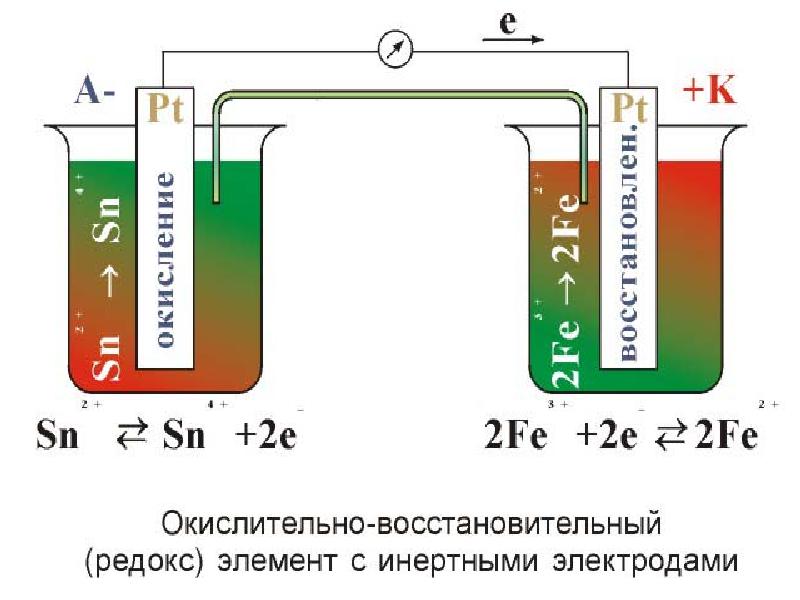
- 33. Sn+2 - 2ē = Sn+4 ; φо =+
- 34. Чем больше стандартный ОВ потенциал системы, тем в большей степени выражены
- 35. КРИТЕРИИ САМОПРОИЗВОЛЬНОГО ПРОТЕКАНИЯ ОВ РЕАКЦИЙ
- 37. Окислительно-восстановительные Гальванические элементы
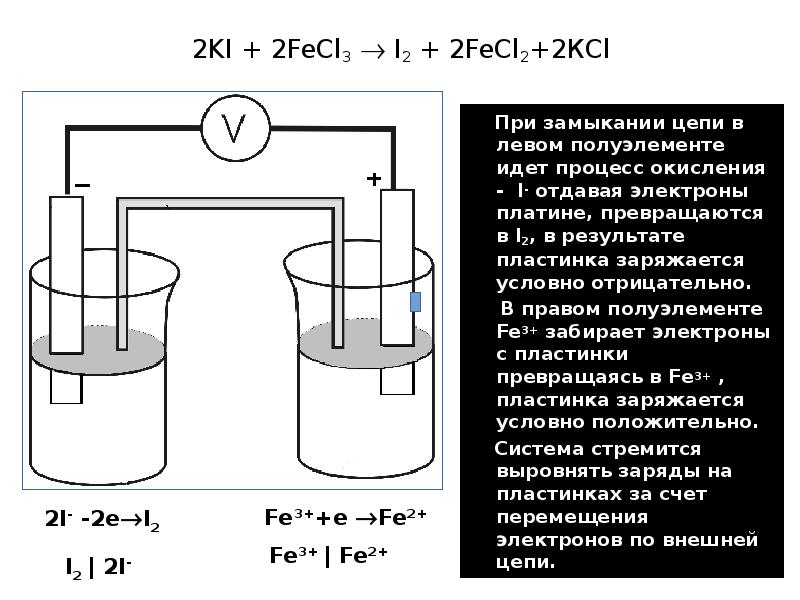
- 38. 2KI + 2FeCl3 I2 + 2FeCl2+2КCl При замыкании цепи
- 39. Электрическая проводимость растворов электролитов Способность вещества проводить электрический ток называется
- 46. диффузный потенциал . Скачок потенциала
- 47. Диффузный потенциал Обычно диффузный потенциал является побочным и не совсем желательным
- 48. Мембранный потенциал Мембранный потенциал, возникающий по обе стороны избирательно проницаемой мембраны,
- 49. Мембранный потенциал Для живых клеток и особенно для клеток нервной системы
- 52. Потенциал действия Потенциал действия - амплитуда колебания (деполяризация и реполяризация) мембранного
- 53. Физико-химические методы анализа, основанные на электрохимических процессах Кондуктометрия Кондуктометрией называется физико-химический
- 54. Различают прямую кондуктометрию и кондуктометрическое титрование. Прямая кондуктометрия основана на том,
- 55. Кондуктометрическое титрование – титриметрический метод анализа, в котором точка эквивалентности
- 56. Потенциометрия. Потенциометрией называют совокупность физико-химических методов исследования, в основе
- 57. Скачать презентацию














































Слайды и текст этой презентации
Похожие презентации





























