ОВР презентация
Содержание
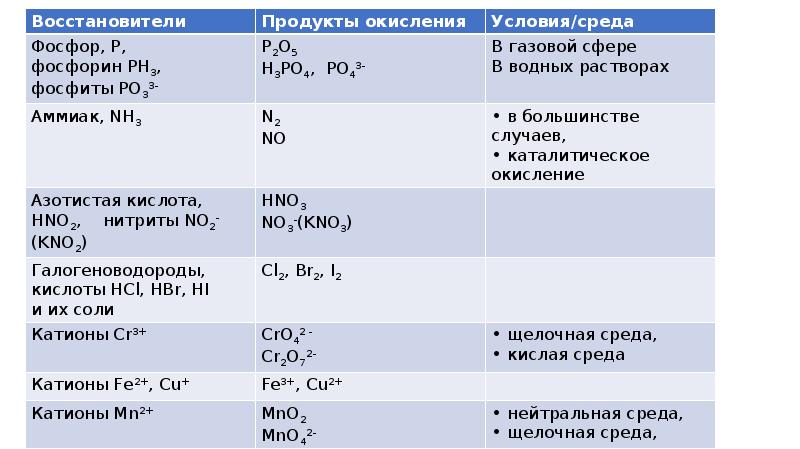
- 2. Восстановители
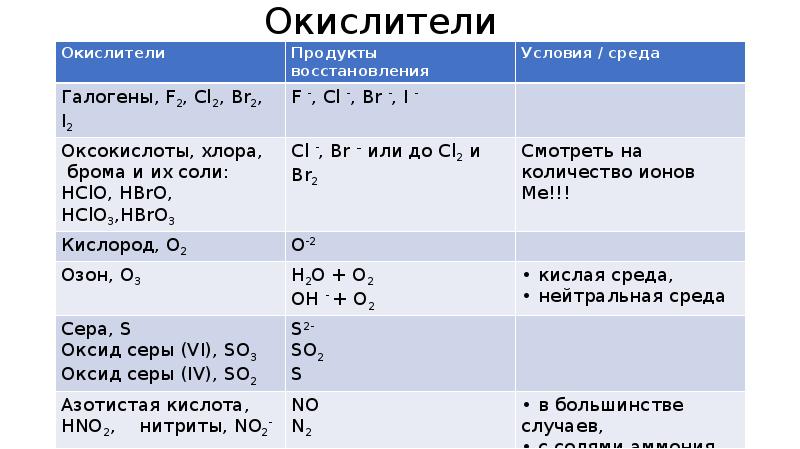
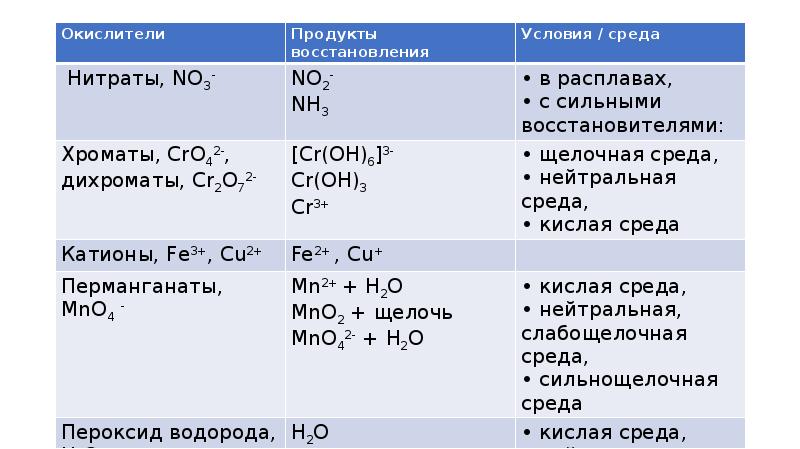
- 4. Окислители
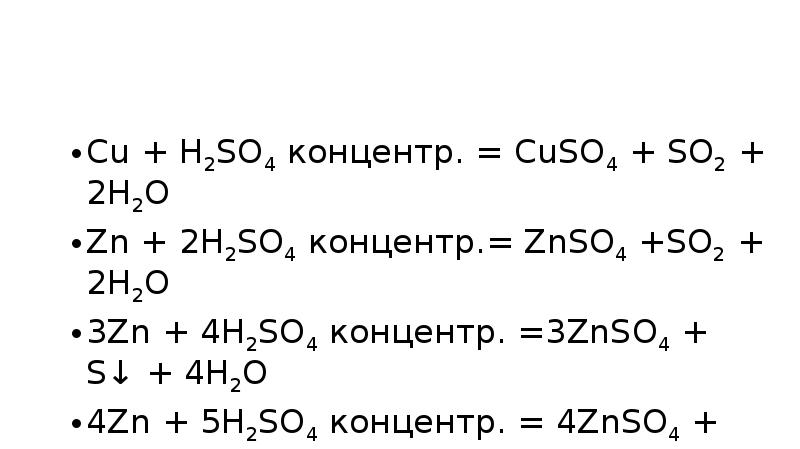
- 6. H2SO4 концентр.
- 7. Cu + H2SO4 концентр. = CuSO4 + SO2 + 2H2O
- 8. HNO3 концентр.
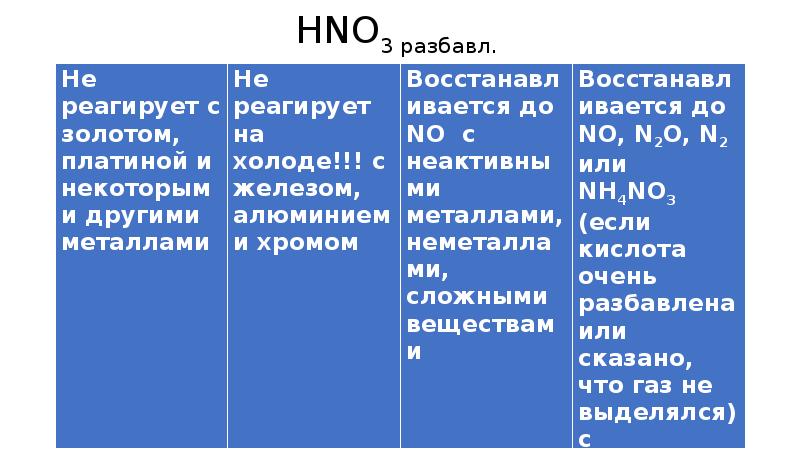
- 9. HNO3 разбавл.
- 10. 3Cu + 8HNO3 разбавл. = 3Cu (NO3)2 + 2NO + 4H2O
- 11. Концентрированные H2SO4 и HNO3 реагируют с Fe, Al, Cr только при
- 12. Концентрированная H2SO4 и HNO3 в любом виде окисляют неметаллы - восстановители
- 13. C + 4HNO3 концентр. = CO2 + 2H2O + 4NO2
- 14. Концентрированная азотная кислота окисляет йод до йодноватой кислоты: I2 +
- 15. Особое значение имеет ОВР между соляной и азотной кислотами: 3HCl +HNO3
- 16. Окислительно–восстановительные реакции, а не реакции обмена. 2FeCl3 + H2S =
- 17. Fe(OH)3 + 6HI = 2FeI2 + I2↓ + 6H2O
- 18. Окислители – соединения меди (II), восстановители - йодиды. При этом катион
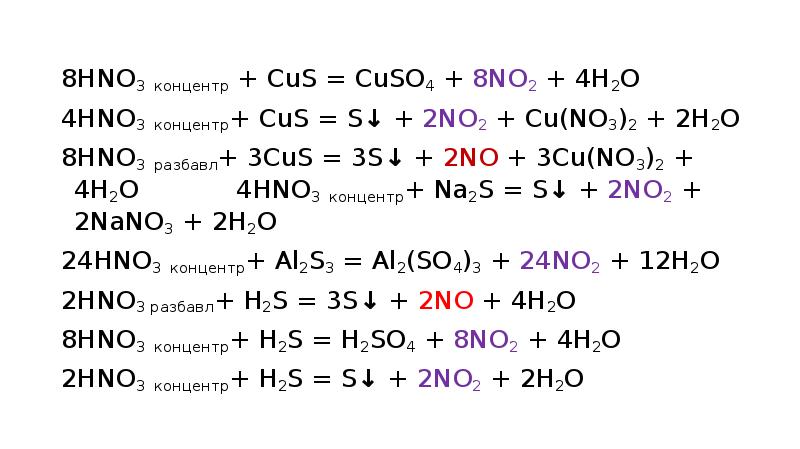
- 19. 8HNO3 концентр + CuS = CuSO4 + 8NO2 + 4H2O
- 20. 2HNO3 разбавл+ 3K2SO3 = 3K2SO4 + 2NO + H2O 2HNO3 разбавл+
- 21. Окислитель – азотная кислота или серная, восстановитель – соединения железа (II).
- 22. Окислитель – серная кислота, восстановитель – сульфиды, йодиды и бромиды.
- 23. 6KI + 2H2SO4 концентр. = 3I2↓ + H2S + 3K2SO4 +
- 24. Железная окалина – Fe3O4 Fe3O4 + 10HNO3 концентр. = 3Fe(NO3)3 +
- 25. В большинстве остальных случаев – происходит реакция обмена!!!! Fe3O4 + 8HCl
- 26. Реакции диспропорционирования
- 27. Сера в щелочах 3S + 6KOH = 2K2S + K2SO3 +
- 28. Диспропорционирование фосфора в растворах щелочей. 4P + 3KOH + 3H2O
- 29. Диспропорционирование оксида азота (IV) в воде и щелочах: 2NO2 +
- 30. Другое 3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH 4NaClO3
- 31. Скачать презентацию













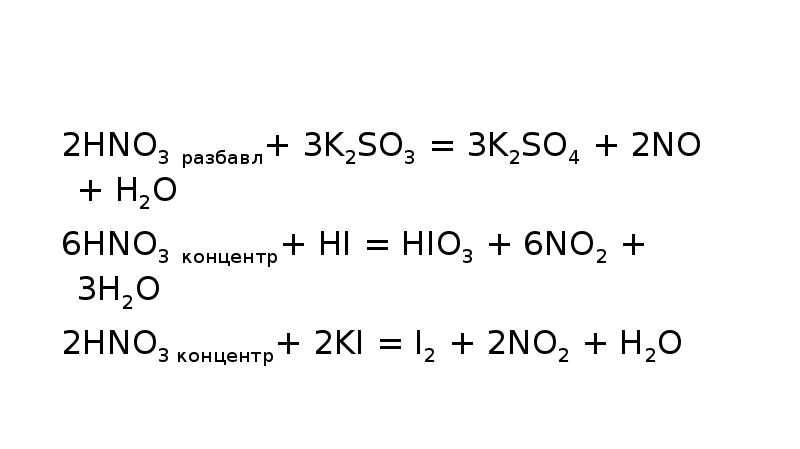










Слайды и текст этой презентации
Похожие презентации





























