Электрохимические методы. (Лекция 3) презентация
Содержание
- 2. Преимущества ЭХ методов Высокая чувствительность (пределы определения до 10-9 г), воспроизводимость,
- 3. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ потенциометрические методы (измерение напряжения между электродами), полярография (измерение
- 4. Сущность потенциометрического метода. Типы электродов Уравнение Нернста
- 5. серебряный, ртутный, и водородный электроды
- 6. Стеклянный электрод: Водород, растворенный в металле, образует с катионами Н+
- 7. Потенциометрическое титрование точка стехиометричности устанавливается по изменению потенциала индикаторного электрода,
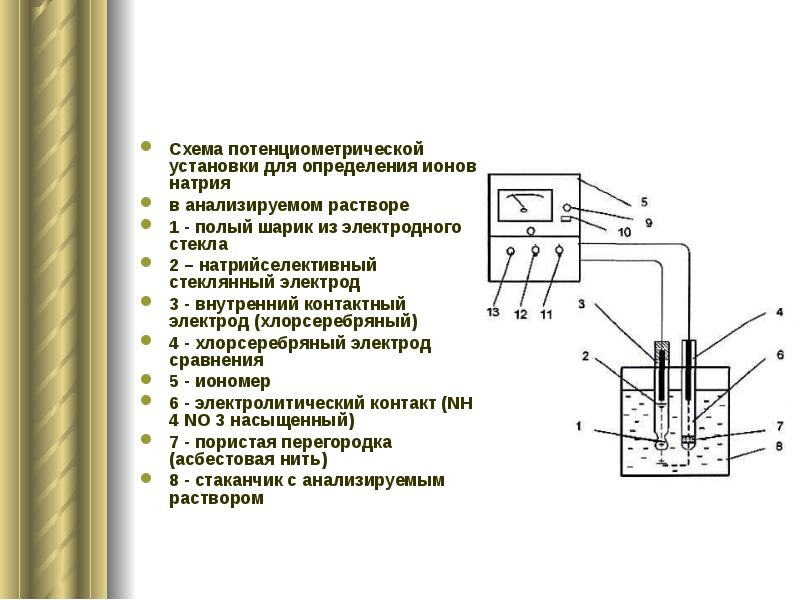
- 8. Схема потенциометрической установки для определения ионов натрия в анализируемом растворе 1
- 9. Кулонометрия q/nF = т/М, (4) где
- 10. прямая кулонометрия Если исследуемый компонент восстанавливается на катоде, выбирается потенциал
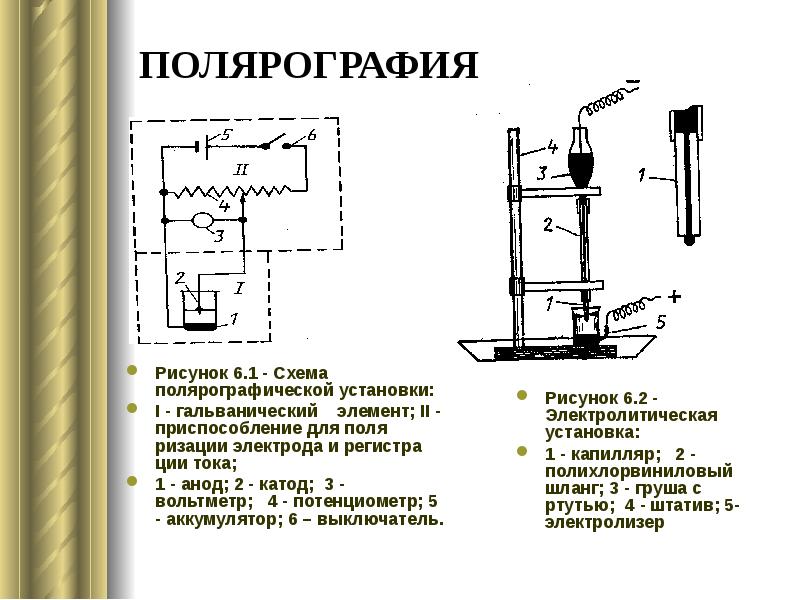
- 11. ПОЛЯРОГРАФИЯ Рисунок 6.1 - Схема полярографической установки: I - гальванический элемент;
- 12. Основы полярографического метода анализа Eа - Eк = U,
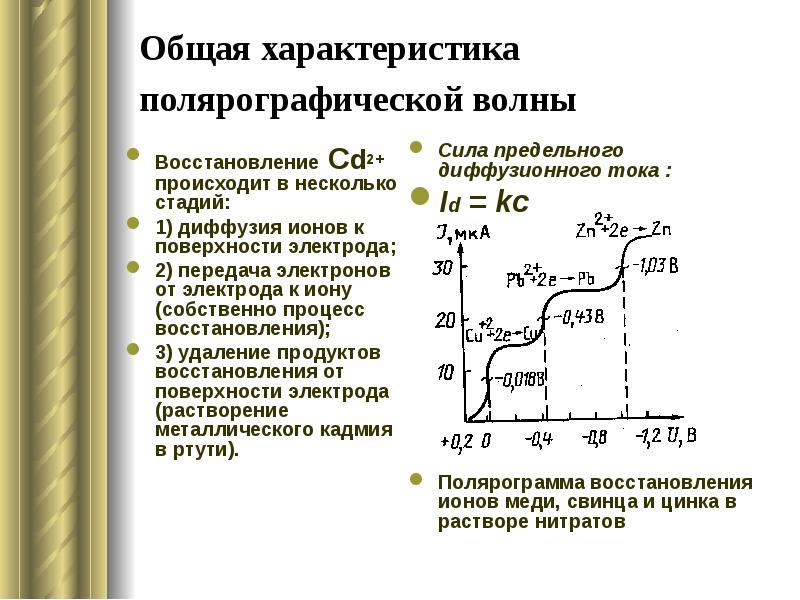
- 13. Общая характеристика полярографической волны Восстановление Сd2+ происходит в несколько стадий:
- 14. Качественный и количественный полярографический анализ метод градуировочного графика
- 15. Скачать презентацию











Слайды и текст этой презентации
Скачать презентацию на тему Электрохимические методы. (Лекция 3) можно ниже:
Похожие презентации





























