Физическая химия дисперсных систем. Коллоидные растворы презентация
Содержание
- 2. План лекции Общие понятия Классификация дисперсных систем Методы получения коллоидов Методы
- 3. Коллоидная химия Раздел физической химии, изучающий физико-химические свойства гетерогенных высокодисперсных систем,
- 4. Немного истории… До начала XX века наука о коллоидах содержала описание
- 5. По Т. Грэму Кристаллоиды – вещества быстро диффундирующие и проходящие через
- 6. По И.Г. Борщеву В зависимости от условий одно и то же
- 7. Коллоидное состояние вещества Степень его раздробленности (дисперсности) и нахождение коллоидных частиц
- 8. Удельная поверхность фазы S Sуд = -----
- 9. Дисперсная система Дисперсионная среда – растворитель, в котором распределено вещество в
- 10. Гетерогенные (неоднородные) системы Дисперсные системы, в которых одно вещество распределено в
- 11. Классификация дисперсных систем По величине частиц дисперсной фазы Грубодисперсные (больше 10-7м).
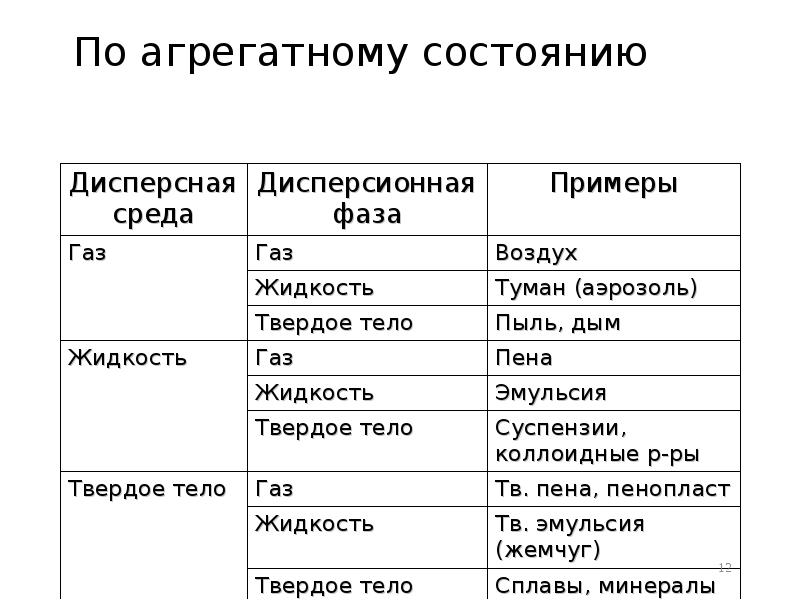
- 12. По агрегатному состоянию
- 13. Классификация коллоидных растворов По интенсивности взаимодействия частиц на поверхности раздела фаз:
- 14. По текучести растворов: По текучести растворов: Золи – коллоидные растворы, имеющие
- 15. Условия получения коллоидов Дисперсная фаза должна обладать плохой растворимостью Размеры диспергируемого
- 16. Методы получения коллоидных растворов Дисперсионные методы – дробление вещества до коллоидной
- 17. Дисперсионные методы Механические (шаровые и коллоидные мельницы, ступка) – диспергирование с
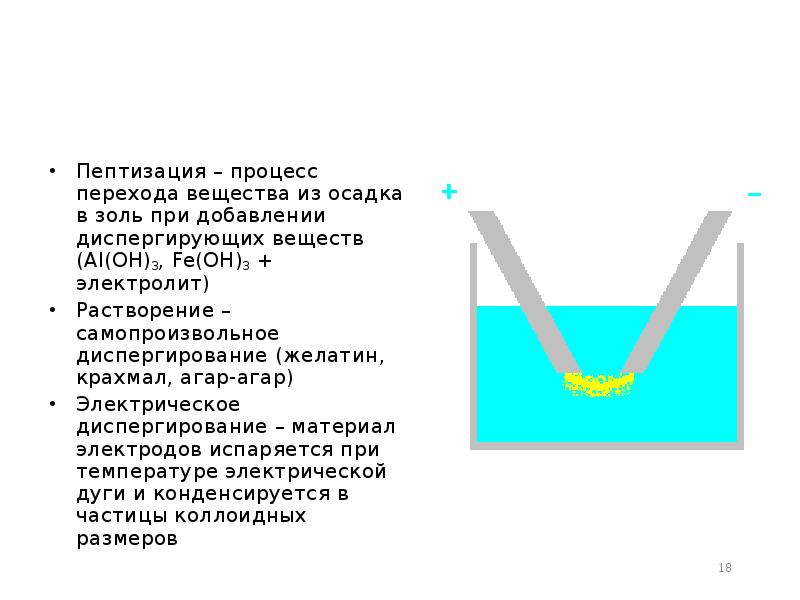
- 18. Пептизация – процесс перехода вещества из осадка в золь при добавлении
- 19. Конденсационные методы Окисление 2H2S + O2 2H2O + 2S Восстановление
- 20. Нейтрализация Нейтрализация Ca(OH)2 + H2SO4 CaSO4 + 2H2O Замена растворителя
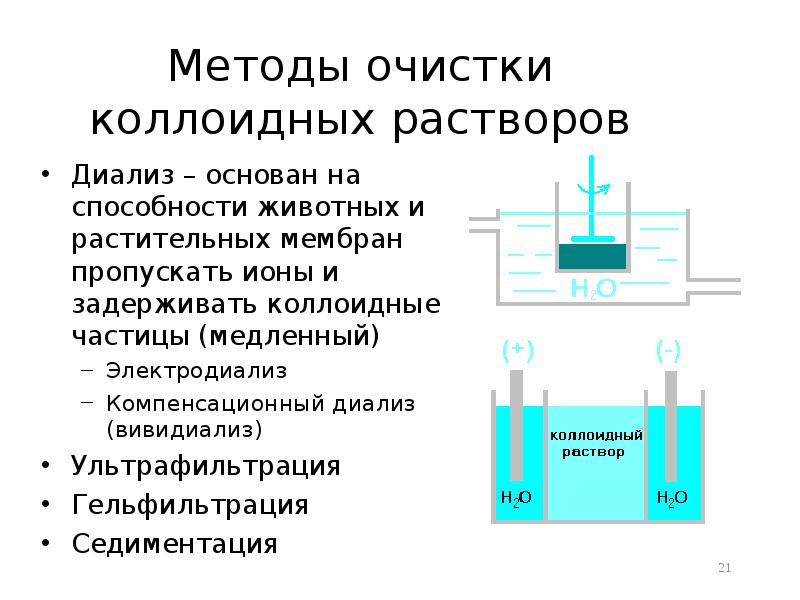
- 21. Методы очистки коллоидных растворов Диализ – основан на способности животных и
- 22. Молекулярно-кинетические свойства коллоидных растворов Седиментационное равновесие Броуновское движение Диффузия Осмотическое давление
- 23. Седиментационное равновесие 2 (d – d0) =
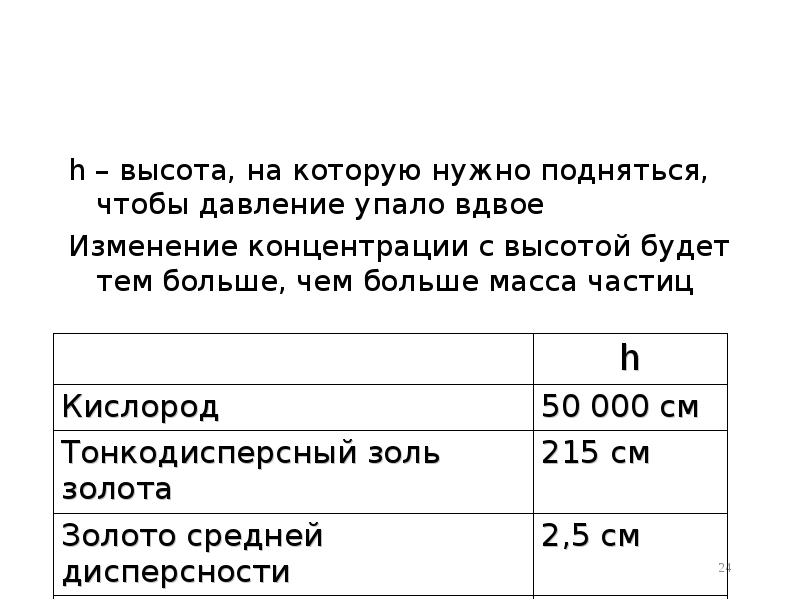
- 24. h – высота, на которую нужно подняться, чтобы давление упало вдвое
- 25. Применение седиментационного анализа Определение размера и фракционного состава частиц (число частиц
- 26. Броуновское движение Присуще частицам с размерами не более 10-6м Не зависит
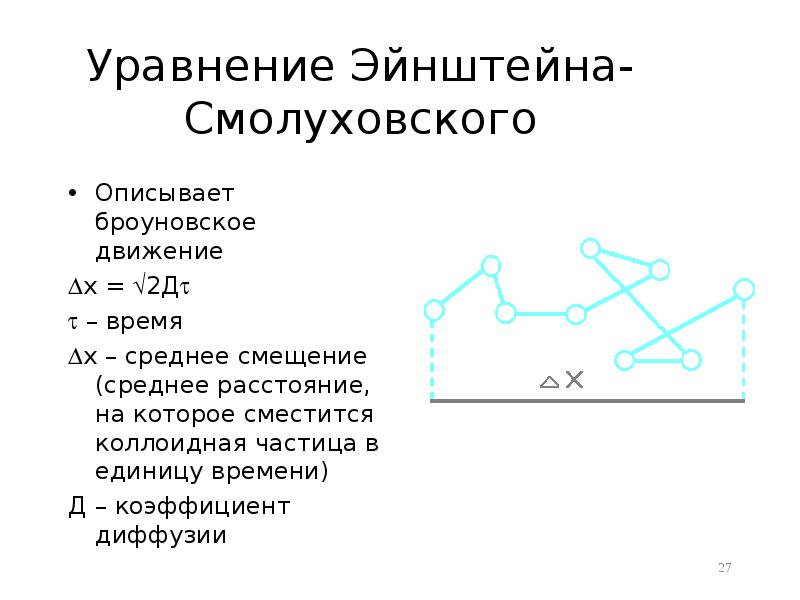
- 27. Уравнение Эйнштейна-Смолуховского Описывает броуновское движение х = 2Д –
- 28. Диффузия C m = -Д · ----- ·
- 29. Осмотическое давление Осмотическое давление коллоидных растворов подчиняется закону Вант-Гоффа осм =
- 30. осм (1% золь золота) = 0,00045 атм осм (1% золь золота)
- 31. Роль коллоидов Кровь, лимфа, плазма, спинномозговая жидкость, протоплазма – коллоидные системы,
- 32. Скачать презентацию


























Слайды и текст этой презентации
Скачать презентацию на тему Физическая химия дисперсных систем. Коллоидные растворы можно ниже:
Похожие презентации





























