Кинетика химических превращений. (Тема 4.3) презентация
Содержание
- 2. Тема 4.3 Кинетика химических превращений: Схема превращения; Скорость превращения и
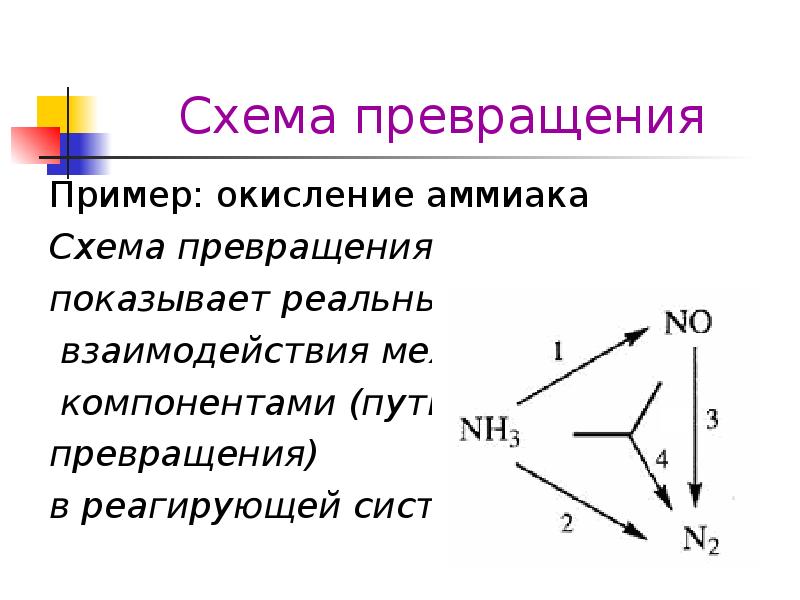
- 3. Схема превращения Пример: окисление аммиака Стехиометрически независимые уравнения 4NH3 +
- 4. Схема превращения Пример: окисление аммиака Действительные превращения 4NH3 + 5O2
- 5. Схема превращения Пример: окисление аммиака Схема превращения показывает реальные
- 6. Скорость превращения и скорость реакции Скорость превращения вещества — изменение
- 7. Скорость превращения и скорость реакции Для скоростей превращения различных компонентов
- 8. Скорость превращения и скорость реакции Истинная или мгновенная скорость реакции
- 9. Скорость превращения и скорость реакции Например, реакция синтеза аммиака N2
- 10. Кинетическое уравнение реакции Зависимость скорости превращения или скорости реакции от
- 11. Скорость превращения и скорость реакции Параметры химической реакции – константы
- 12. Скорость превращения и скорость реакции Кинетическое уравнение в общем виде
- 13. Скорость превращения и скорость реакции АА + ВВ + …=
- 14. Скорость превращения и скорость реакции Порядок реакции по реагенту –
- 15. Скорость превращения и скорость реакции
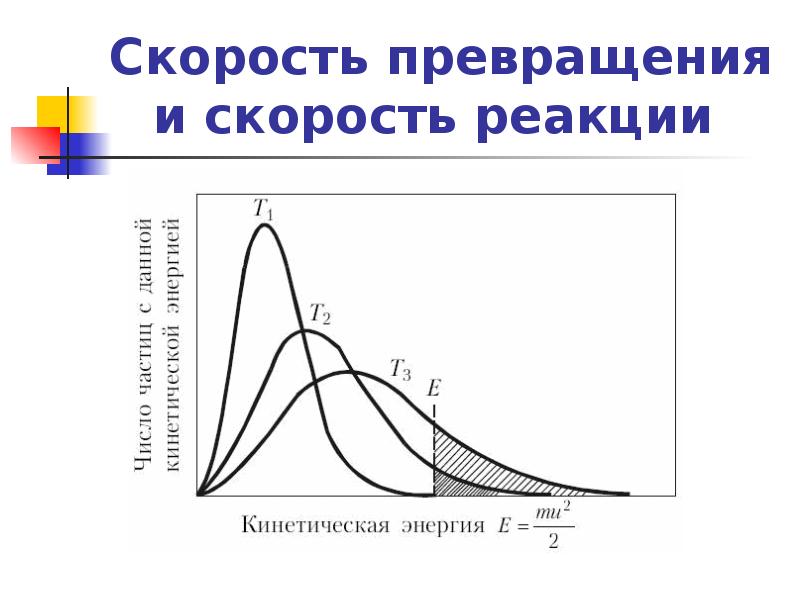
- 16. Скорость превращения и скорость реакции Энергия активации элементарной реакции Е
- 17. Скорость превращения и скорость реакции а) чем выше энергия активации
- 18. Скорость превращения и скорость реакции Для ориентировочной оценки влияния температуры
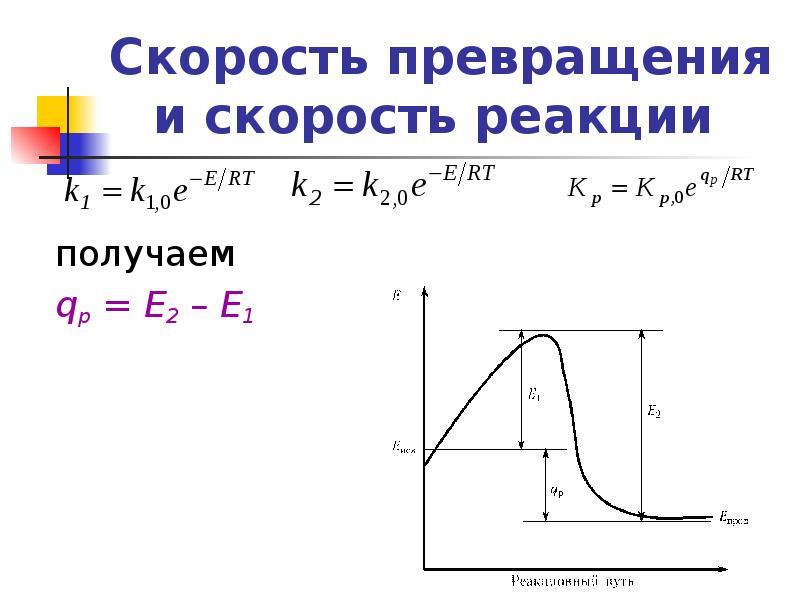
- 19. Скорость превращения и скорость реакции Кинетическое уравнение простой обратимой реакции
- 20. Скорость превращения и скорость реакции получаем qр = Е2
- 21. Скорость превращения и скорость реакции Первая стадия реакции k1СА(СК0
- 22. Скачать презентацию


















Слайды и текст этой презентации
Скачать презентацию на тему Кинетика химических превращений. (Тема 4.3) можно ниже:
Похожие презентации





























