Предмет физической химии презентация
Содержание
- 2. Учебная литература Курс физической химии: В 2-х т. Т 1./
- 3. Методическая и справочная литература Краткий справочник физико-химических величин / Под ред.
- 4. Физическая химия (ФХ) – наука о применении теоретических и экспериментальных методов
- 5. Основные разделы ФХ Химическая термодинамика (ХТД) На
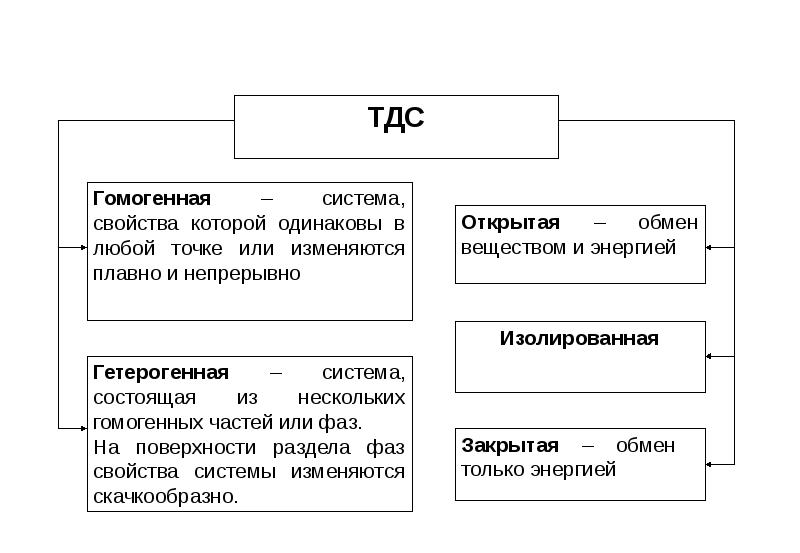
- 6. Химическая термодинамика Основные понятия химической термодинамики
- 7. ХТД изучает взаимные превращения массы и энергии (в форме теплоты и
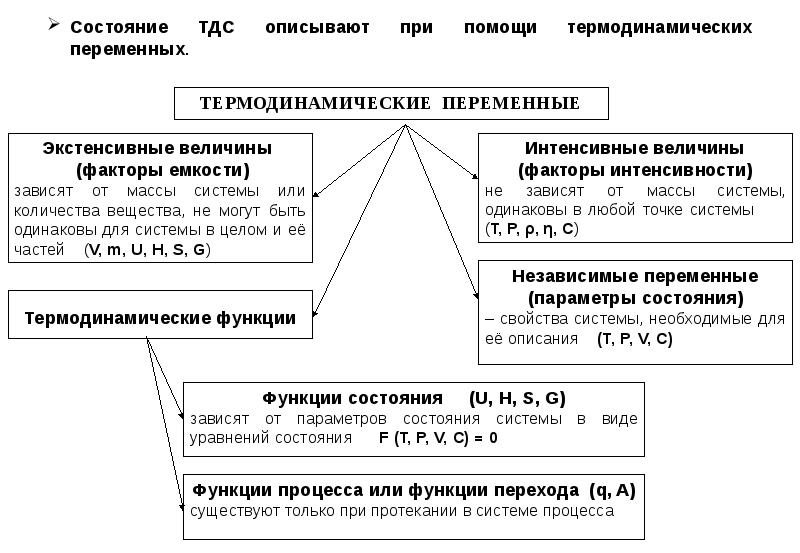
- 9. Состояние ТДС описывают при помощи термодинамических переменных.
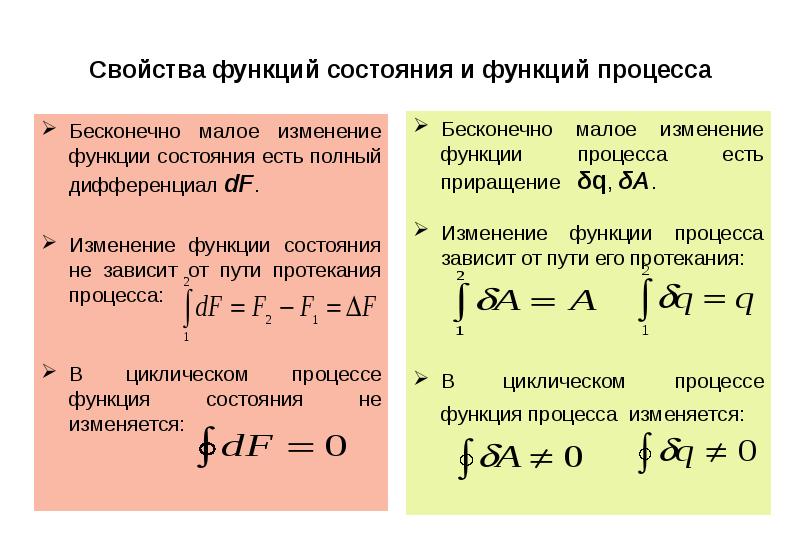
- 10. Свойства функций состояния и функций процесса Бесконечно малое изменение функции состояния
- 11. Теплота и работа – два способа передачи энергии. Теплота – энергия
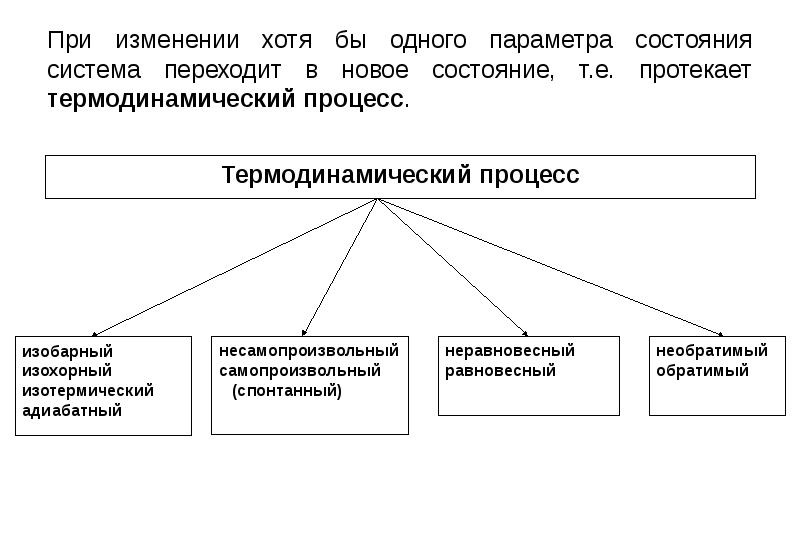
- 12. При изменении хотя бы одного параметра состояния система переходит в новое
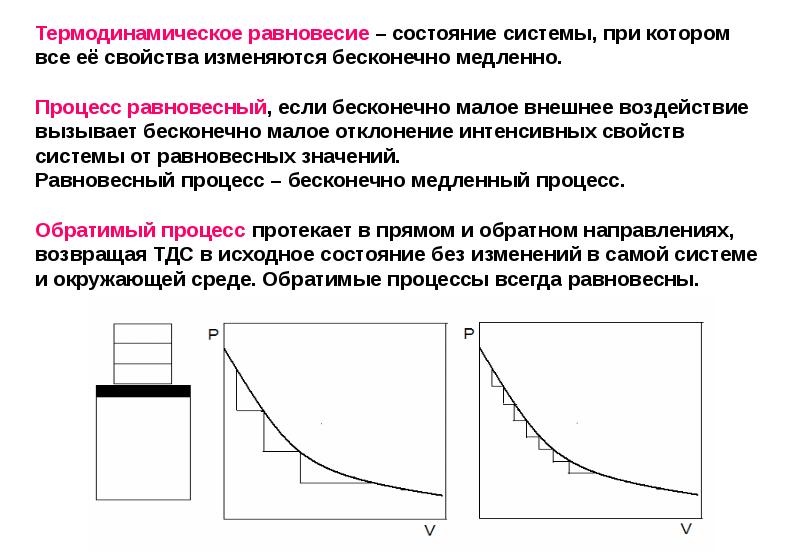
- 13. Термодинамическое равновесие – состояние системы, при котором все её свойства изменяются
- 14. Первое начало термодинамики I закон термодинамики - закон сохранения энергии
- 15. dU = δq – δA − дифференциальная форма (1)
- 16. Теплота и работа в различных процессах dU = δQ – PdV
- 17. dU = δQ – PdV (5)
- 18. dU = δQ – PdV (5)
- 19. dU = δQ – PdV (5)
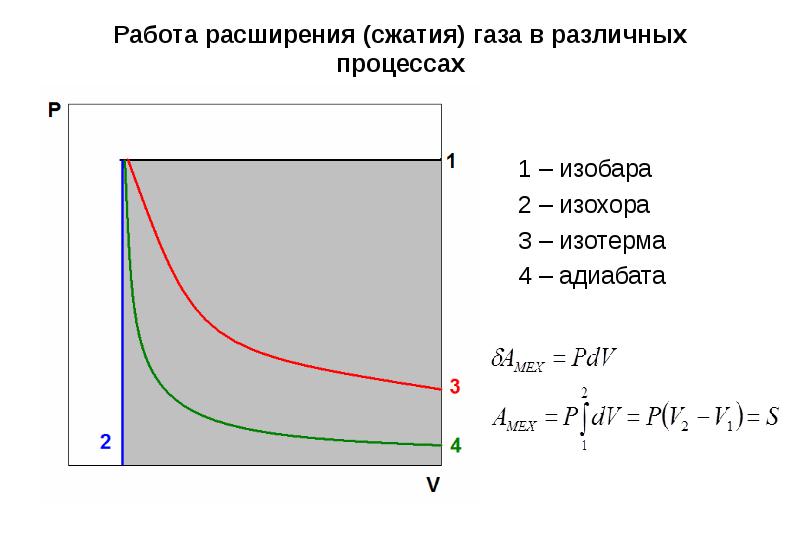
- 20. Работа расширения (сжатия) газа в различных процессах 1 – изобара 2
- 21. Разминка В процессе дыхания при расширении и сжатии легких человек затрачивает
- 22. Такую работу выполняет Ваш организм даже когда Вы «отдыхаете»!
- 23. Скачать презентацию
















Слайды и текст этой презентации
Похожие презентации





























