Применение метода кислотно-основного титрования в количественном анализе химических веществ и лекарственных средств. (Ле презентация
Содержание
- 2. План: 1. Элементный анализ. Анализ по функциональным группам. 2. Способы
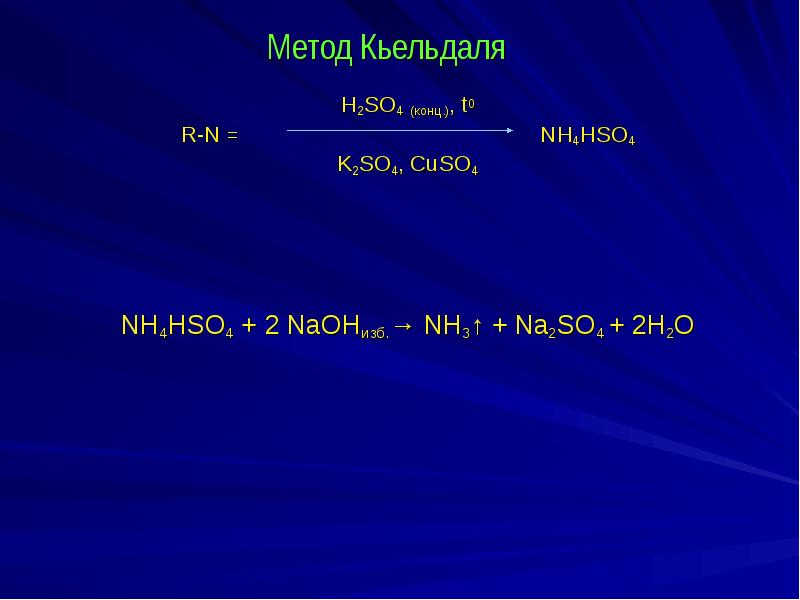
- 3. Метод Кьельдаля H2SO4 (конц.), t0 R-N =
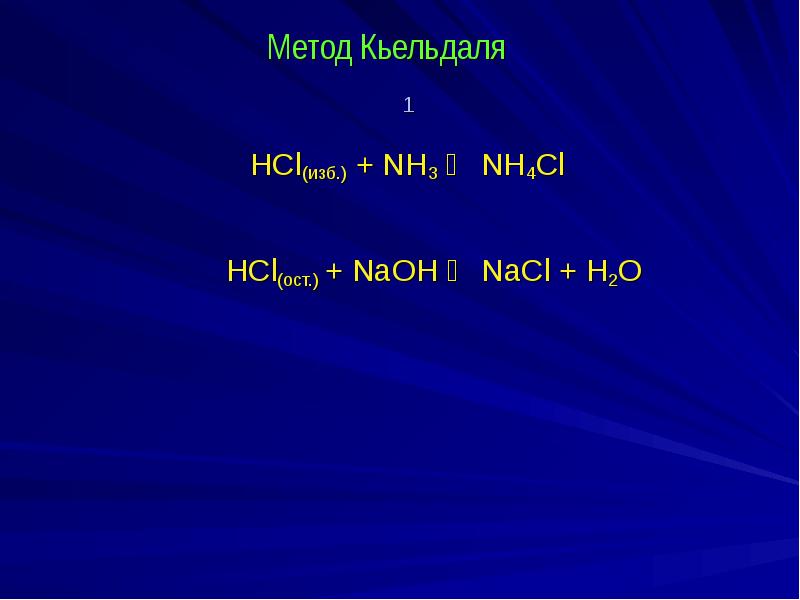
- 4. Метод Кьельдаля 1 HCl(изб.) + NH3 ⇄ NH4Cl НCl(ост.)
- 5. Метод Кьельдаля 2 НВО2 + NH3 ⇄ NH4+ + BO2-
- 6. NO3- и NO2- NO3- и NO2- определяют после их
- 7. Определение серы Определение серы проводят путем сжигания органического
- 8. Галогены Галогены Хлор-, бромсодержащие органические вещества после разрушения образуют кислоты:
- 9. Определение фунциональных групп органических соединений Вещества, содержащие карбоксильную (- СООН), сульфогруппу
- 10. Прямая алкалиметрия Полипротонные кислоты титруют в соответствии с величинами их
- 11. Органические оксикарбоновые кислоты: Глюконовая (Ка =1,4∙ 10-4) титруется как одноосновная:
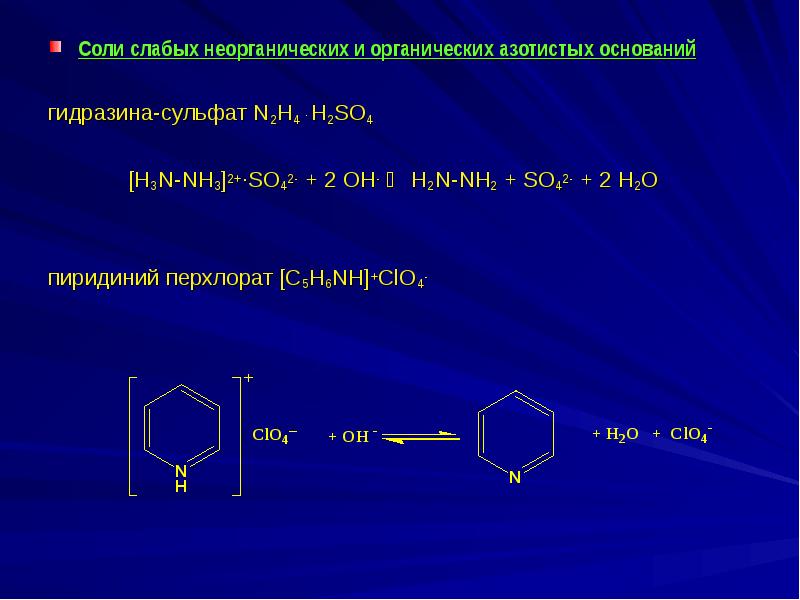
- 12. Соли слабых неорганических и органических азотистых оснований Соли слабых
- 13. Прямая ацидиметрия Прямая ацидиметрия щелочи (NaOH, KOH, Ba(OH)2); органические основания
- 14. Способы обратного титрования кислот и оснований Определение раствора аммиака NH3·H2O
- 15. Способ заместительного кислотно-основного титрования Определение оксида ртути(II) HgO + 4 I-
- 16. Скачать презентацию












Слайды и текст этой презентации
Скачать презентацию на тему Применение метода кислотно-основного титрования в количественном анализе химических веществ и лекарственных средств. (Ле можно ниже:
Похожие презентации