Реальный газ и его работа. (лекция 5в) презентация
Содержание
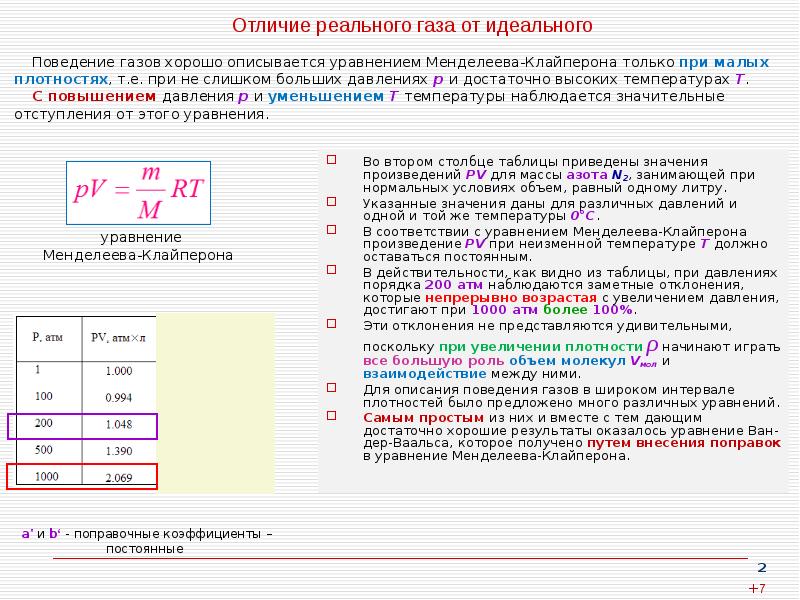
- 2. Отличие реального газа от идеального Во втором столбце таблицы приведены значения
- 3. Вывод уравнения Ван-дер-Ваальса Вывод: наличие сил притяжения и отталкивания приводит к
- 4. Вывод уравнения Ван-дер-Ваальса-2 лучше согласуется с опытными данными, чем уравнение Клапейрона-Менделеева,
- 5. Изотермы Ван-дер-Ваальса Обсудим уравнения Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса – графический вид
- 6. Экспериментальные изотермы реального газа. Кривая фазового перехода Томас Эндрюс в 1866
- 7. Обобщим изотермы реального газа Линии Синие — изотермы при температуре ниже критической.
- 8. Критические параметры Критические параметры - изотерма реального газа, соответствующая критической температуре
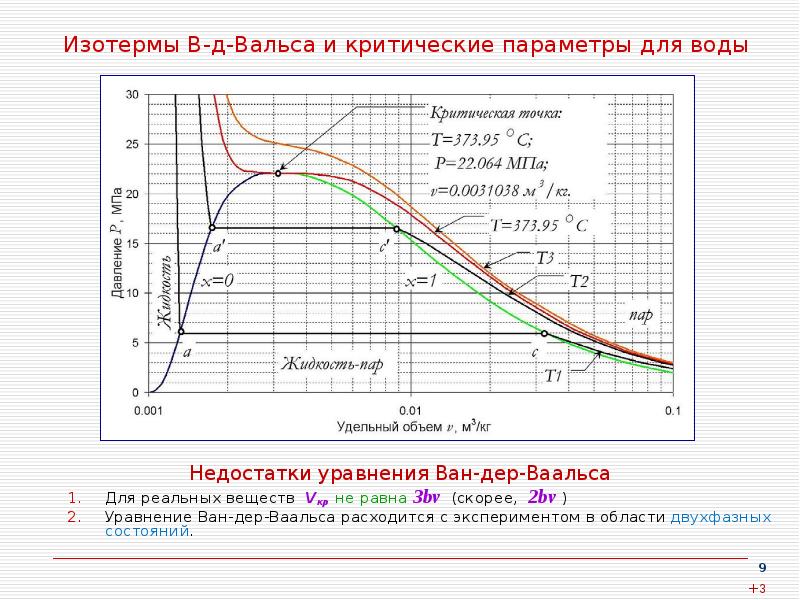
- 9. Изотермы В-д-Вальса и критические параметры для воды Недостатки уравнения Ван-дер-Ваальса Для
- 10. Внутренняя энергия реального газа Внутренняя энергия Uреал реального газа равна сумме
- 11. Спасибо за внимание! Курс физики для студентов 1 курса БГТУ Кафедра
- 12. Скачать презентацию









Слайды и текст этой презентации
Скачать презентацию на тему Реальный газ и его работа. (лекция 5в) можно ниже:
Похожие презентации





























