Структура енергетичних рівнів молекул презентация
Содержание
- 2. Згідно з квантовою механікою енергія всіх видів руху в молекулі може
- 3. Тоді повна енергія молекули є сумою квантованих значень енергії трьох видів
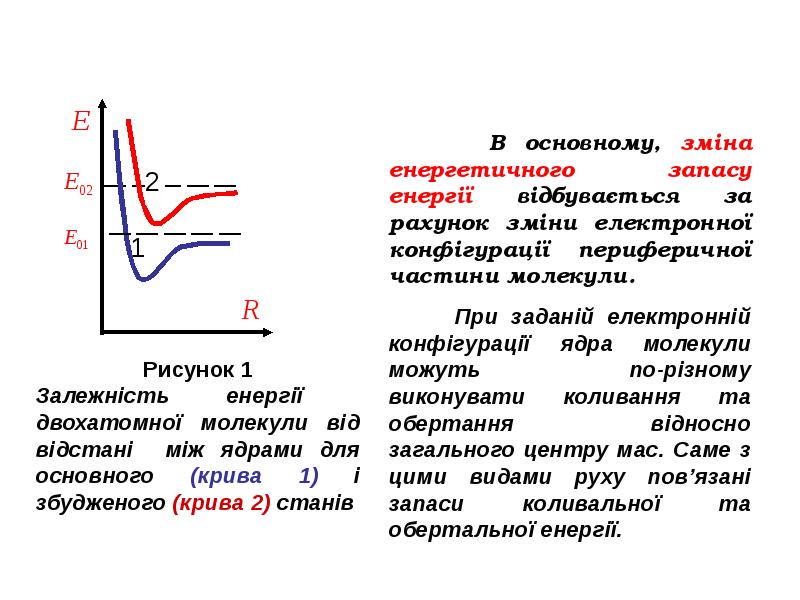
- 5. Електронна енергія – це енергія, обумовлена електронною конфігурацією. Вона має мінімум
- 6. Правила добору – це правила, які визначають можливі квантові переходи для
- 7. Коливання ядер у молекулі описують за допомогою моделі квантового гармонічного осцилятора.
- 8. Розглянемо обертання молекули. Енергія системи, яка має момент інерції I та
- 9. Таким чином, обертальна енергія молекули може набувати лише дискретних значень: Таким
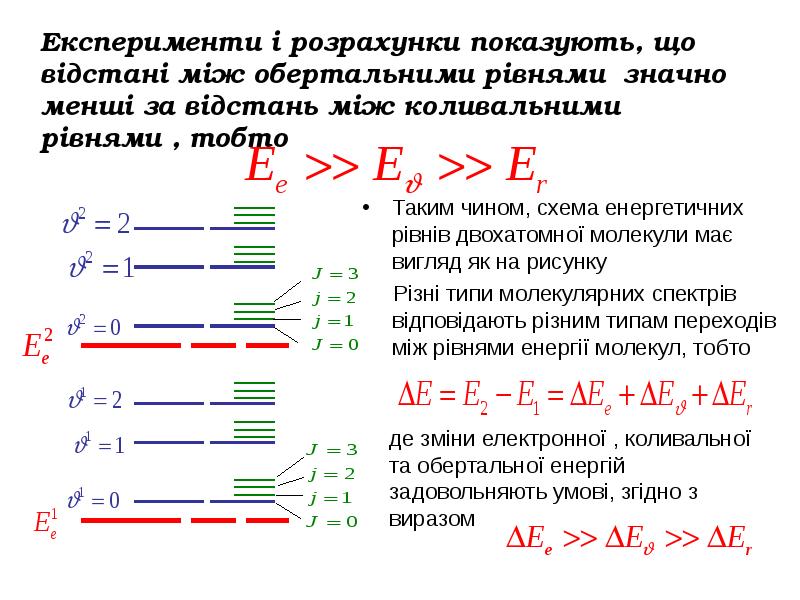
- 10. Експерименти і розрахунки показують, що відстані між обертальними рівнями значно менші
- 11. На відміну від лінійчастих спектрів атомів молекулярні спектри складаються із смуг,
- 13. З правила добору для дозволених переходів
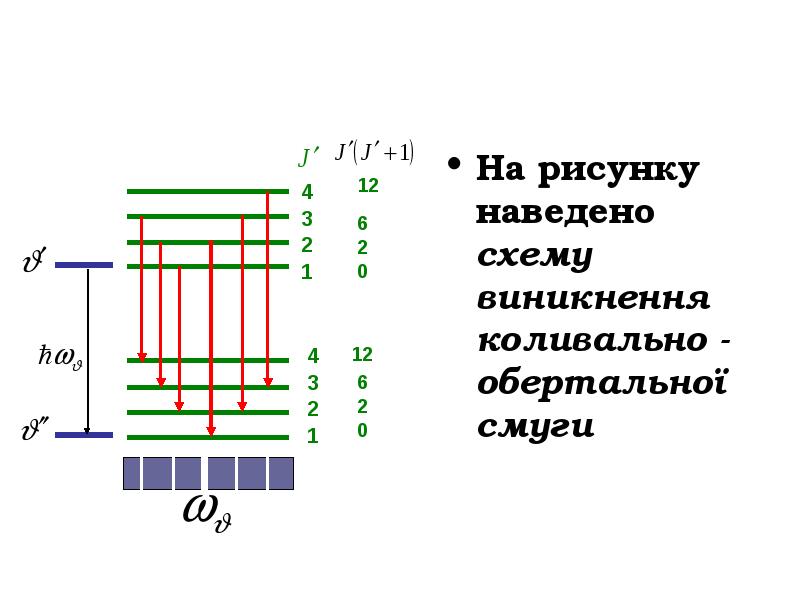
- 15. На рисунку наведено схему виникнення коливально - обертальної смуги На
- 16. У випадку, коли під час переходу змінюється і коливальний і обертальний
- 17. У молекул є велика кількість збуджених електронних рівнів, переходи між якими
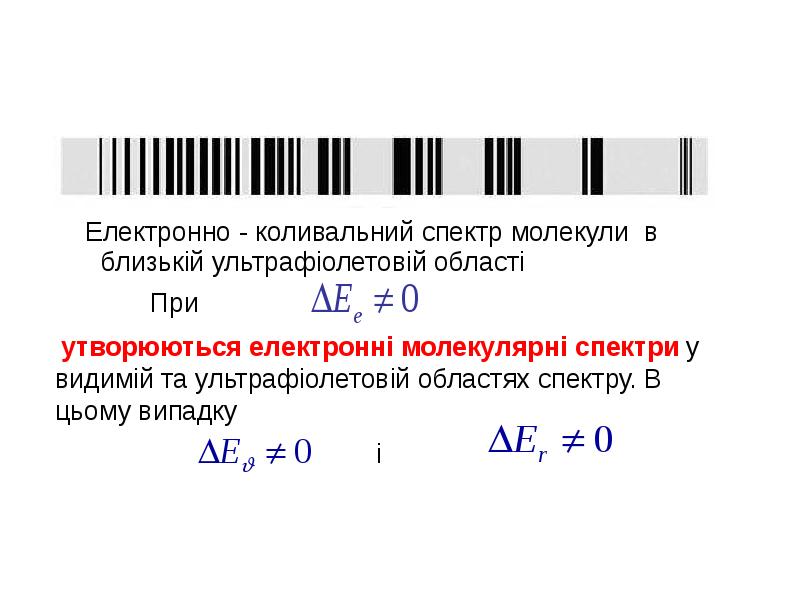
- 18. Електронно - коливальний спектр молекули в близькій ультрафіолетовій області Електронно
- 19. Методи молекулярної спектроскопії, які вивчають молекулярні спектри, дозволяють вирішувати різно-манітні завдання
- 20. Рентгенівське випромінювання - це електромагнітне іонізуюче випромінювання, яке займає спектральну область
- 21. Рентгенівські промені було відкрито в 1895 р. Рентгеном і названі
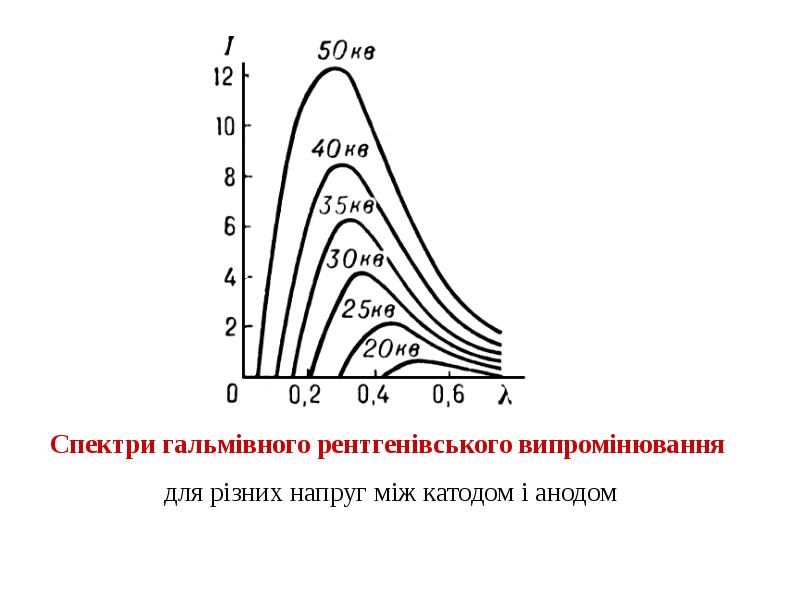
- 24. Гальмівне випромінювання
- 25. Характеристичне випромінювання
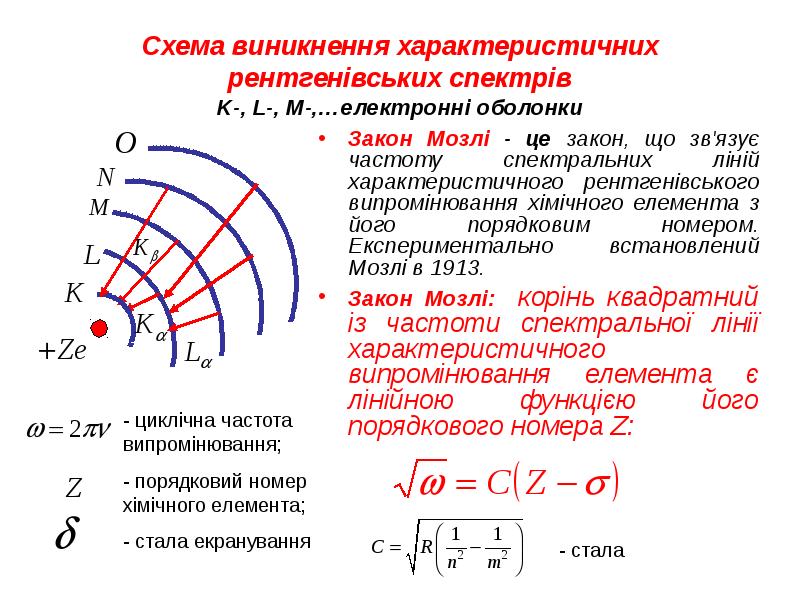
- 26. Схема виникнення характеристичних рентгенівських спектрів K-, L-, M-,…електронні оболонки Закон Мозлі
- 27. Закон Мозлі Згідно з цим законом, частоти лінії можна визначити з
- 28. МОЗЛІ, ГЕНРІ ГВІН ДЖЕФРІС Англійський фізик. Навчався в Ітоні та
- 29. Застосування рентгенівських променів
- 30. Слово "лазер" складене з початкових букв в англійському словосполученні Light Amplification
- 31. Мейман Теодор
- 32. Академік БАСОВ Басов Микола Геннадійович – відомий радянський фізик віце
- 33. Академік Прохоров
- 34. Чарлз Таунс
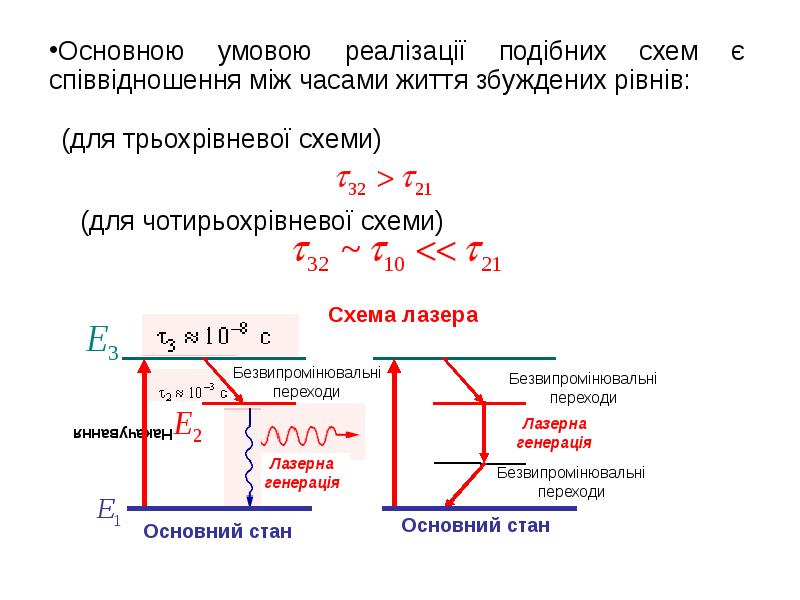
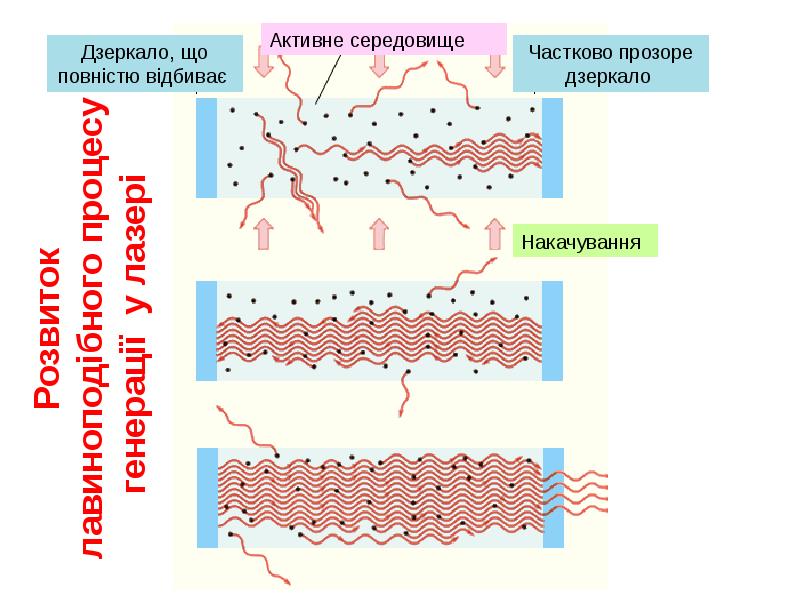
- 38. Як довів Ейнштейн у стані термодинамічної рівноваги вірогідності поглинання і змушеного
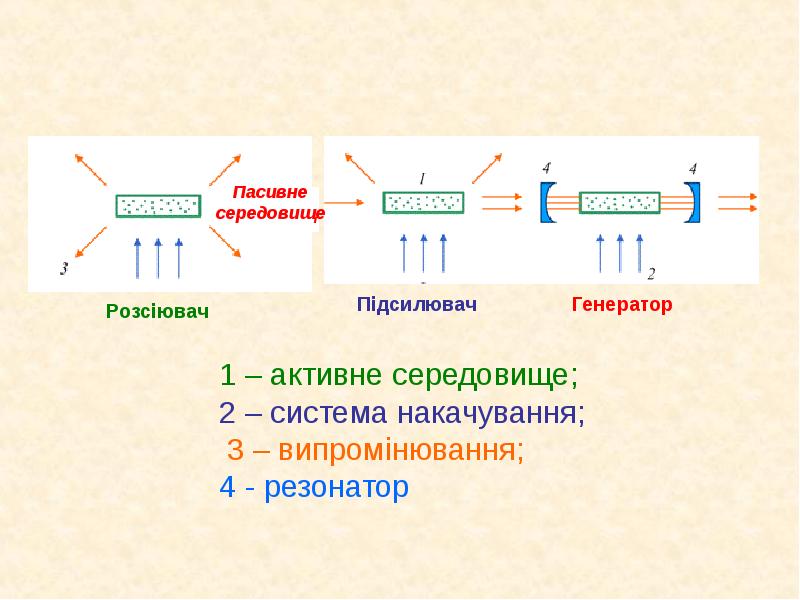
- 40. 1 – активне середовище; 1 – активне середовище; 2
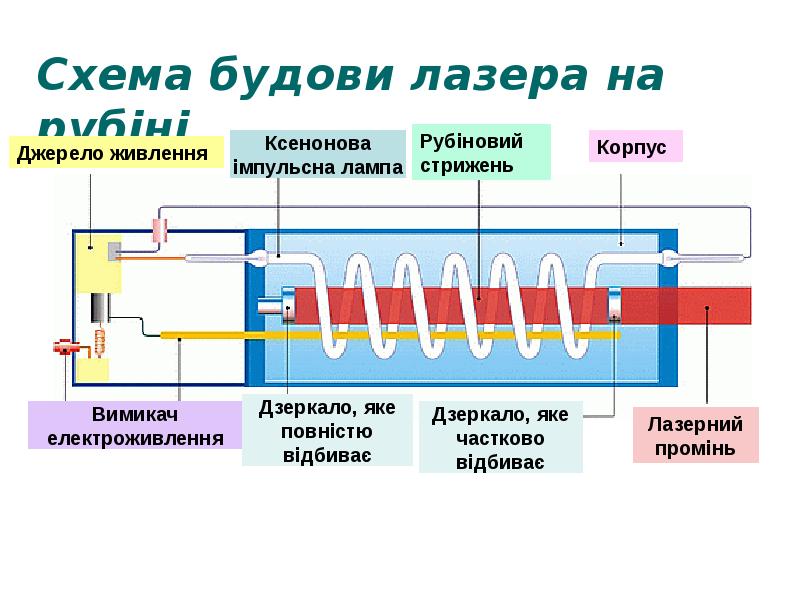
- 42. Рубіновий лазер
- 45. 1) Висока ступінь монохроматичності. 1) Висока ступінь монохроматичності. На практиці
- 47. Скачать презентацию


































Слайды и текст этой презентации
Скачать презентацию на тему Структура енергетичних рівнів молекул можно ниже:
Похожие презентации





























