Термодинамические распределения презентация
Содержание
- 2. 1. Некоторые сведения из теории вероятности В качестве основной функции,
- 3. Введем величину Введем величину Величина P(xi) называется вероятностью измерения
- 4. f(x) ≥ 0, так как вероятность попадания измеренного значения в интервал
- 5. Если состояние системы характеризуется двумя параметрами x и y, то вероятность
- 6. 2. Распределение Больцмана Рассмотрим случай нахождения идеального газа во внешнем
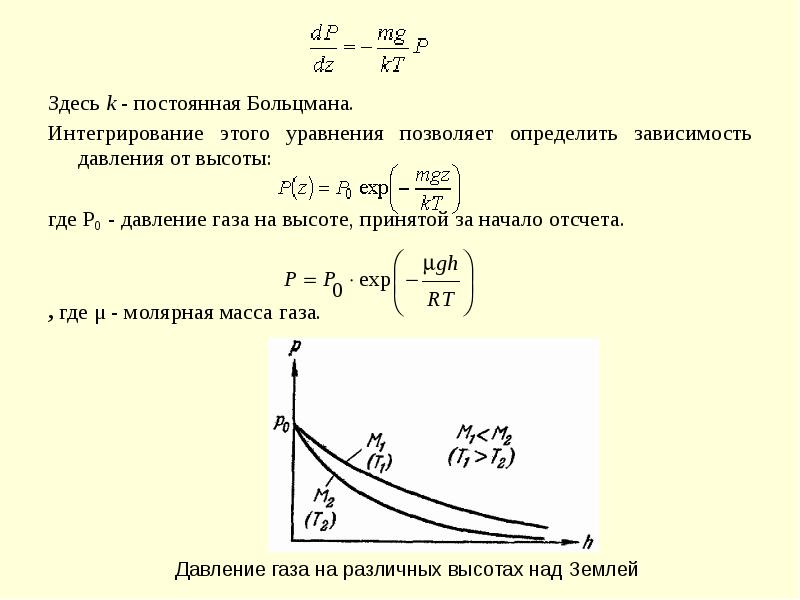
- 7. Здесь k - постоянная Больцмана. Здесь k - постоянная Больцмана. Интегрирование
- 8. Эта зависимость носит название барометрической формулы. Она, в частности, позволяет рассчитывать
- 9. 3. Распределение Максвелла Рассмотренный ниже подход был предложен Максвеллом в
- 10. lnf(x) = lnψ(vx) + lnψ(vy) + lnψ(vz) lnf(x) = lnψ(vx) +
- 11. В этой формуле выбраны бесконечные пределы интегрирования. Но, конечно, реальная скорость
- 12. Второе условие, которое может быть использовано для нахождения неизвестных констант, является
- 13. Соответственно коэффициент a принимает вид Соответственно коэффициент a принимает вид
- 14. Учитывая то, что эта вероятность зависит только от величины скорости и
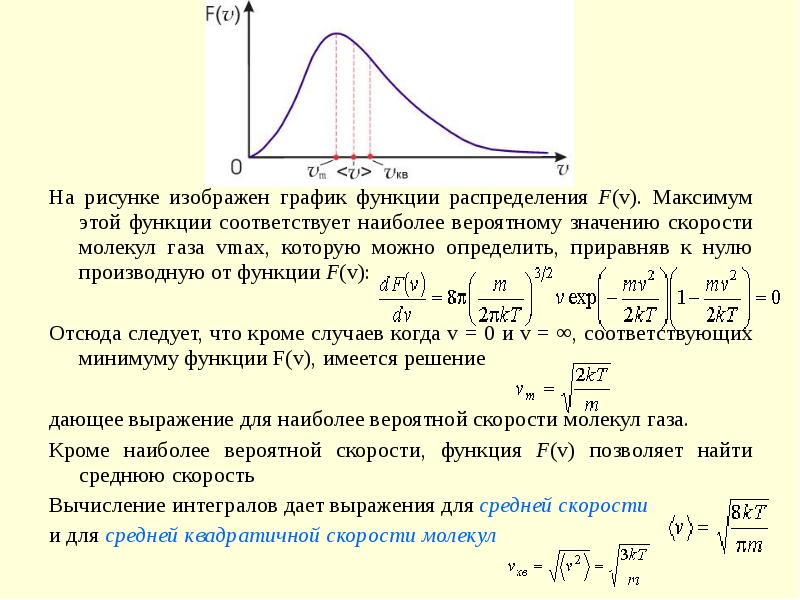
- 15. На рисунке изображен график функции распределения F(v). Максимум этой функции соответствует
- 16. Полученные значения скоростей численно отличаются друг от друга: Полученные значения
- 17. 6. Распределение Максвелла-Больцмана Полученные в предыдущих параграфах распределения Больцмана и
- 18. 5. Экспериментальная проверка распределения Максвелла Первым экспериментальным подтверждением существования распределения
- 19. При пропускании через платиновую нить электрического тока она разогревалась до максимальной
- 20. Прямые измерения скорости атомов ртути в пучке были
- 21. Скачать презентацию


















Слайды и текст этой презентации
Похожие презентации





























