Термохимия. Расчетные задачи. (Лекция 4.2) презентация
Содержание
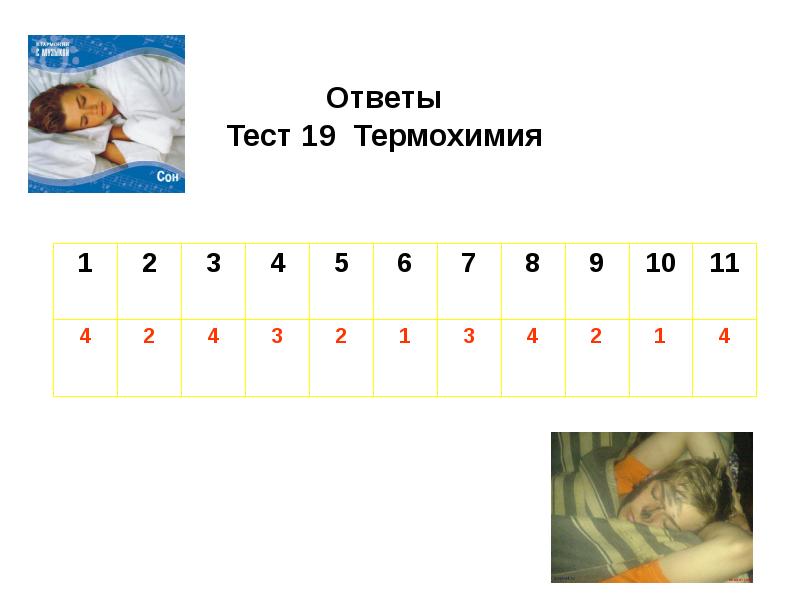
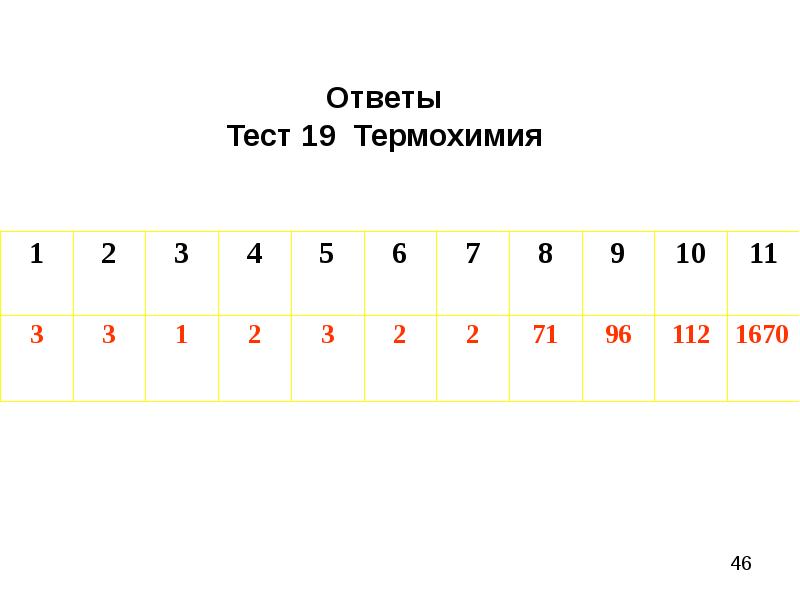
- 21. Тест 19 Термохимия (один вариант ответа)
- 34. Тест 19а Термохимические уравнения. Расчет.
- 35. 1.В соответствии с термохимическим уравнением С6Н12О6(тв) + 6О2(г) → 6СО2(г) +
- 36. 2.В соответствии с термохимическим уравнением С6Н12О6(тв) + 6О2(г) → 6СО2(г) +
- 37. 3.В соответствии с термохимическим уравнением С6Н12О6(тв) + 6О2(г) → 6СО2(г) +
- 38. 4.В соответствии с термохимическим уравнением С6Н12О6(тв) + 6О2(г) → 6СО2(г) +
- 39. 5.В соответствии с термохимическим уравнением 2Na(тв) + Сl2(г) → 2NaCl(тв) +
- 40. 6.В соответствии с термохимическим уравнением 2Na(тв) + Сl2(г) → 2NaCl(тв) +
- 41. 7.Согласно термохимическому уравнению ZnS(тв.) +2НСl(г) →ZnCl2( тв.) +H2S(г) + 139,3 кДж,
- 42. 8.Теплота образования 1 моль жидкой воды из простых веществ равна 284
- 43. 9.Теплота образования 1 моль SO2 (г) из простых веществ равна 297
- 44. 10. Теплота образования 1 моль SO2 (г) из простых веществ равна
- 45. 11. При соединении 12 г алюминия с кислородом выделяется 371,1 кДж
- 47. Спасибо за внимание!
- 48. Скачать презентацию






































Слайды и текст этой презентации
Скачать презентацию на тему Термохимия. Расчетные задачи. (Лекция 4.2) можно ниже:
Похожие презентации





























