Виды контроля коррозии презентация
Содержание
- 3. Точки пересечения прямых Е-lg и E-lg для каждой из двух ОВР
- 4. В реальном коррозионном биэлектроде ( М в растворе, содержащем Мn+ ,
- 5. C учетом (8) и (9) переходит в (12), j ipM.
- 6. Если условия (12) и (13) не соблюдаются, потенциал под током не
- 7. В ы х о д п о т о к у
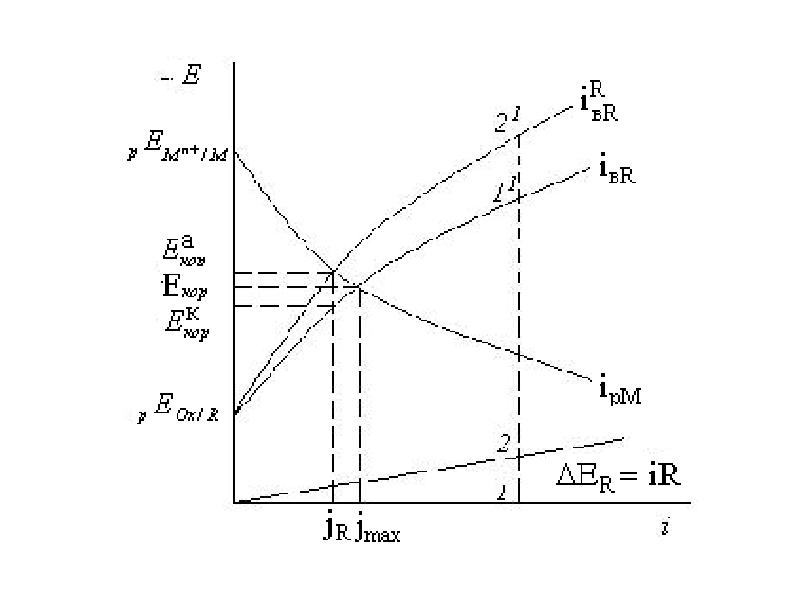
- 8. Если между катодным и анодным участками существует омическое падение напряжения. Графически
- 9. пересечения дает один Екор и максимальную скорость коррозии jмах. Для учета
- 11. Виды контроля коррозии При стационарном Екор растворение металла и катодная деполяризация
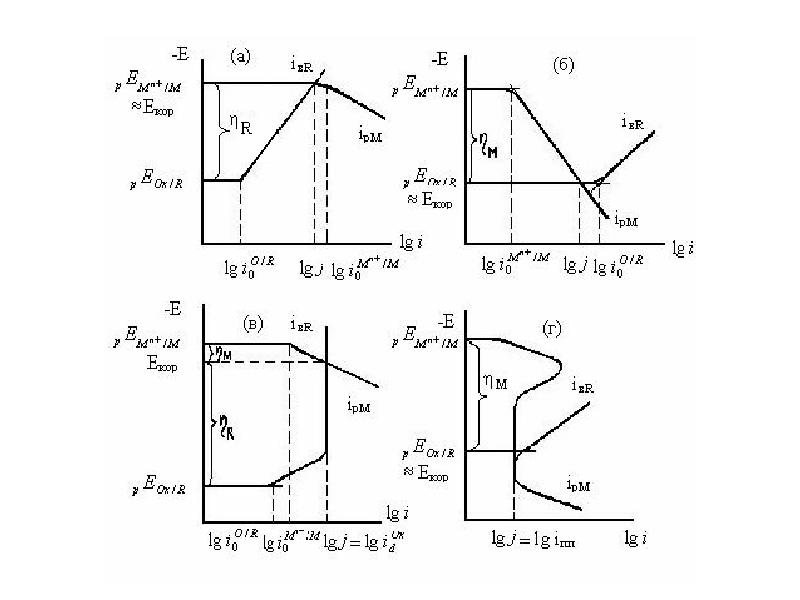
- 13. Рис. а,б иллюстрируют роль i0. Если , процесс протекает с катодным
- 14. На рис. в,г показана роль крутизны поляризационных кривых. При bк
- 15. Сложные коррозионные системы Короткозамкнутая система ( R0), у которой поверхность
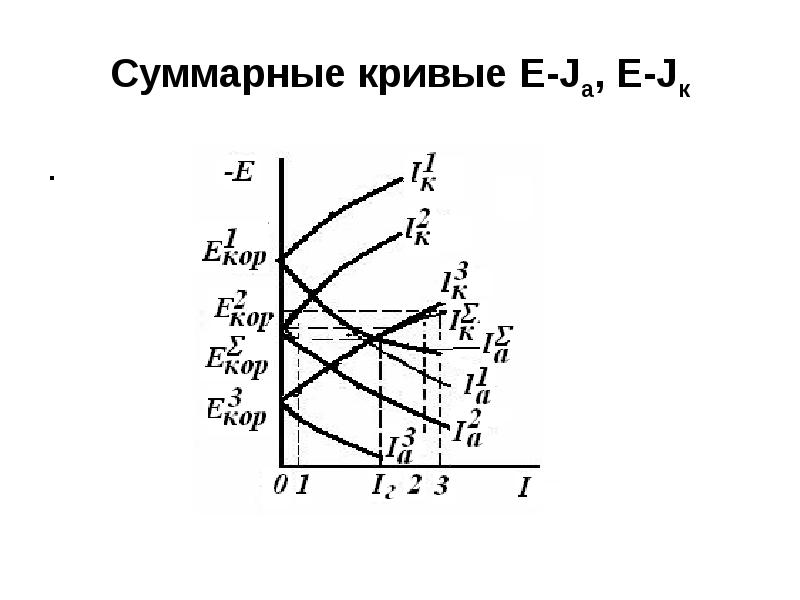
- 16. Суммарные кривые E-Ja, E-Jк .
- 17. Кривая (
- 18. при М1 и М2 являются анодами, причем
- 19. Используя J вместо i , получаем Используя J
- 20. Парциальные кривые
- 21. Эти кривые идут от равновесного потенциала, а не от Екор. Аналогично
- 22. По данным рис. М1 – анод, М2 – слабый катод, а
- 23. Скачать презентацию

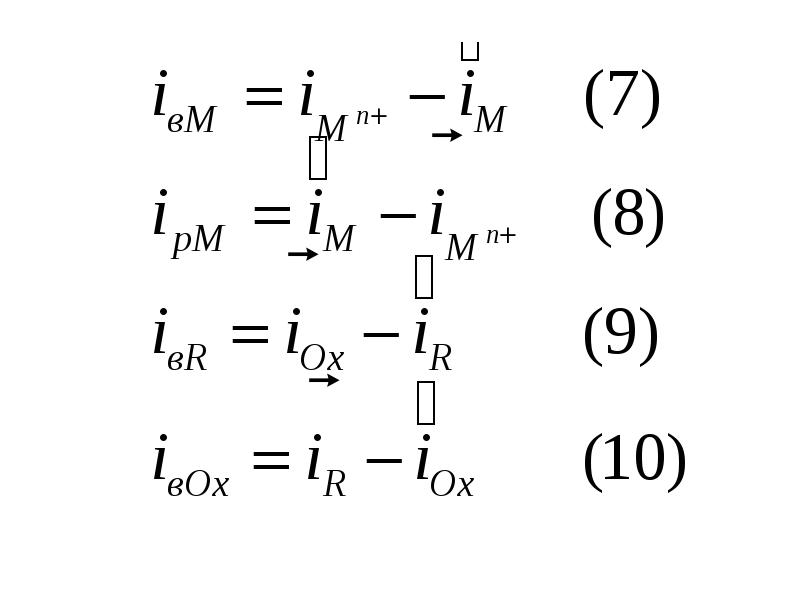

















Слайды и текст этой презентации
Похожие презентации





























