Второе начало термодинамики. Энтропия презентация
Содержание
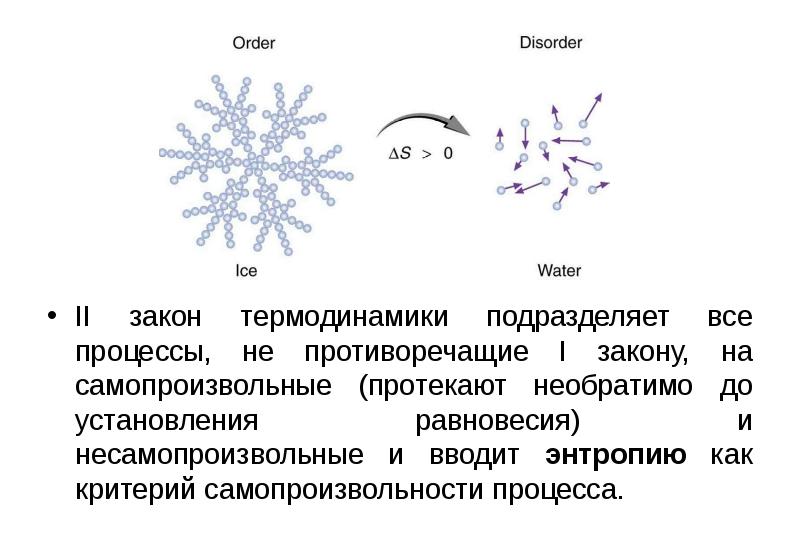
- 2. II закон термодинамики подразделяет все процессы, не противоречащие I закону, на
- 3. Вечный двигатель 2-го рода не существует. Энергия Вселенной постоянна, а её
- 4. Существует экстенсивная функция состояния системы – энтропия S, которая возрастает в
- 7. Статистический характер II закона термодинамики Не абсолютный закон природы, применим только
- 8. Вероятностный характер II закона термодинамики. В необратимом самопроизвольном процессе система переходит
- 9. S = KlnW W – термодинамическая вероятность (число способов, которыми
- 11. Расчет изменения энтропии в различных процессах
- 14. Постулат Планка (третий закон термодинамики) Абсолютная энтропия
- 16. б) при наличии фазовых превращений вещества на интервале от 0 до
- 17. Следствия из постулата Планка
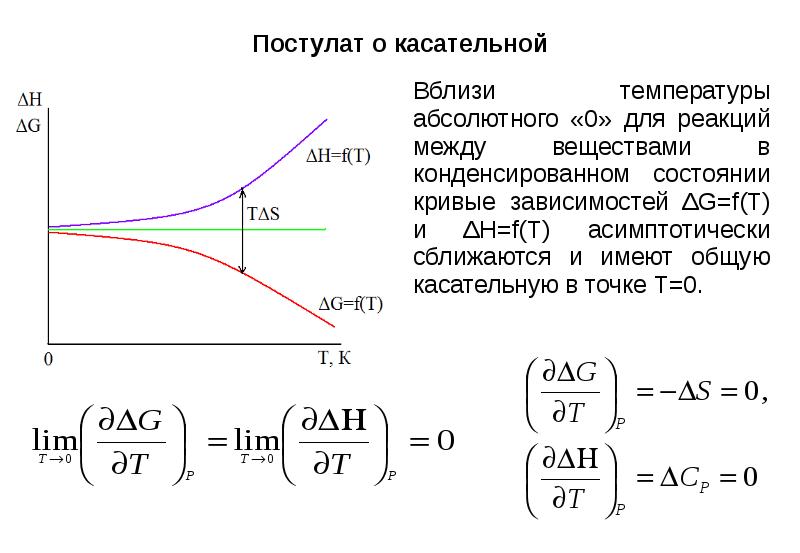
- 18. Постулат о касательной
- 19. Скачать презентацию
















Слайды и текст этой презентации
Скачать презентацию на тему Второе начало термодинамики. Энтропия можно ниже:
Похожие презентации





























