Химическое превращение. Стехиометрическое уравнение. Термодинамический анализ химических превращений. (Тема 4.1-4.2) презентация
Содержание
- 2. Тема 4 (4.1 - 4.2) Химическое превращение Стехиометрическое уравнение Термодинамический
- 3. Целью исследований химического процесса на уровне химической реакции является построение кинетической
- 4. Химическое превращение Химической реакцией считается любое изменение вещества, при котором образуются
- 5. Химическое превращение В газовой фазе при обычных условиях молекулы занимают лишь
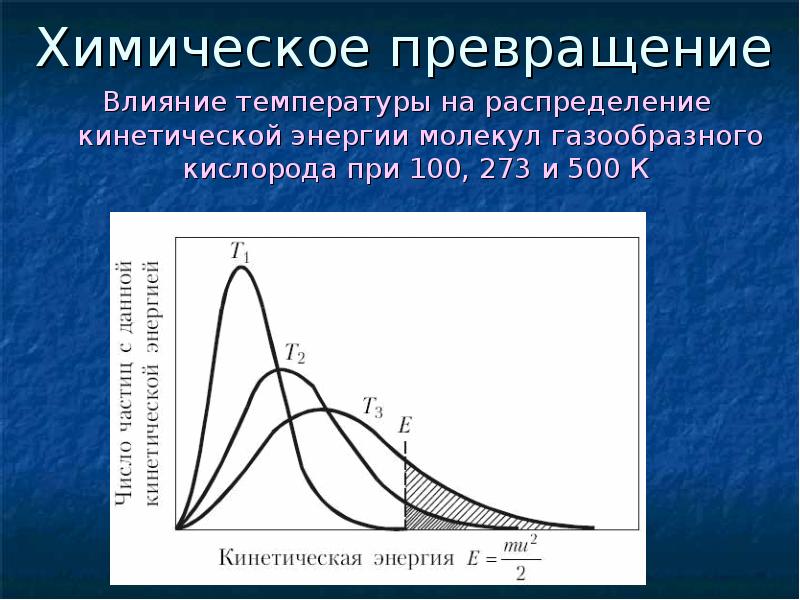
- 6. Химическое превращение Вероятность возникновения реакции при столкновении зависит от кинетической энергии
- 7. Химическое превращение Влияние температуры на распределение кинетической энергии молекул газообразного кислорода
- 8. Химическое превращение Возможность прохождения реакции между веществами в общем случае зависит:
- 9. Химическое превращение Вероятность того, что столкнувшиеся молекулы будут иметь достаточную для
- 10. Стехиометрическое уравнение Стехиометрические уравнения составляются на основе фундаментальных законов природы: -
- 11. Стехиометрическое уравнение Простая реакция (реакция окисления диоксида серы): SO2 +
- 12. Стехиометрическое уравнение Базисная система стехиометрических уравнений, однозначно и полно описывающая баланс
- 13. Стехиометрическое уравнение Стехиометрически независимыми считаются уравнения, которые не могут быть получены
- 14. Стехиометрическое уравнение Концентрация i-го компонента в реагирующей смеси при изменении объема
- 15. Химическое превращение Пример: конверсия метана СН4 + Н2О = СО +
- 16. Химическое превращение Пример: конверсия метана Концентрации компонентов (в мольных долях)
- 17. Направленность реакции Δ Gр,Т 0 - реакция возможна Δ Gр,Т
- 18. Направленность реакции Изменение химического состава реагирующей смеси приводит к изменению ее
- 19. Направленность реакции Если [(НТ)обр]прод < [(НТ)обр] исх , то выделяется теплота
- 20. Направленность реакции Тепловой эффект реакции В справочной литературе тепловой эффект реакции
- 21. Химическое равновесие Изотерма химической реакции (уравнение Вант-Гоффа) В условиях равновесия
- 22. Химическое равновесие Изотерма химической реакции при равновесии Тогда
- 23. Химическое равновесие Для идеальных газовых смесей и жидкостей Кр зависит: -
- 24. Химическое равновесие Например: при синтезе аммиака при 450 °С по реакции
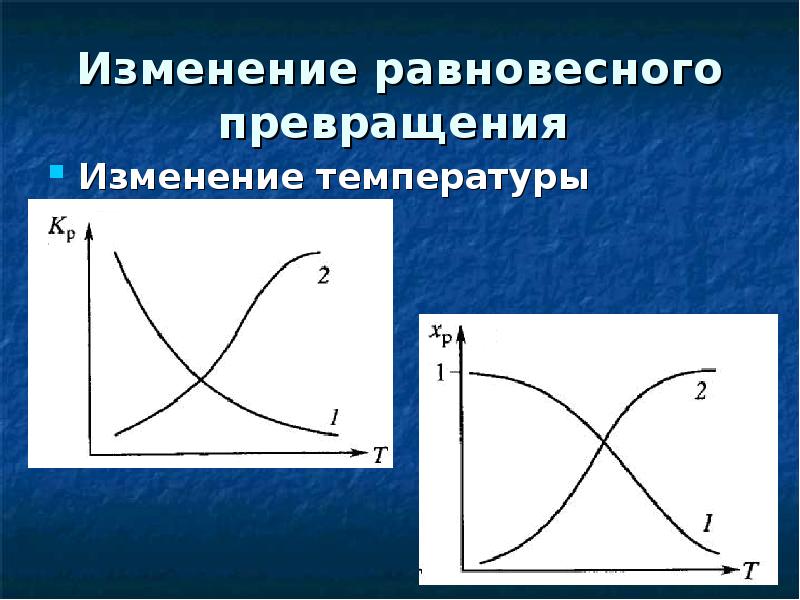
- 25. Изменение равновесного превращения Изменения химического равновесия достигают, изменяя внешние условия
- 26. Изменение равновесного превращения Изменение температуры
- 27. Изменение равновесного превращения Изменение давления При увеличении давления в
- 28. Изменение равновесного превращения Разбавление реакционной смеси инертным веществом Эффект
- 29. Изменение равновесного превращения Избыток и удаление компонентов Равновесие в
- 30. Скачать презентацию

















![Направленность реакции
Если [(НТ)обр]прод < [(НТ)обр] исх , то выделяется теплота Направленность реакции
Если [(НТ)обр]прод < [(НТ)обр] исх , то выделяется теплота](/documents_3/1c549c410908531f39be45d9f8936473/img18.jpg)









Слайды и текст этой презентации
Скачать презентацию на тему Химическое превращение. Стехиометрическое уравнение. Термодинамический анализ химических превращений. (Тема 4.1-4.2) можно ниже:
Похожие презентации





























