Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice презентация
Содержание
- 2. Chestionar Caracteristica generală, proprietăți fizice și chimice ale substanțelor pe clase:
- 3. Subcompetențe Identificarea proprietăților fizice și chimice ale acizilor, bazelor, oxizilor și
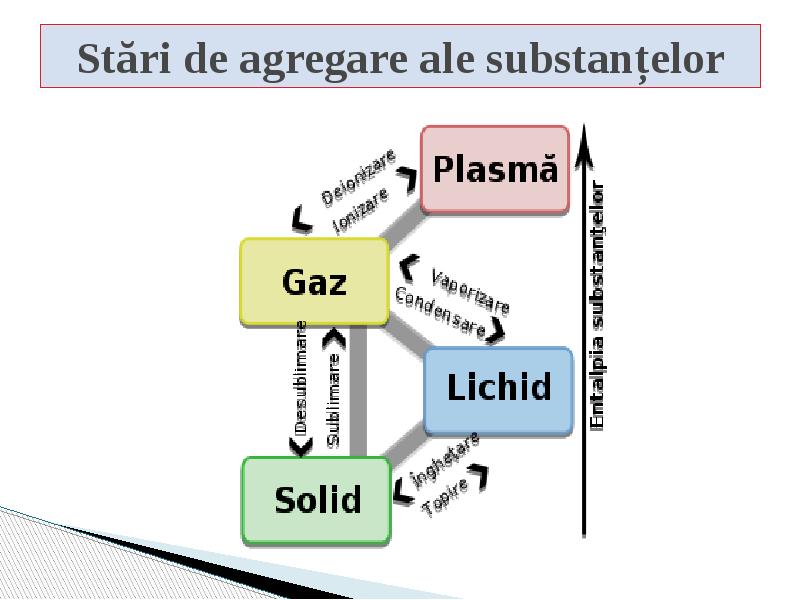
- 4. Stări de agregare ale substanțelor
- 5. Proprietăţi generale Proprietăţi generale
- 6. Clasificarea acizilor și bazelor
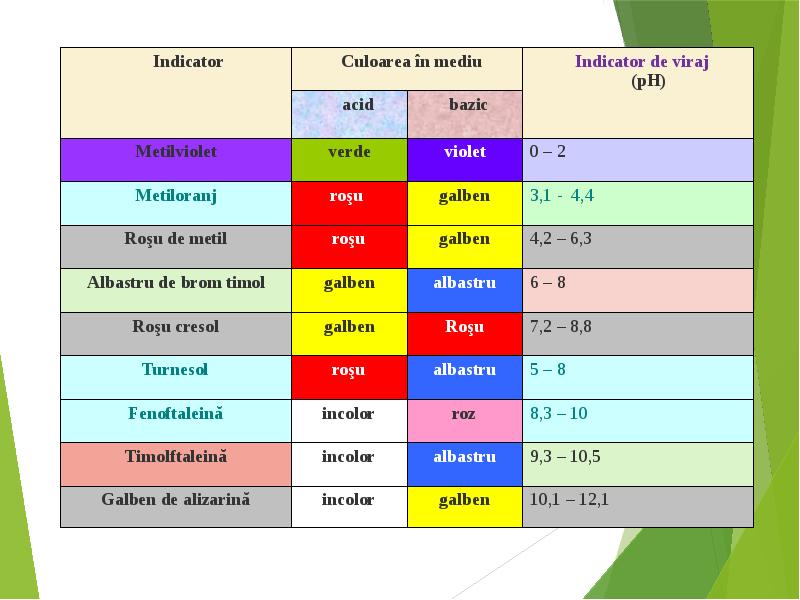
- 7. Indicatorii acido – bazici sunt substanţe organice care îşi schimbă structura
- 9. ProprietATile fizice ale acizilor Acizii sunt substante - gazoase: HCl, H2S
- 10. PROPRIETATILE chimice ale aCIzIlor Acțiunea asupra indicatorilor Soluția de turnesol –
- 11. Reactia acizilor cu oxizii bazici=sare+H2O 2HCl+CaO
- 12. ImportanTa Si utilizarile acizilor Acizii se folosesc în laborator – reactivi
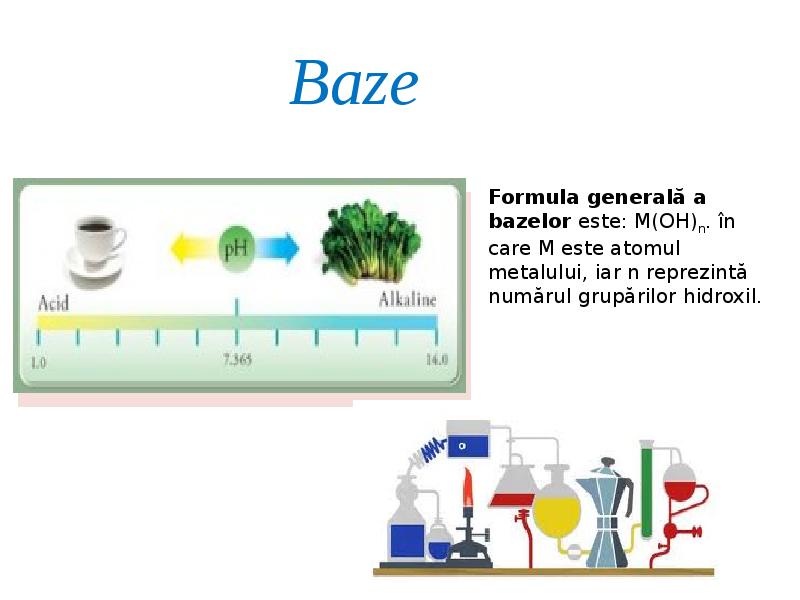
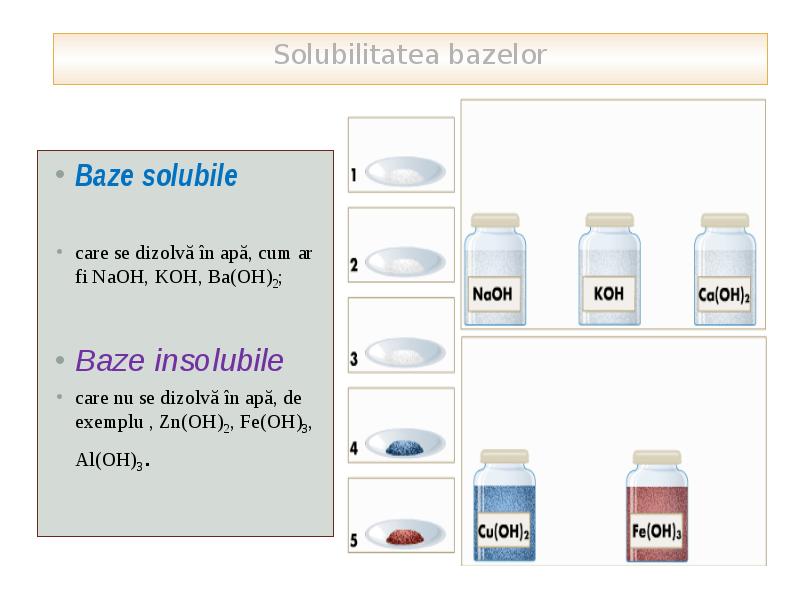
- 14. Baze solubile Baze solubile care se dizolvă în apă, cum ar
- 15. Proprietăți fizice
- 16. Proprietăți chimice
- 18. Oxizii
- 20. METODE DE OBTINERE Reacţii de combinare
- 21. Reacţii de descompunere CaCO3 CaO + CO2 MgCO3 MgO + CO2 CuCO3 CuO + CO2
- 22. proprietăți chimice A)Reacţii cu substanţe simple: Oxizii superiori pot fi
- 23. Reacţii cu substanţe compuse a)Reacţionează cu apa
- 24. Reacţia bazelor cu oxizi acizi oxid acid+ bază => sare + apă
- 25. Importanţă şi utilizări: materii prime: Al2O3 (bauxita), FeO, Fe2O3; materiale de
- 26. Caracteristicile unor oxizi CO Nu întreține arderea, dar arde cu flacară albastră
- 27. sărurile Sărurile sunt combinaţii cu structură ionică, în general, formate prin
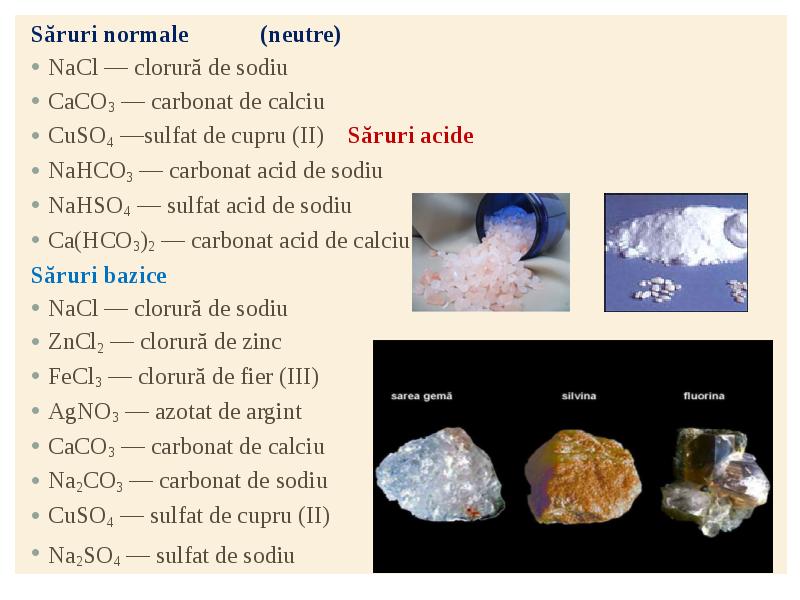
- 28. Săruri normale (neutre) Săruri normale (neutre) NaCl
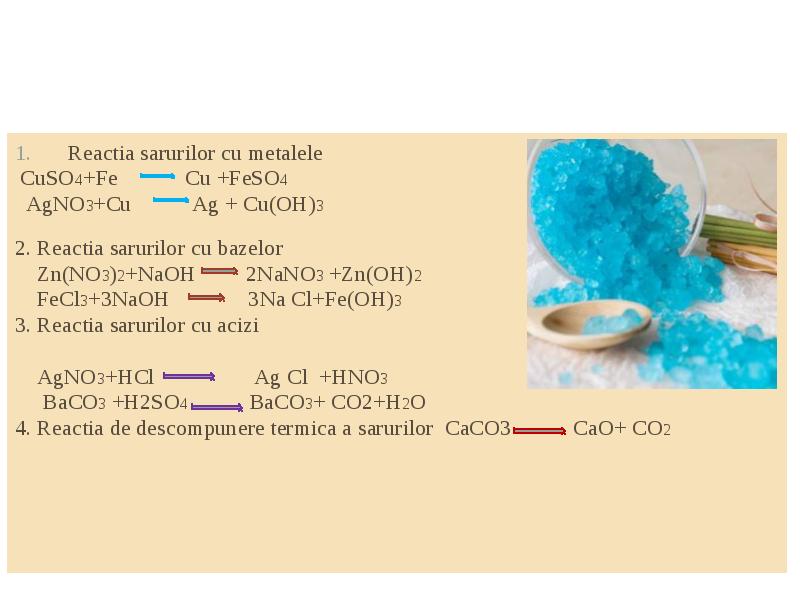
- 29. Reactia sarurilor cu metalele Reactia sarurilor cu metalele CuSO4+Fe
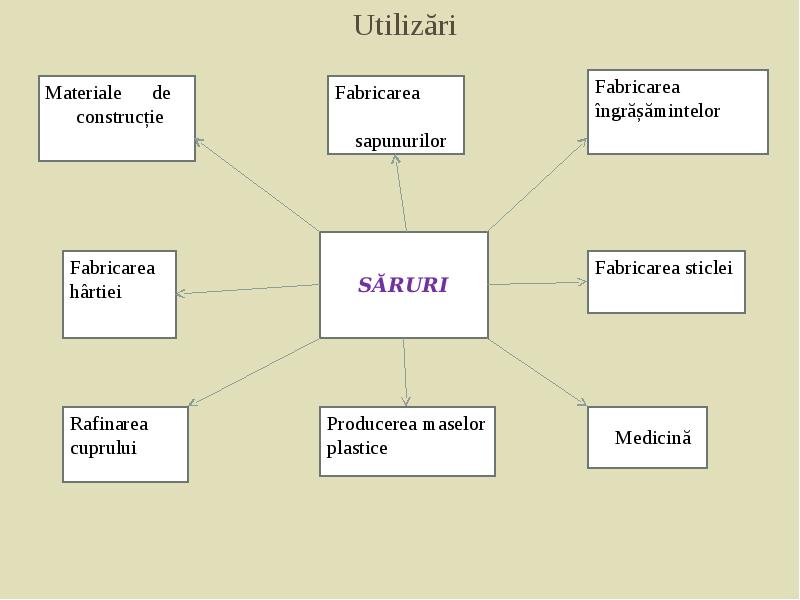
- 30. Utilizări Utilizări
- 31. Bibliografie ro.wikipedia.org facultate.regielive.ro acuz.net docstoc.com olgaotiliaspace.wikispaces.com/file/view/SARURI.pptx medicinasanatate.ro chimsuceava.wordpress.com www.cursuri-online.info/notite/28/oxizi.htm oxizi.wikispaces.com/Oxizi.Proprietat www.focus-energetic.ro
- 32. Скачать презентацию
























Слайды и текст этой презентации
Скачать презентацию на тему Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice можно ниже:
Похожие презентации





























