СОЕДИНЕНИЯ ХРОМА презентация
Содержание
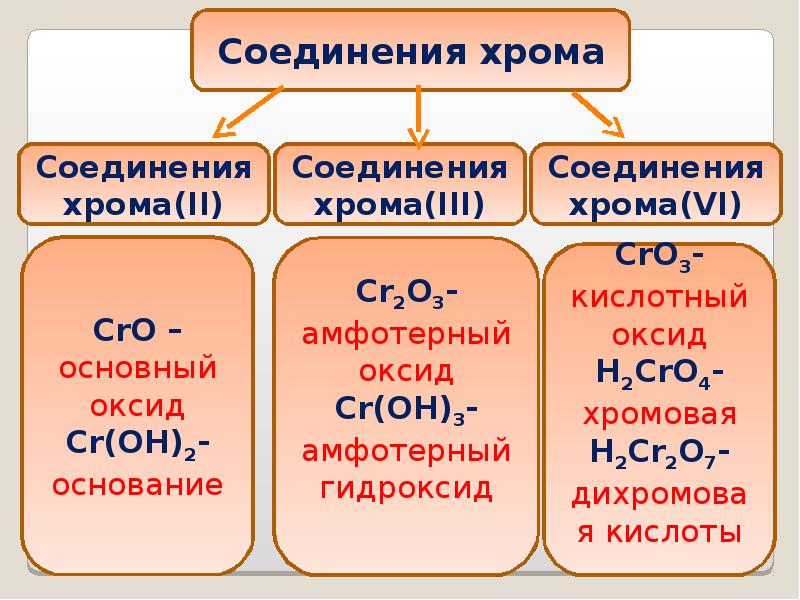
- 11. Оксид хрома (III) обладает амфотерными свойствами Оксид хрома (III) обладает
- 14. Оксид хрома (III) – катализатор Оксид хрома (III)
- 15. Каталитическое окисление этанола Каталитическое окисление этанола Окисление этилового спирта
- 28. Если поместить оксид хрома на фарфоровую пластинку и капнуть на него
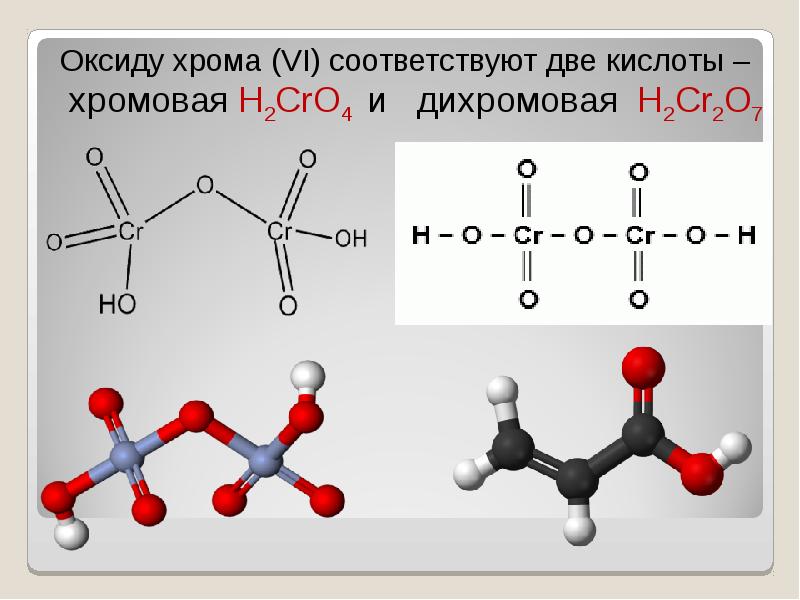
- 30. Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии
- 34. Взаимопревращение хроматов и дихроматов Взаимопревращение хроматов и дихроматов
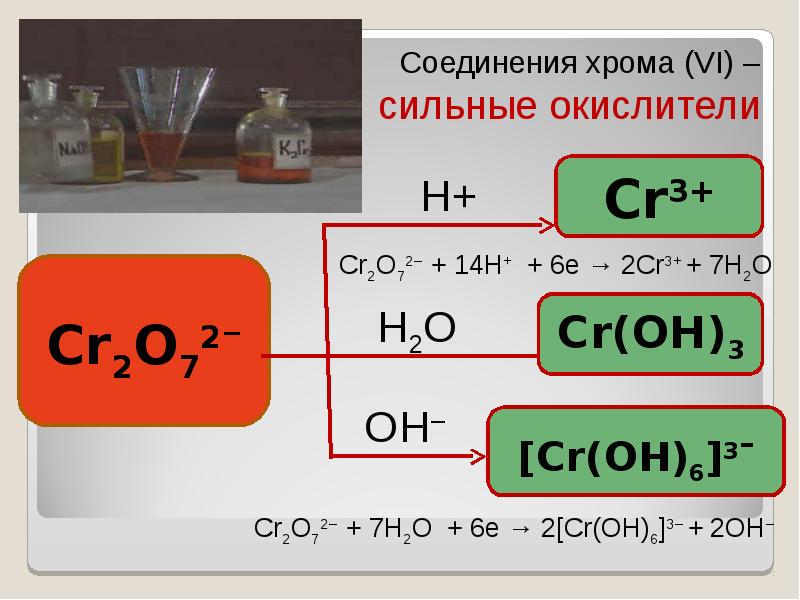
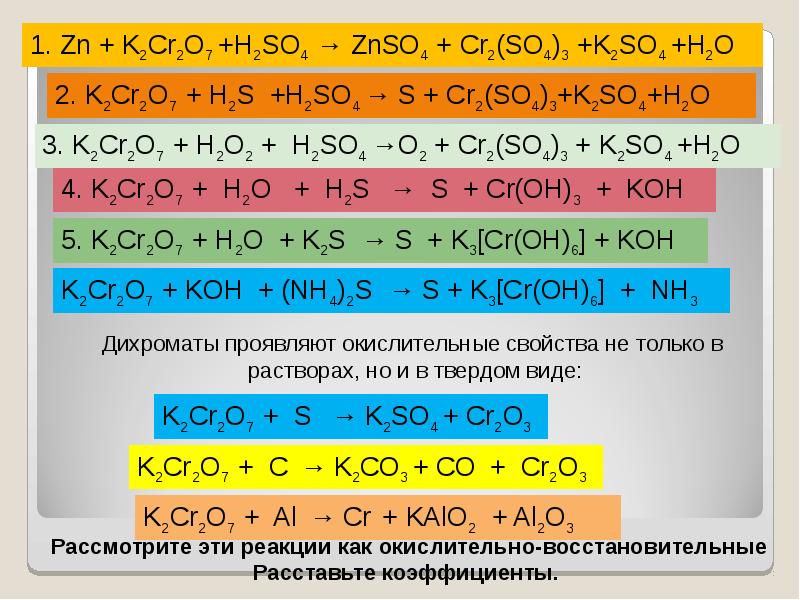
- 36. Окислительные свойства дихроматов Окислительные свойства дихроматов Дихроматы, например дихромат калия
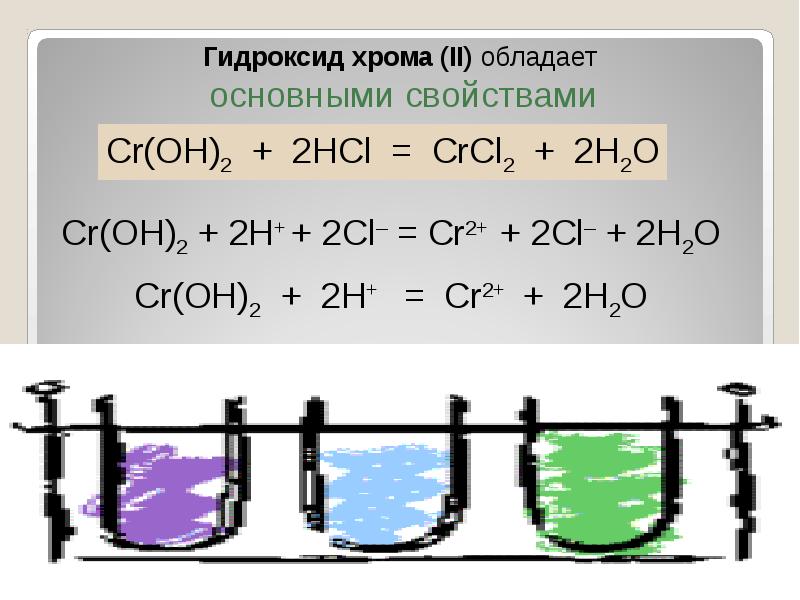
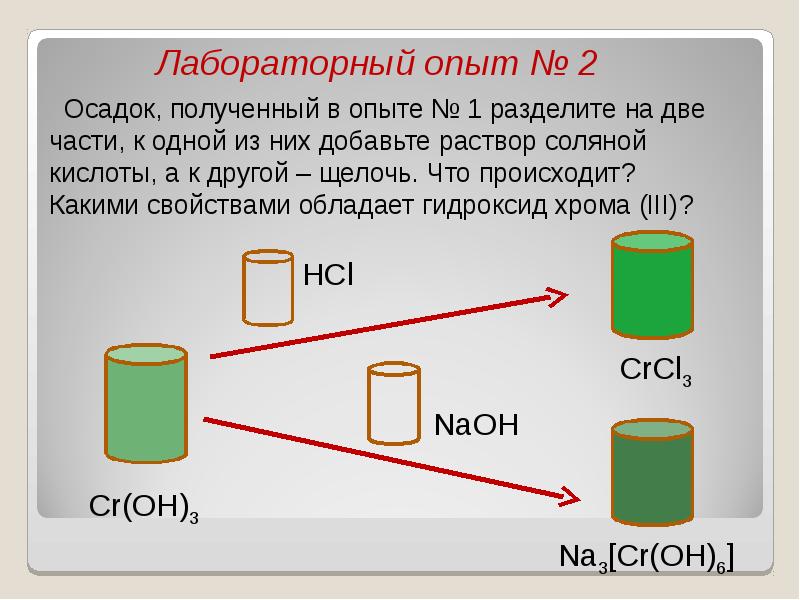
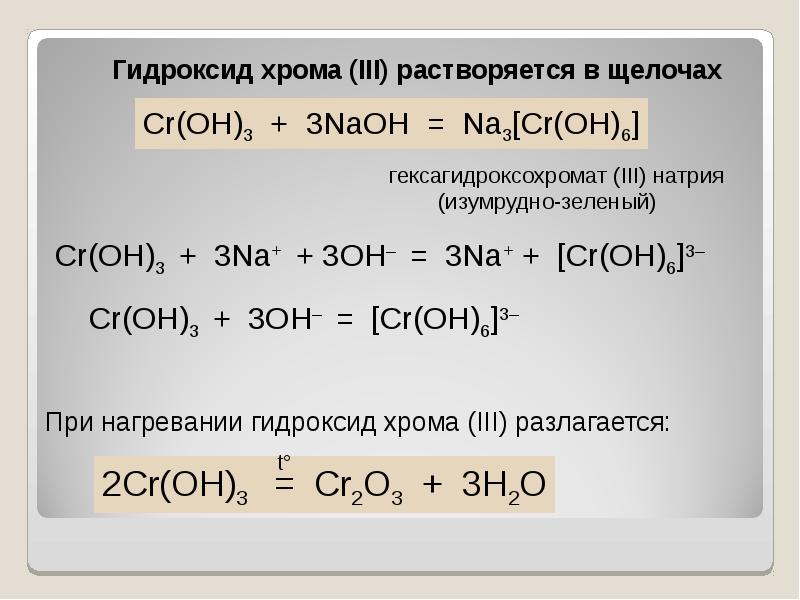
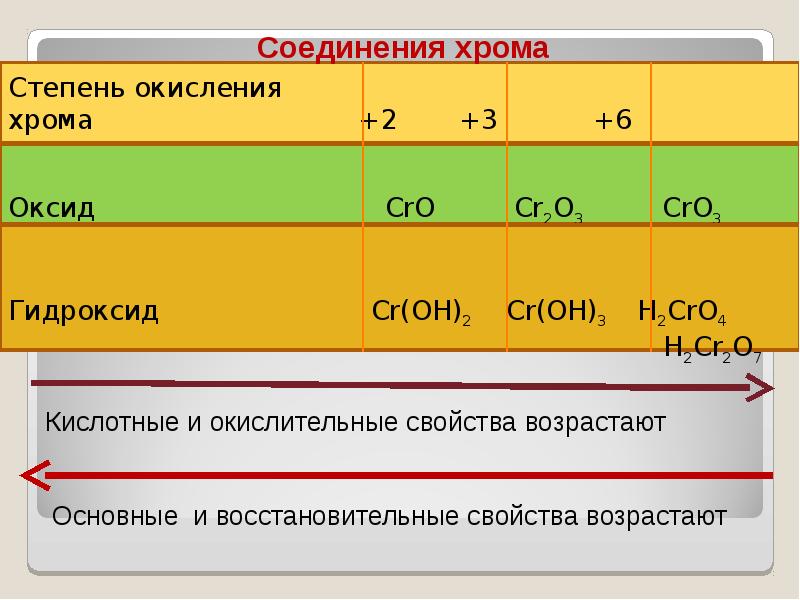
- 40. В ряду гидроксидов хрома различных степеней окисления В ряду
- 42. Домашнее задание: Выполнить ОВР! Используем презентацию «ОВР по теме «ХРОМ»
- 43. СПАСИБО ЗА РАБОТУ!
- 44. Начала химии. Современный курс для поступающих в ВУЗы. – М.: 1Федеративная
- 45. Скачать презентацию




































Слайды и текст этой презентации
Похожие презентации





























