Состав ядра. Ядерные силы (11 класс)
Содержание
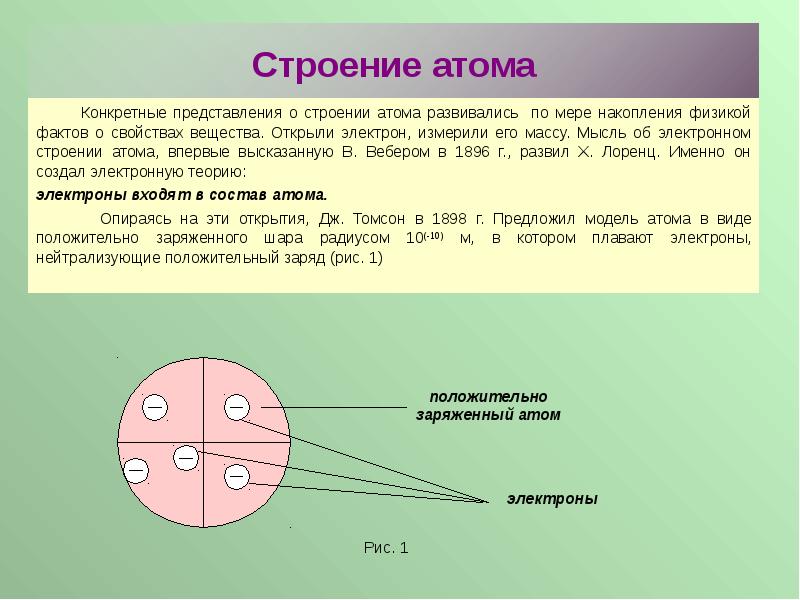
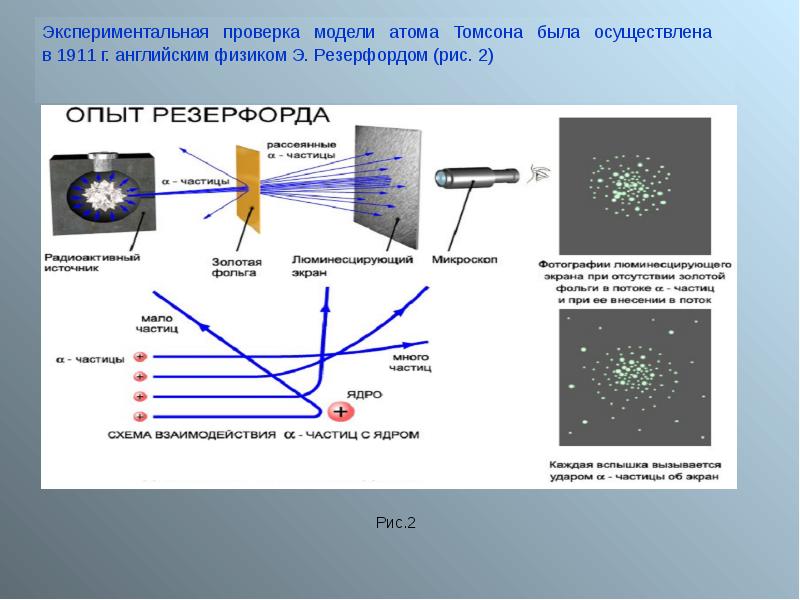
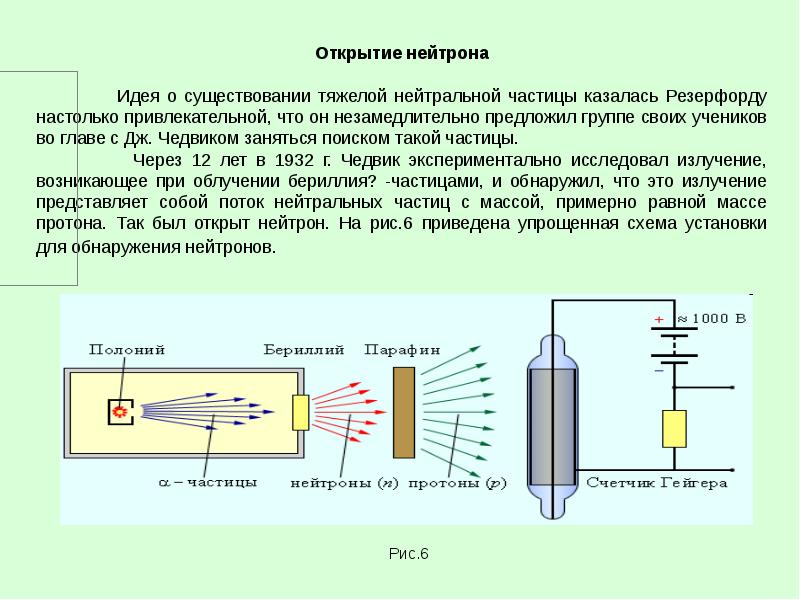
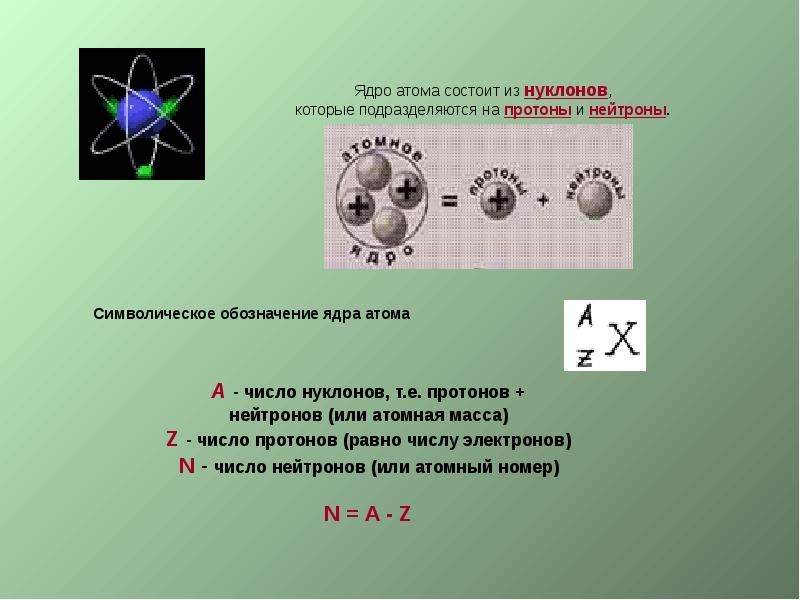
- 2. Строение атома
- 9. ЗНАЕШЬ ЛИ ТЫ ? В середине XX века теория ядра
- 10. Атомы с одинаковыми атомными номерами называют изотопами: в таблице Менделеева они
- 11. Решение задач: Сколько нуклонов, протонов и нейтронов содержится в ядрах следующих
- 12. Домашнее задание: Домашнее задание: п. 105 упр. 14 (4)
- 13. Скачать презентацию







Слайды и текст этой презентации
Презентация на тему Состав ядра. Ядерные силы (11 класс) доступна для скачивания ниже:
Похожие презентации





























