Строение атома. Состав атомных ядер. Изотопы презентация
Содержание
- 2. Цель урока: изучить строение атома, состав атомных ядер, изотопы .
- 3. Эпиграф к уроку «Отыщи всему начало и ты многое
- 5. Демокрит древнегреческий философ В основе философии Демокрита лежит учение об атомах
- 6. Джордж Стони Ирландский физик На основании опытов пришел к выводу, что
- 7. Джозеф Джон Томсон английский физик В 1904 году представил свою новую
- 8. Опыт Дж. Томсона и Ж. Перрена
- 9. Антуан Анри Беккерель французский физик
- 10. Опыт Резерфорда Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки.
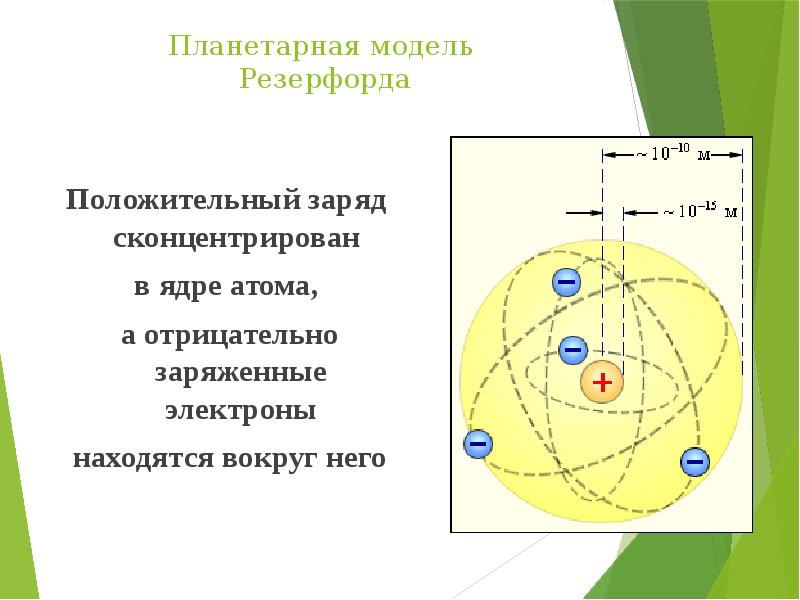
- 11. Планетарная модель Резерфорда Положительный заряд сконцентрирован в ядре атома, а
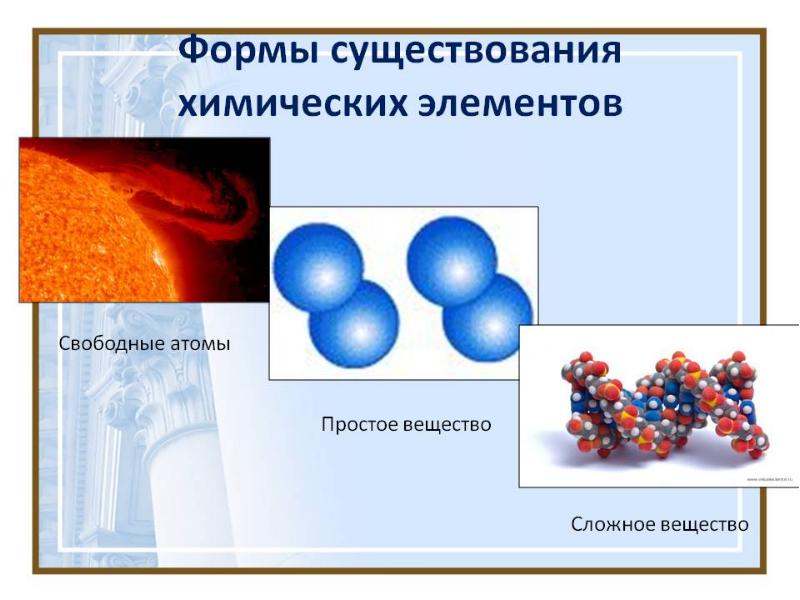
- 12. АТОМ - это химические частицы, являющиеся пределом химического разложения любого
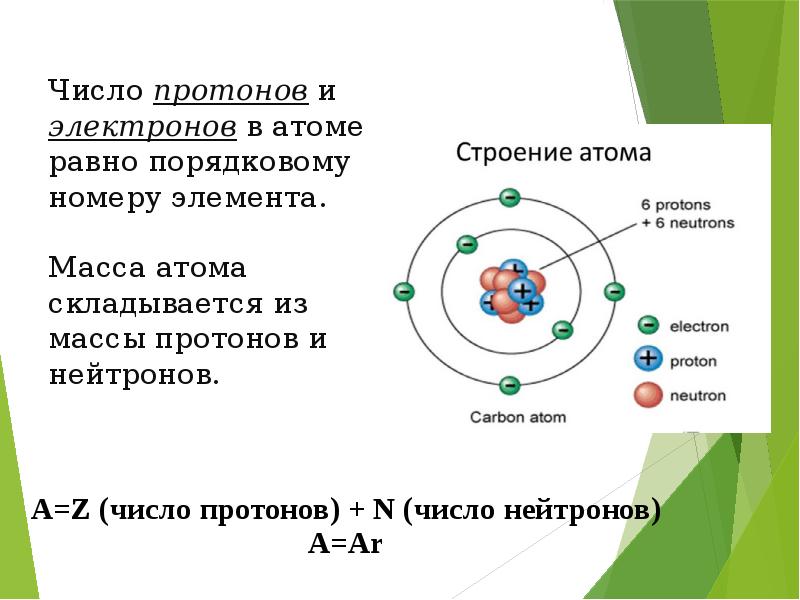
- 13. Число протонов и электронов в атоме равно порядковому номеру элемента.
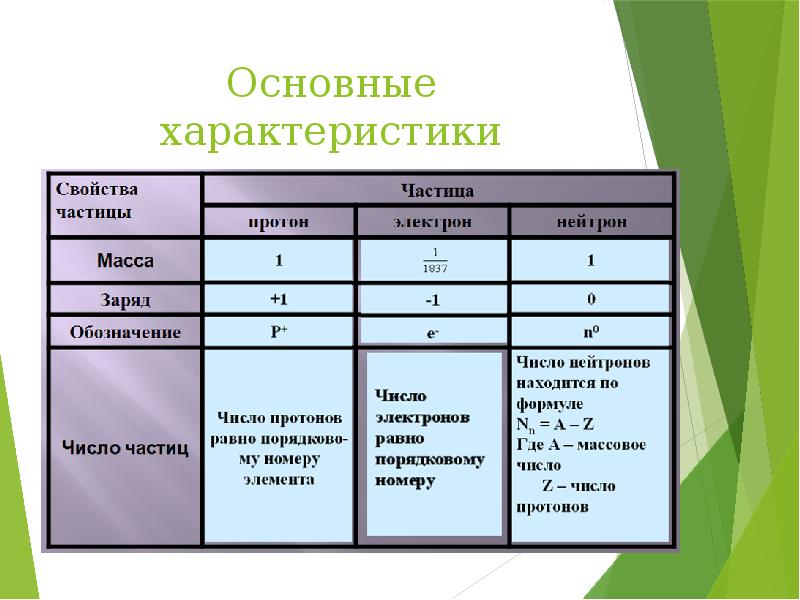
- 14. Основные характеристики элементарных частиц
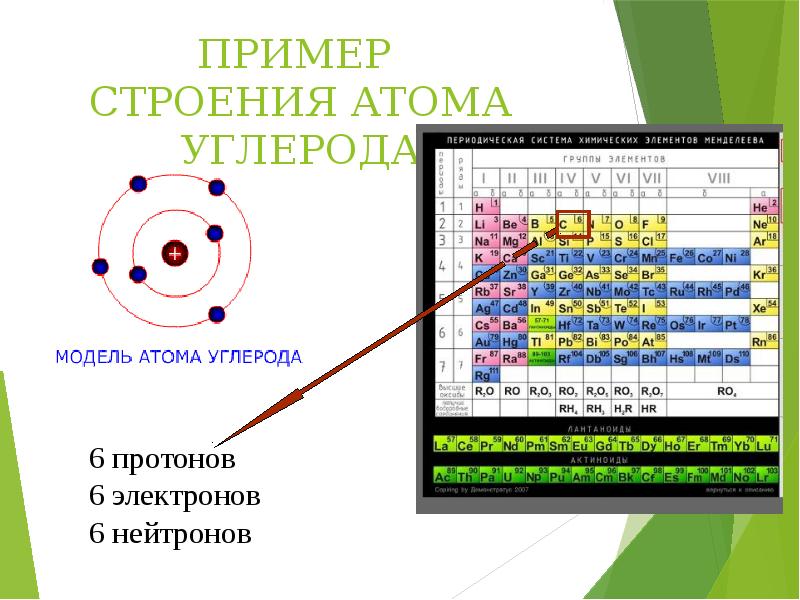
- 15. ПРИМЕР СТРОЕНИЯ АТОМА УГЛЕРОДА
- 16. Изотопы - разновидности атомов одного и того же химического элемента,
- 17. Основные выводы Атом является мельчайшей частицей вещества Вся масса атома
- 18. Выберите верные утверждения Ядро атома содержит протоны и нейтроны, суммарная масса
- 19. Тест «Строение атома» 1. Положительно заряженная частица называется
- 20. Выпишите изотопы для хлора и кислорода Смесь изотопов:
- 21. Определите состав атомных ядер у элементов с порядковым номером 16, 14,
- 22. Спасибо за внимание!
- 23. Скачать презентацию

















Слайды и текст этой презентации
Скачать презентацию на тему Строение атома. Состав атомных ядер. Изотопы можно ниже:
Похожие презентации





























