Химический состав почвы презентация
Содержание
- 2. План Химический состав почв Микроэлементы Кислотность и щелочность почв Гумус. Карбонаты.
- 3. Почва наследует химический состав коры выветривания. Однако при влиянии на кору
- 4. Поскольку основная масса почвы, за исключением гумуса и органических остатков, представлена
- 5. Кремний определяется содержанием в почве кварца, силикатов и алюмосиликатов. Присутствует
- 6. Алюминий обусловлен присутствием полевых шпатов, глинистых минералов, слюд, эпидотов, граната, корунда.
- 7. Железо присутствует в почвах как компонент магнетита, гематита, глауконита, роговых
- 8. Соединения железа в почве: 1) силикатное железо, входящее в состав кристаллических
- 9. Кальций содержание СаО в бескарбонатных суглинистых почвах составляет 1-3 %
- 10. Магний по содержанию близок к СаО. В крупных фракциях магний
- 11. Калий содержание К2О в почвах составляет 2-3 %. Он
- 12. Натрий Натрий — содержание Na2О в почвах составляет около 1-3
- 13. Титан, марганец, сера Титан, марганец и сера присутствуют в почвах в
- 14. Углерод, азот, фосфор Углерод сосредоточен в гумусе, органических остатках и карбонатах.
- 15. Микроэлементы – химические элементы, содержащиеся в породе, почве, растениях и живых
- 16. Главным источником микроэлементов являются почвообразующие породы. Главным источником микроэлементов являются почвообразующие
- 17. Для решения вопросов применения микроудобрений важны не столько валовые запасы микроэлементов,
- 18. Микроэлементы выполняют важную физиологическую и биохимическую роль в жизни растений, животных
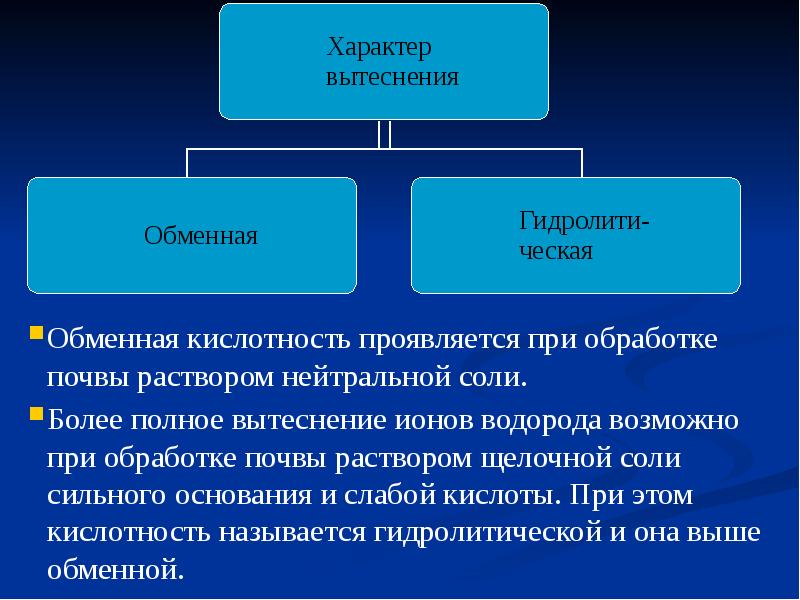
- 19. Кислотность и щелочность почв Концентрация свободных ионов Н+ выражается рН -
- 20. Попадая в почву, атмосферная влага начинает растворять минеральные и органические вещества,
- 21. Величина рН характеризует актуальную кислотность, или щелочность, почвы. Величина рН
- 23. Для сельскохозяйственных растений наиболее благоприятна слабокислая или слабощелочная реакция почвенного раствора;
- 24. Степени кислотности или щелочности почвы 3,0-4,5 - сильнокислые; 4,6-5,0 -
- 25. Гумус Гумус определяют по содержанию в нем углерода. Содержание гумуса
- 26. Карбонаты Содержание в почве углекислых солей кальция и магния (карбонатов) узнают
- 27. Водно-растворимые соли В засоленных почвах количество и состав солей варьируют в
- 28. Радиоактивность почв Радиоактивность почв или ионизирующее излучение почв – обусловлена содержанием
- 29. Естественная радиоактивность вызывается ураном, радием, торием, актинием, радоном; изотопами химических элементов,
- 30. Искусственная радиоактивность Искусственная радиоактивность появилась в окружающей среде в результате загрязнения,
- 31. Наиболее опасными в биологическом отношении представляются изотопы стронция и цезия, так
- 32. Химические элементы почвы
- 33. Домашнее задание Конспект или «География почв с основами почвоведения» Белобродов,
- 34. Скачать презентацию































Слайды и текст этой презентации
Похожие презентации





























