Этилен презентация
Содержание
- 2. Содержание презентации 1 Классификация углеводородов Этилен - непредельный углеводород Валентные
- 3. Содержание презентации 2 Химические свойства этилена О реакциях присоединения Уравнения
- 4. Содержание презентации 3 Получение этилена в промышленности Завод по производству этилена
- 5. Содержание презентации 4 Выдув полиэтиленовой пленки (фото) Производство ПЭ – труб
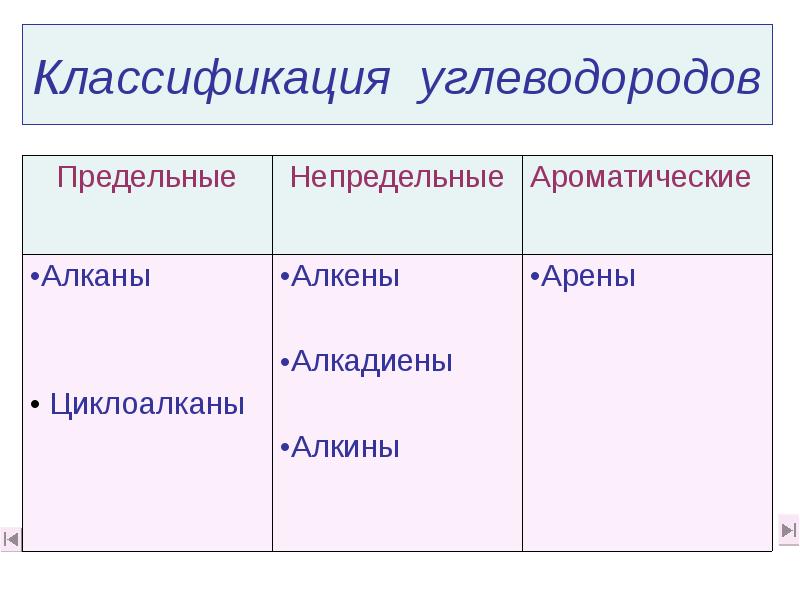
- 6. Классификация углеводородов
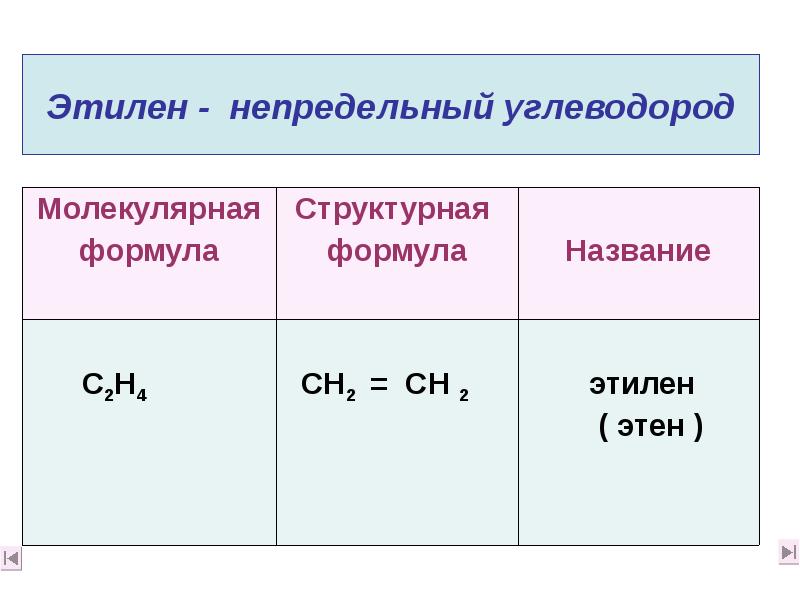
- 7. Этилен - непредельный углеводород
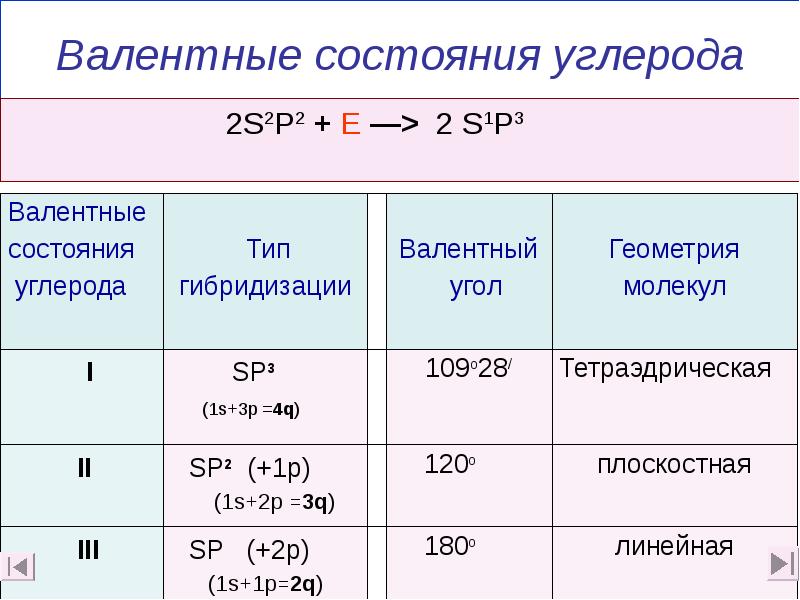
- 8. Валентные состояния углерода
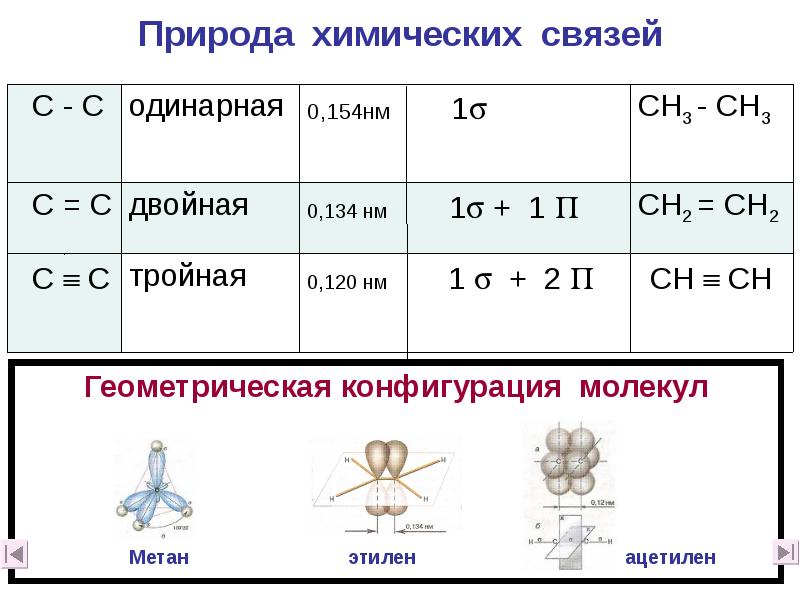
- 9. Природа химических связей
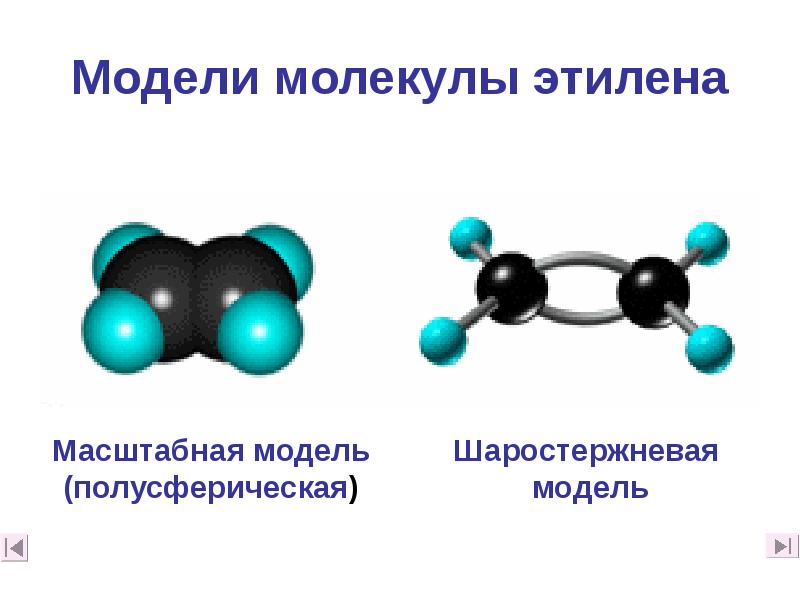
- 10. Модели молекулы этилена
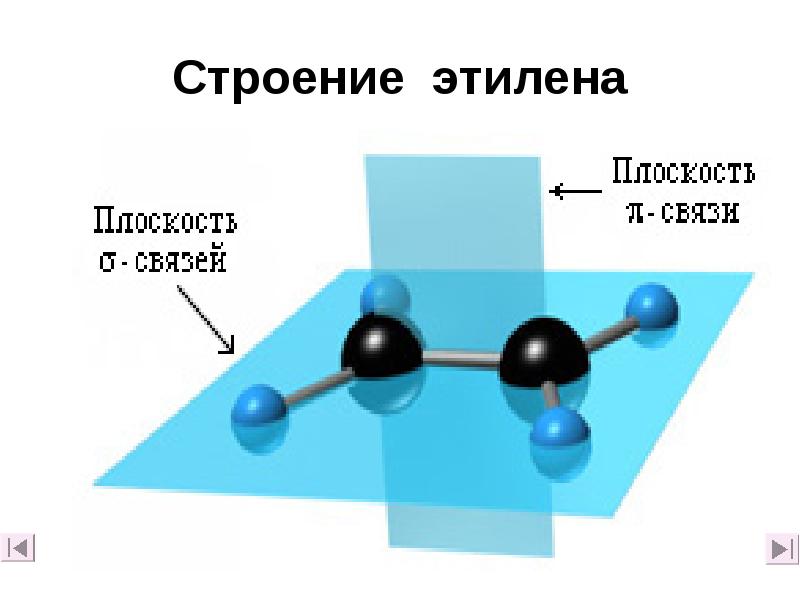
- 11. Строение этилена
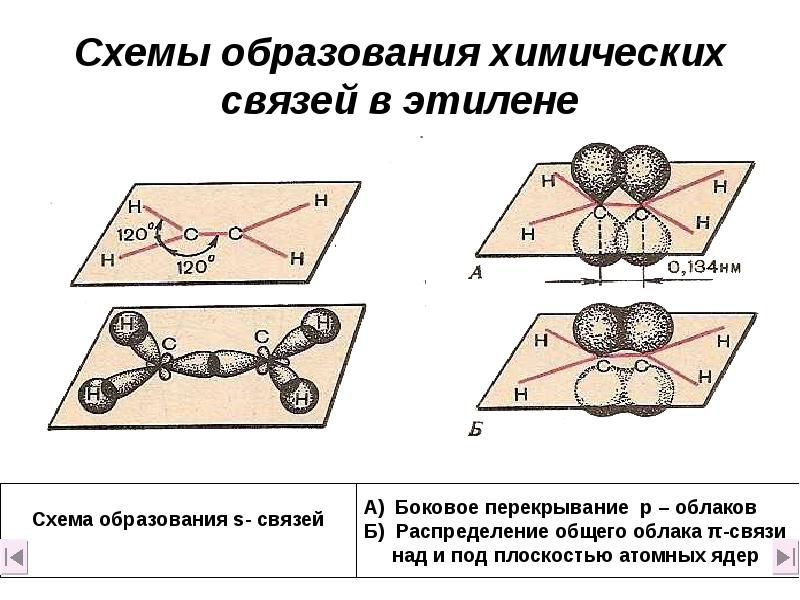
- 12. Схемы образования химических связей в этилене
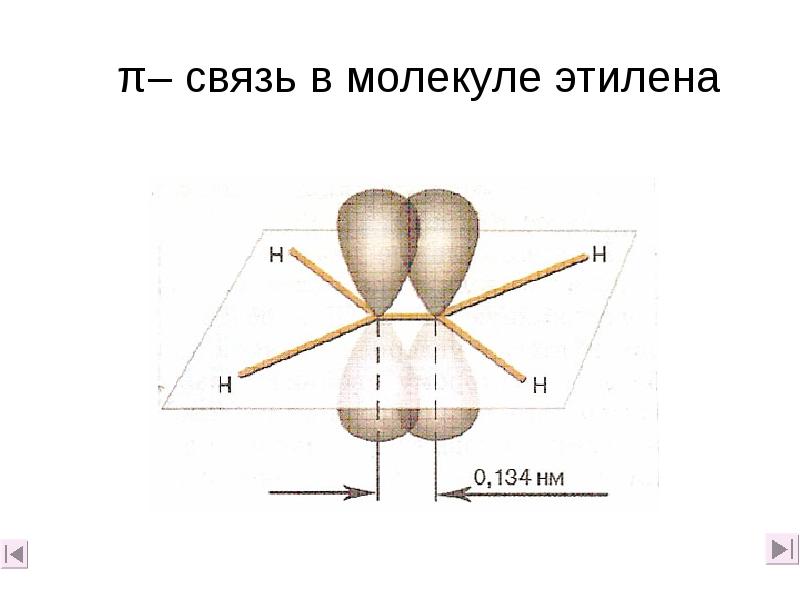
- 13. π– связь в молекуле этилена
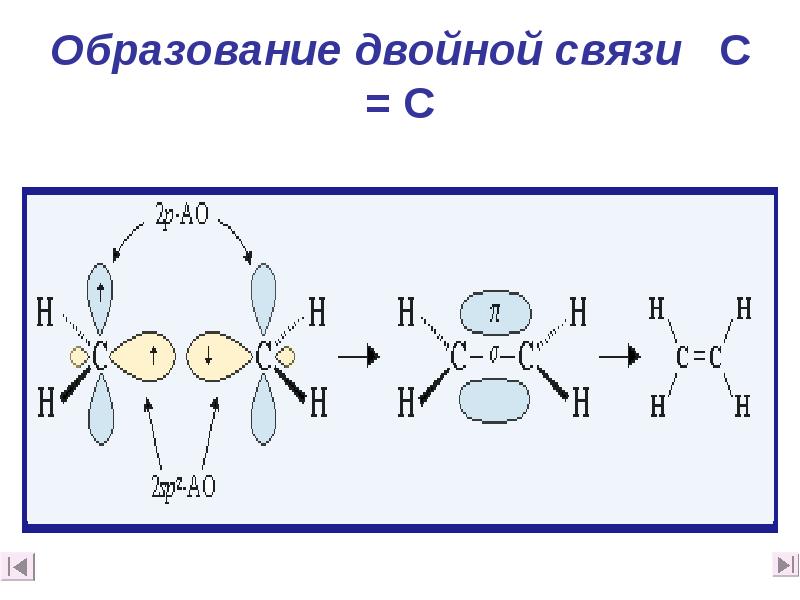
- 14. Образование двойной связи C = C
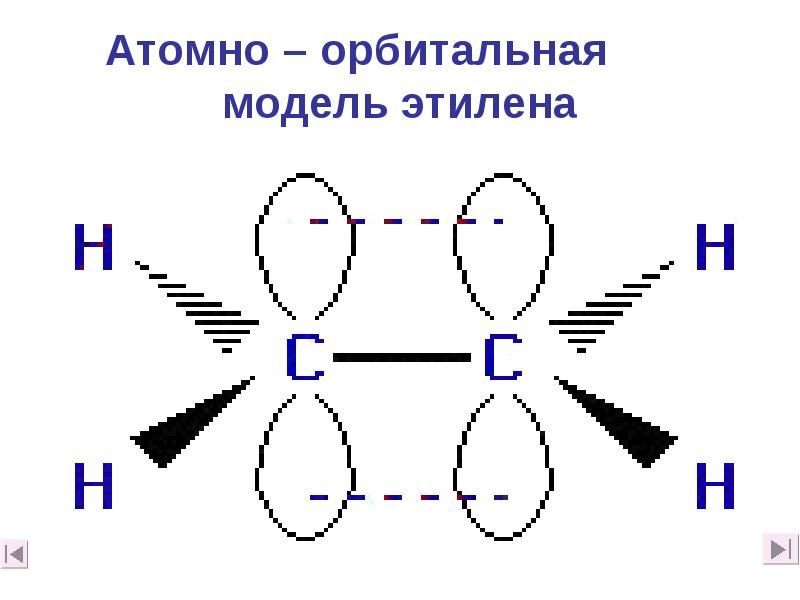
- 15. Атомно – орбитальная модель этилена
- 16. Строение двойной связи С = С Двойная связь является сочетанием σ-
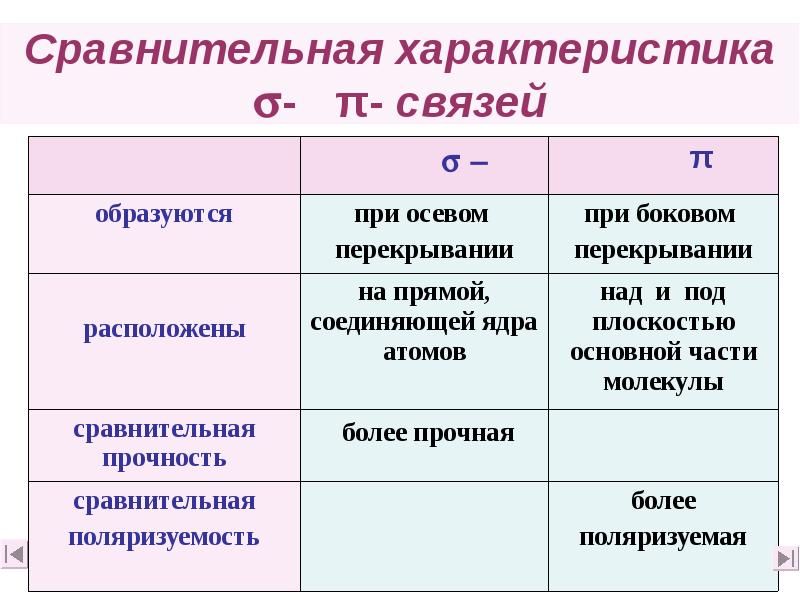
- 17. Сравнительная характеристика - π- связей
- 18. Описание электронного строения молекулы этилена Валентное состояние углерода – II
- 19. Физические свойства газ ( при
- 20. Знаете ли вы, что… этилен содержится в коксовом газе (3 –
- 22. Химические свойства этилена
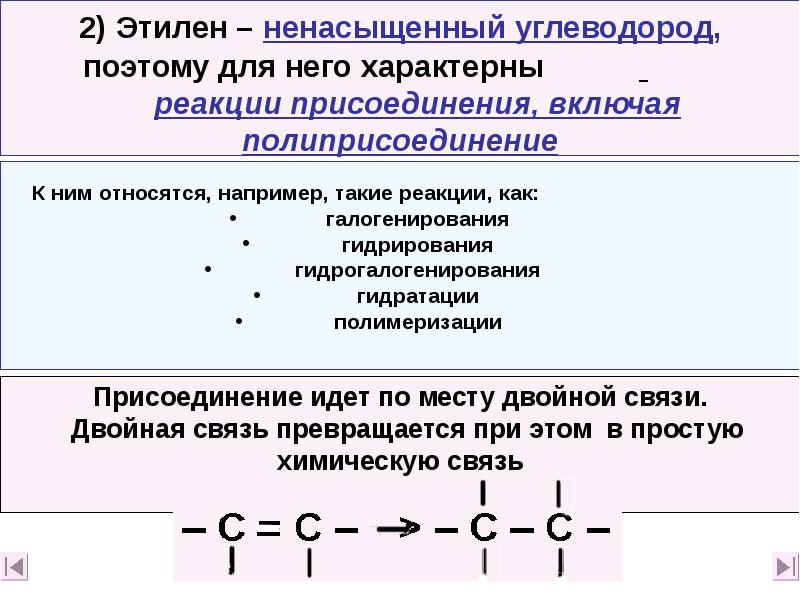
- 23. 2) Этилен – ненасыщенный углеводород, поэтому для него характерны
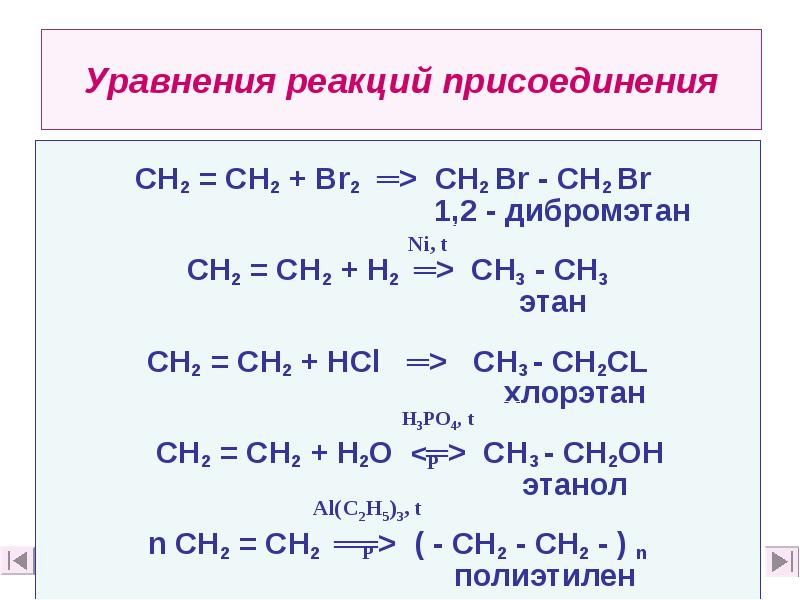
- 24. Уравнения реакций присоединения СН2 = СН2 + Вr2 ═> СН2
- 25. Ионный механизм реакции галогенирования этилена СН2 = СН2 +
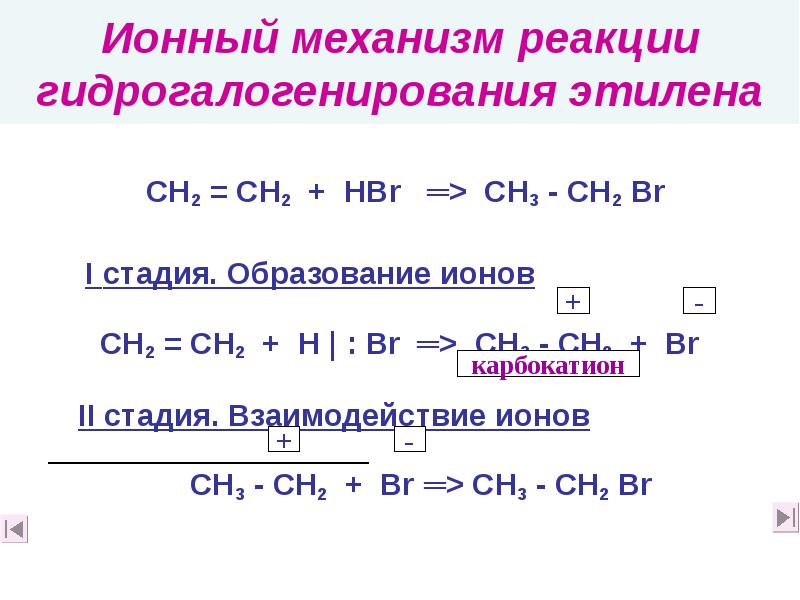
- 26. Ионный механизм реакции гидрогалогенирования этилена СН2
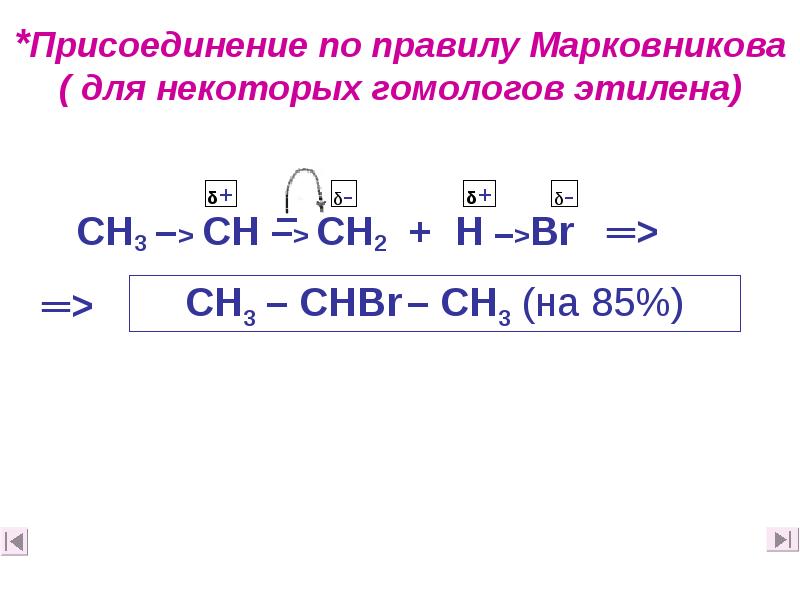
- 27. *Присоединение по правилу Марковникова ( для некоторых гомологов этилена)
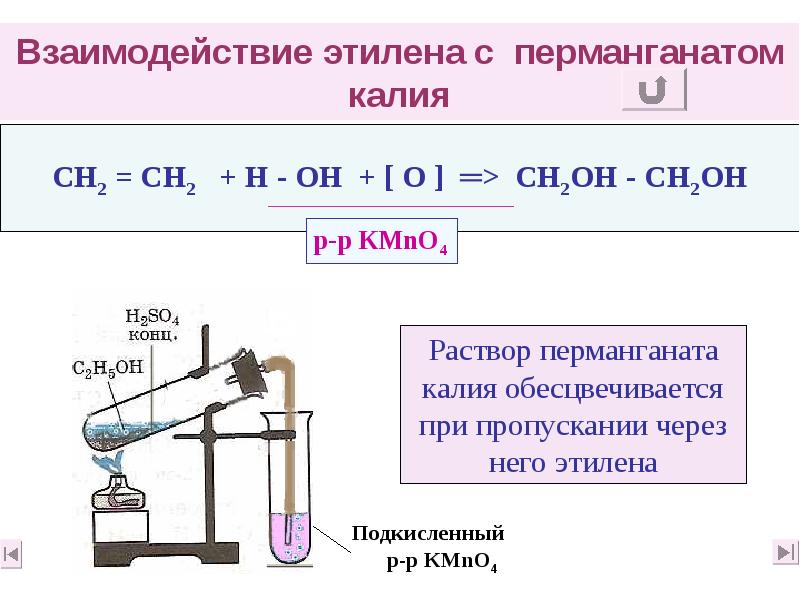
- 28. 3) Реакции частичного окисления А. раствором КМnО4 CН2 =
- 29. Качественные реакции на π - связь Непредельность характера углеводорода
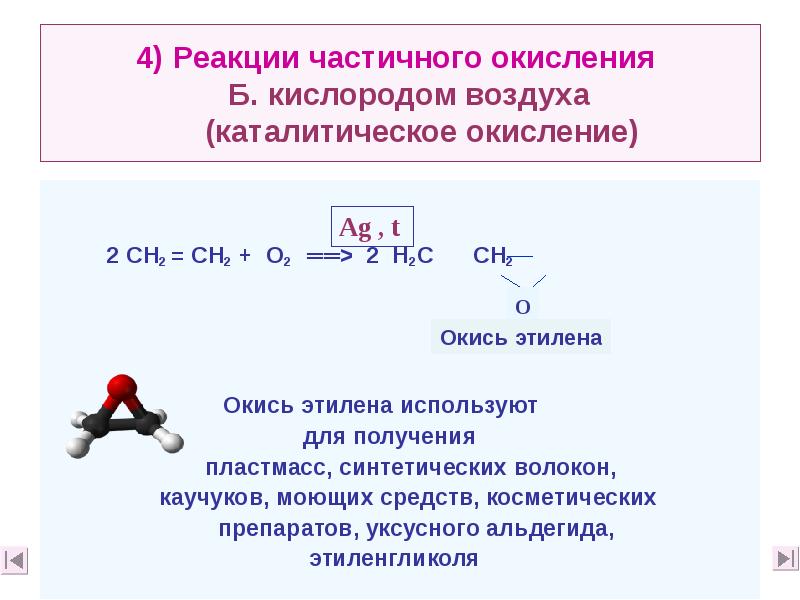
- 30. 4) Реакции частичного окисления Б. кислородом воздуха (каталитическое окисление)
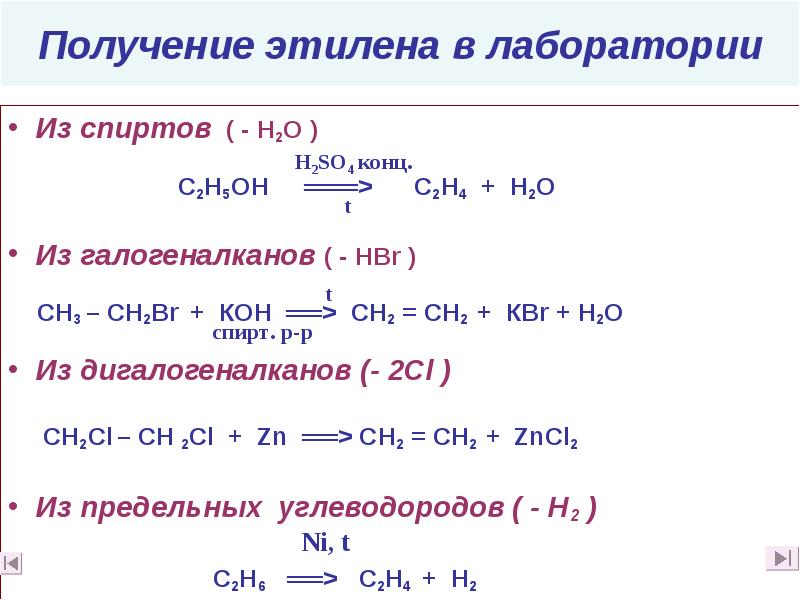
- 31. Получение этилена в лаборатории Из спиртов ( - Н2О )
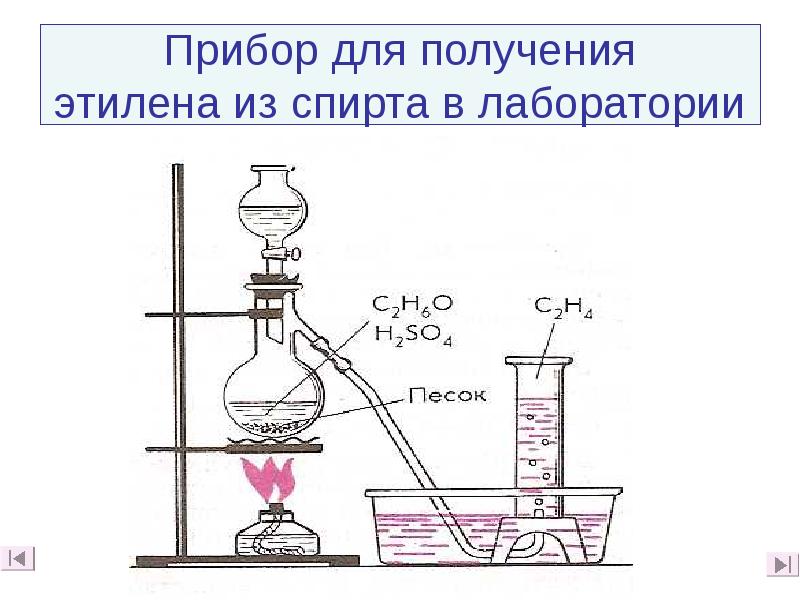
- 32. Прибор для получения этилена из спирта в лаборатории
- 33. Практическая работа «Получение этилена и опыты с ним»
- 34. Оформление практической работы Нарисуйте прибор для получения этилена. Сделайте поясняющие надписи
- 35. Техника безопасности при проведении практической работы Практическую работу выполняйте в
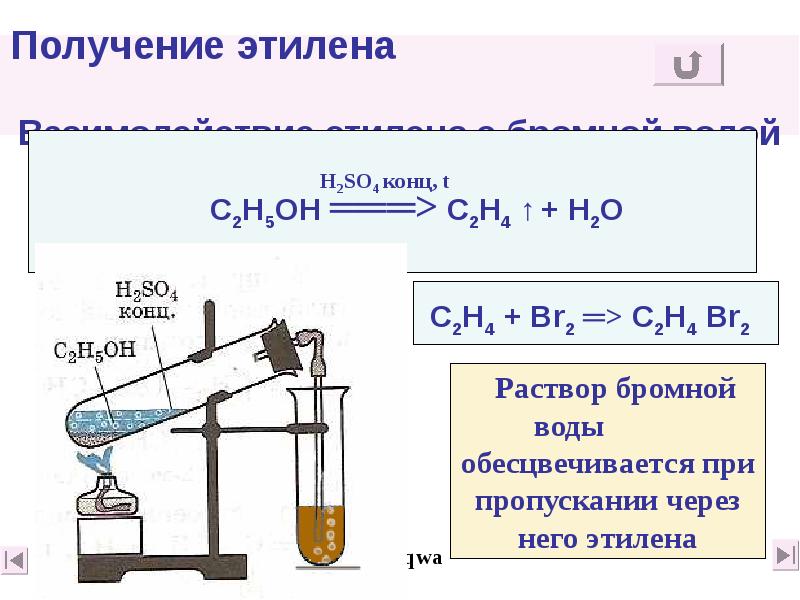
- 36. Получение этилена
- 37. Взаимодействие этилена с перманганатом калия
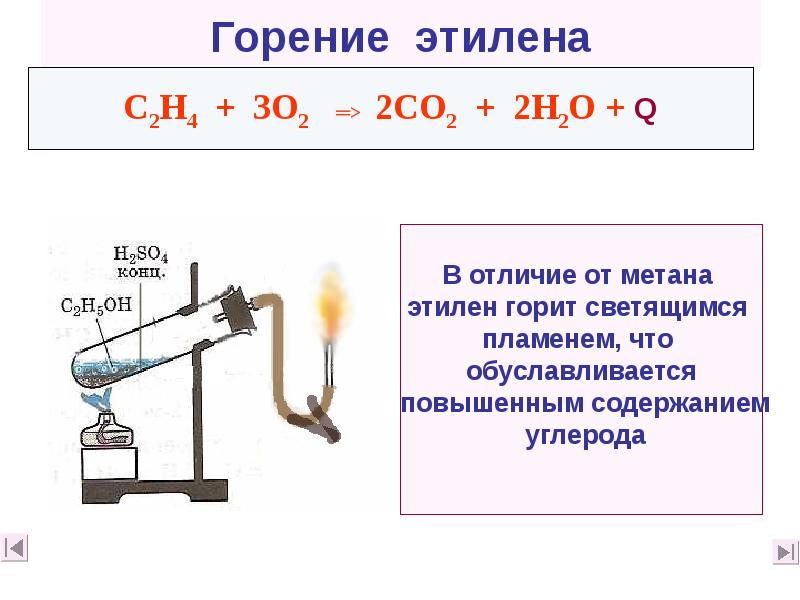
- 38. Горение этилена
- 39. В России производится порядка
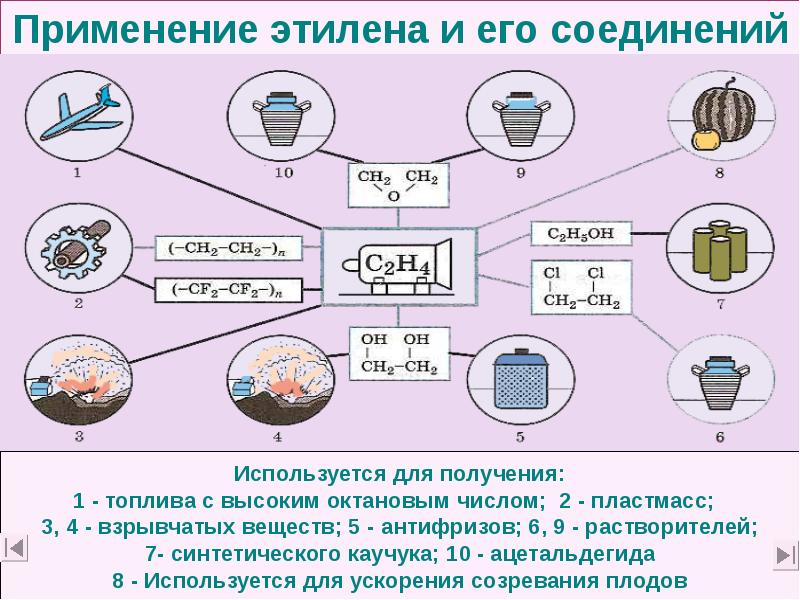
- 40. Промышленные синтезы на основе этилена Из этилена в промышленности получают:
- 41. Получение этилена в промышленности
- 42. Завод по производству этилена мощностью 300 тыс. т/год
- 43. Комплекс производства этилена и его производных на базе углеводородного сырья
- 44. Установка производства этилена ОАО "Нижнекамскнефтехим"
- 45. Установка производства этилена и полиэтилена ООО “Ново – Уренгойский” ГХК
- 46. Завод по производству этилена
- 47. Сферические газгольдеры - наземное газовое хранилище
- 48. Применение этилена и его соединений
- 50. В настоящее время полиэтилен – один из самых распространенных синтетических полимеров.
- 51. Продукт полимеризации этилена- твердое, белое вещество – полиэтилен
- 53. Производство ПЭ - труб
- 54. ПЭ - трубы для подземных систем водоотведения
- 55. ПЭ – трубы под землей
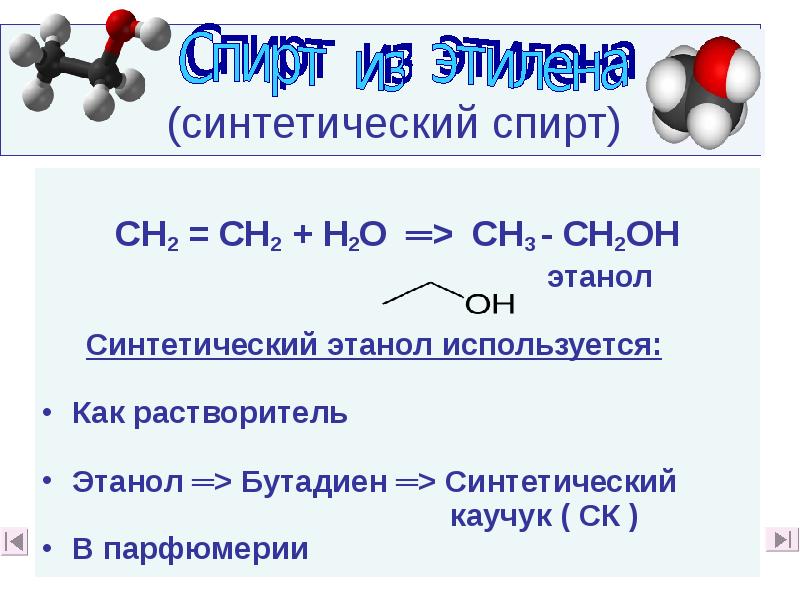
- 57. (синтетический спирт) СН2 = СН2 + Н2О ═> СН3 -
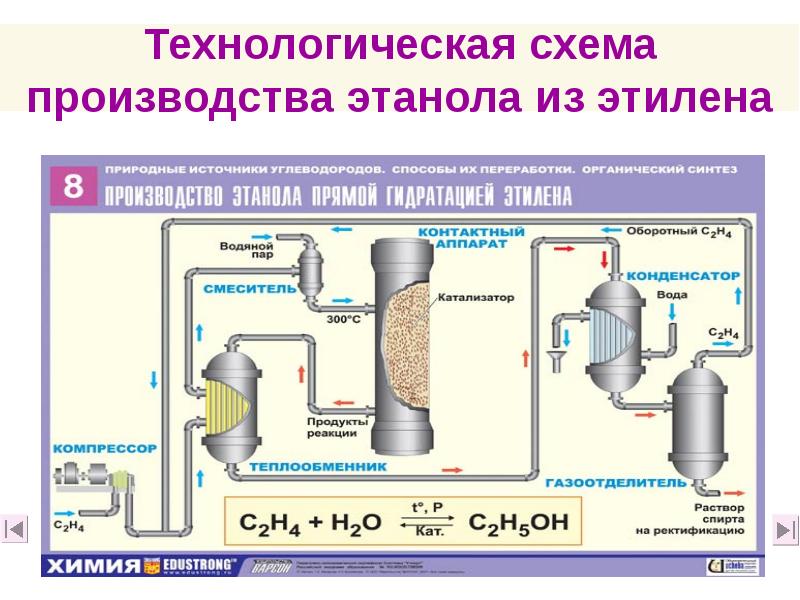
- 58. Технологическая схема производства этанола из этилена
- 59. Цех по гидратации этилена
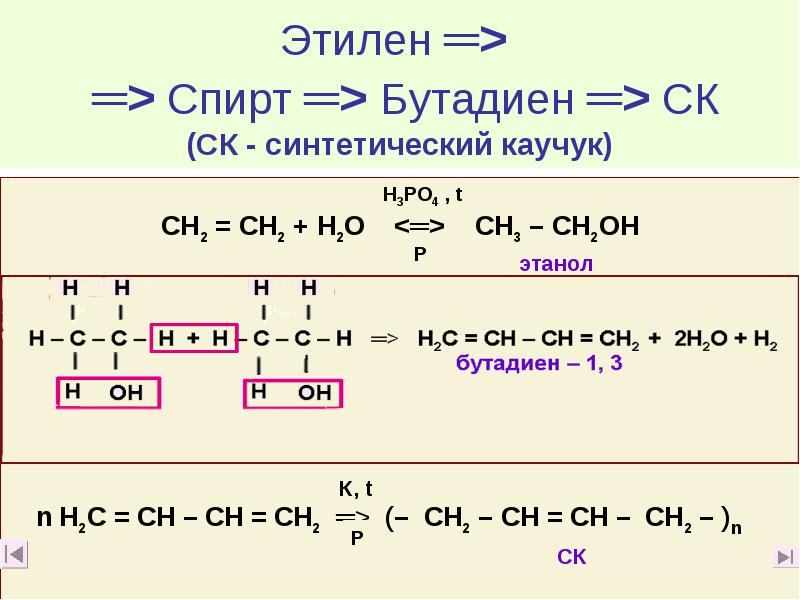
- 60. Этилен ═> ═> Спирт ═> Бутадиен ═> СК (СК -
- 61. Сумгаитский завод синтетического каучука
- 62. Новочеркасский завод синтетических продуктов
- 63. Бутадиеновые каучуки и изделия из них
- 64. Синтетический каучук, называемый резиной
- 65. Антифриз (от греч. ἀντι- — против и англ. freeze — замерзать) — общее название для
- 66. Завод по производству окиси этилена
- 67. Окись этилена ══> этиленгликоль В промышленности этиленгликоль получают некаталитической гидратацией окиси
- 69. Приложение «Вопросник» 1. Какова молекулярная формула этилена? К какой группе углеводородов
- 70. Автор работы Беляева Галина Брониславовна учитель химии ГОУ СОШ №1212
- 71. Скачать презентацию












































Слайды и текст этой презентации
Похожие презентации