Отраслевые стандарты качества лекарственных средств: GMP, GLP, GSP, GDP, GPP, GCP и другие презентация
Содержание
- 2. Качество — это совокупность свойств лекарственного препарата, касающихся его способности удовлетворять
- 3. Требования к качеству лекарств (ВОЗ) эффективность и безопасность применения лекарств; соответствие
- 4. Государственный контроль качества лекарств — это совокупность организационных и правовых
- 5. Государственная фармакопея Украины это правовой акт, содержащий общие требования к
- 6. ГФУ состоит из двух частей: европейская - идентичная Европейской Фармакопее национальная
- 7. В ГФУ включены следующие разделы: Физические и физико-химические методы анализа (30
- 8. Физические и физико-химические методы анализа 2.2.1 Определение прозрачности и степени
- 9. Физические и физико-химические методы анализа 2.2.9. Метод капиллярной вискозиметрии 2.2.10.
- 10. Физические и физико-химические методы анализа 2.2.19. Амперометрическое титрование 2.2.20. Потенциометрическое
- 11. Физические и физико-химические методы анализа 2.2.27. Тонкослойная хроматография 2.2.28. Газовая
- 12. Идентификация 2.3.1 Реакции идентификации на ионы и функциональные группы 2.3.2. Идентификация
- 13. Методы количественного испытания 2.6.1. Кислотное число 2.6.2. Эфирное число 2.6.3. Гидроксильное
- 14. Биологические испытания 2.6.1. Стерильность 2.6.8. Пирогены 2.6.9. Аномальная токсичность 2.6.11. Депрессорные
- 15. Биологические методы количественного определения 2.6.1. Количественное определение антибиотиков микробиологическим методом
- 16. Общие тексты 5.1.1. Методы приготовления стерильных продуктов 5.1.2. Биологические индикаторы стерилизации 5.1.3. Эффективность
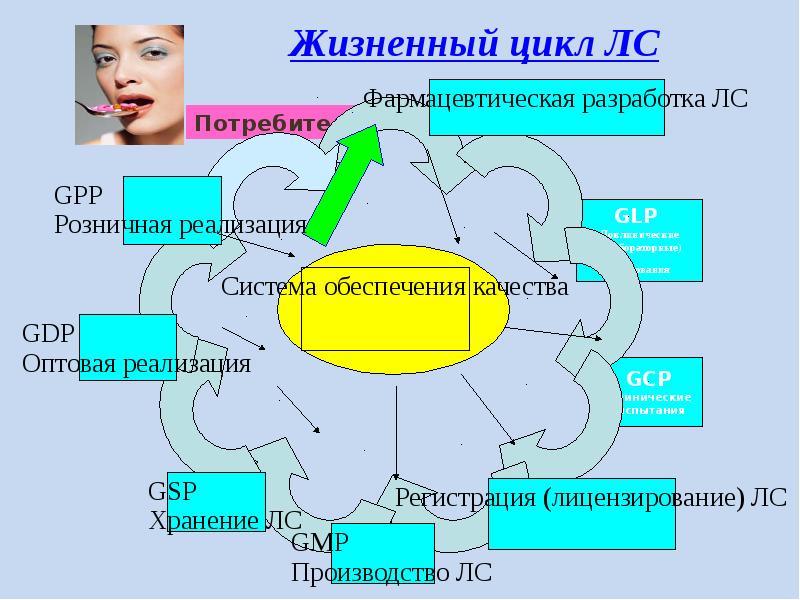
- 18. Жизненный цикл ЛС
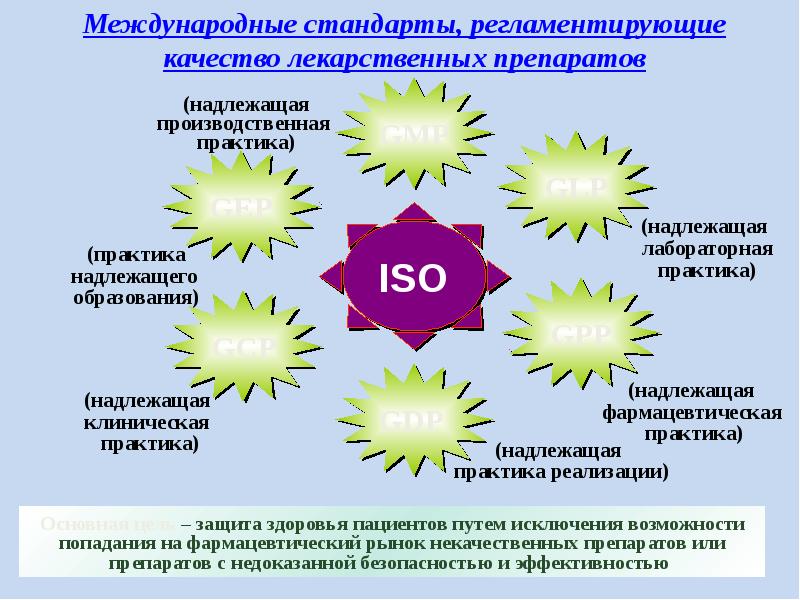
- 19. GLP Good Laboratory Practice комплекс правил по
- 20. GCP Good Clinical Practice совокупность правил по планированию, выполнению, оценке и
- 21. GMP Good Manufacturing Practice Комплекс правил по организации производства и контроля
- 22. GDP Good Distribution Practice комплекс правил и требований к дистрибуции, соблюдение
- 23. GPCL – Good Practices for National Pharmaceutical Control Laboratories Надлежащая практика
- 24. GSP Good Storage Practice for harmaceuticals Надлежащая практика хранения фармацевтической продукции
- 25. Концепция GMP ограниченные возможности контроля качества ЛС после его получения в
- 26. GMP (ВОЗ) часть [концепции] обеспечения качества, гарантирующая последовательную выработку
- 27. Показатели GMP здания и помещения, персонал, оборудование, организация и
- 28. Требования GMP обеспечение наличия всех средств для внедрения GMP, включая:
- 29. Требования GMP инструкции и методики должны быть ясно изложены в форме
- 30. Требования GMP при распространении продукции риск снижения ее качества должен быть
- 31. Благодарю за внимание !
- 32. Скачать презентацию























![GMP (ВОЗ)
часть [концепции] обеспечения качества, гарантирующая последовательную GMP (ВОЗ)
часть [концепции] обеспечения качества, гарантирующая последовательную](/documents_3/5e12954076f5652cb41cc38b95f29192/img25.jpg)





Слайды и текст этой презентации
Скачать презентацию на тему Отраслевые стандарты качества лекарственных средств: GMP, GLP, GSP, GDP, GPP, GCP и другие можно ниже:
Похожие презентации