Карбонаты
Содержание
- 2. Тест – экспресс 1) Электронная конфигурация атома углерода? 2) Разновидности
- 3. ОТВЕТЫ 1) Аллотропные видоизменения 2) 1s22s22p 3) Четыре 4) Метан СН4,
- 4. Фокус-покус для народа: Стоит лишь подуть сквозь воду, Как она
- 5. Действие сильной кислоты может служить качественной реакцией на карбонаты: СаСО3
- 6. Как можно собрать СО2 М(воздуха)=29, т.е. СО2 тяжелее воздуха Метод
- 7. Угольная кислота диссоциирует ступенчато: 1.H2CO3 ↔ Н+ + HCO3- 2.
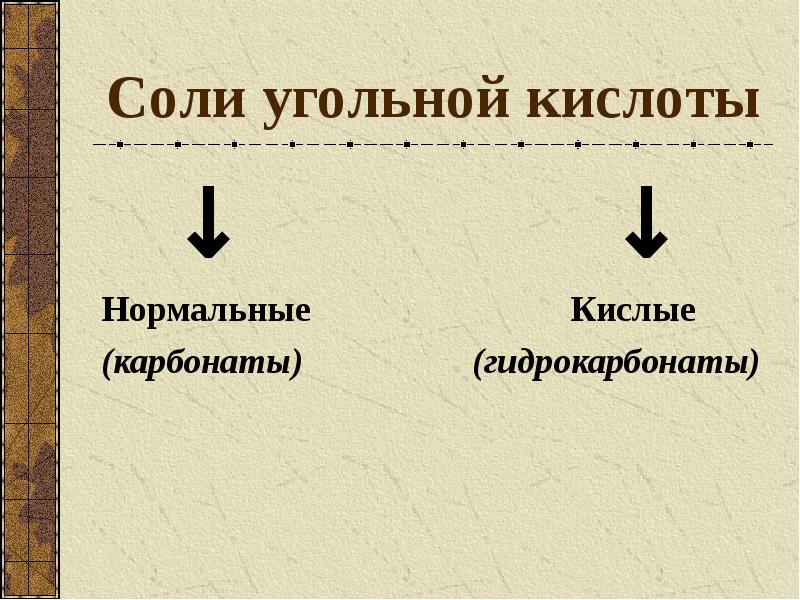
- 8. Соли угольной кислоты ↓ ↓ Нормальные
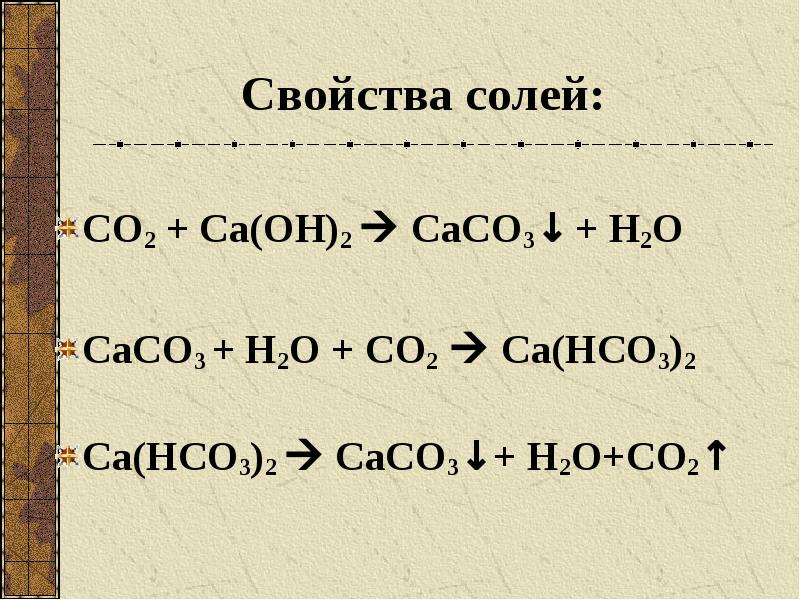
- 9. Свойства солей: СО2 + Са(ОН)2 СаСО3↓ + Н2О
- 10. Пещера красная Пещера красная
- 11. Сталагмиты
- 12. Сталактит «Пузатый»
- 13. Сталактит «Огненный»
- 17. Изучением карстовых пещер занимается наука – спелеология
- 18. Соли угольной кислоты:
- 19. Доломит CaCO3. MgCO3 – обычно содержит глины и известняки, применяется для
- 20. Сидерит FeCO3 – минерал бурого цвета, служит рудой для получения железа.
- 21. Презентация разработки темы в курсе 9 класса. Подготовила учитель
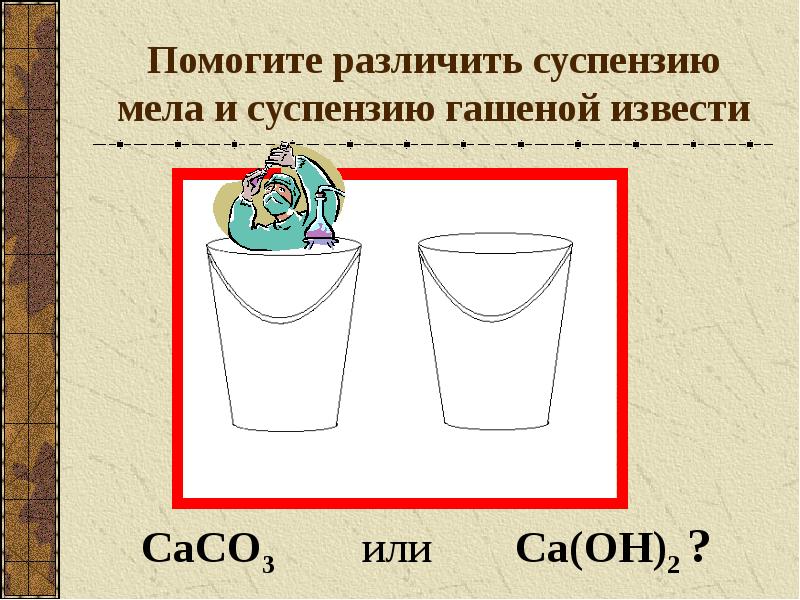
- 22. Помогите различить суспензию мела и суспензию гашеной извести
- 23. Скачать презентацию


















Слайды и текст этой презентации
Похожие презентации





























