Железо и его соединения (9 класс)
Содержание
- 2. Загадка Загадка Очень древний я металл, Счёт столетьям потерял. Был нескромным
- 3. «Третий лишний». Задание: Решите анаграммы и исключите лишнее. леруогд
- 4. Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями:
- 5. Задание Закончите электронно - буквенную формулу и нарисуйте графическую формулу строения
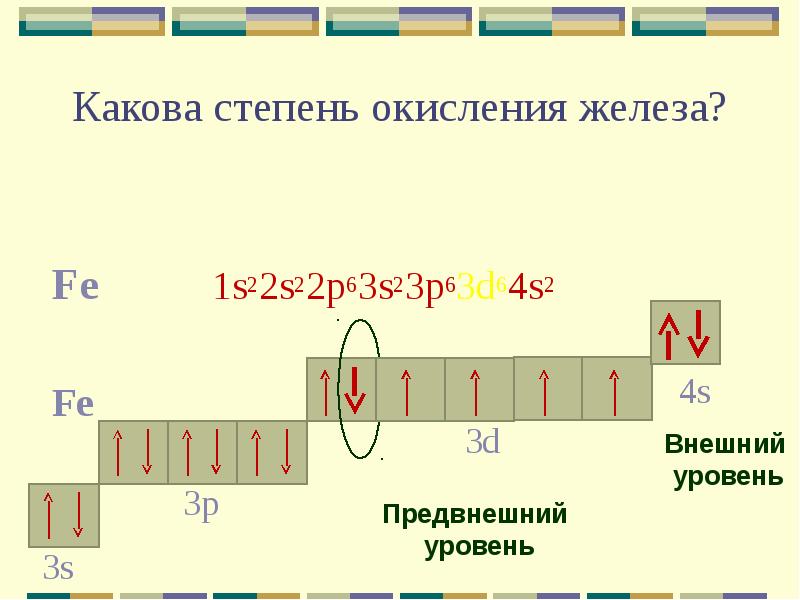
- 6. Какова степень окисления железа? Fe 1s22s22p63s23p63d64s2 Fe
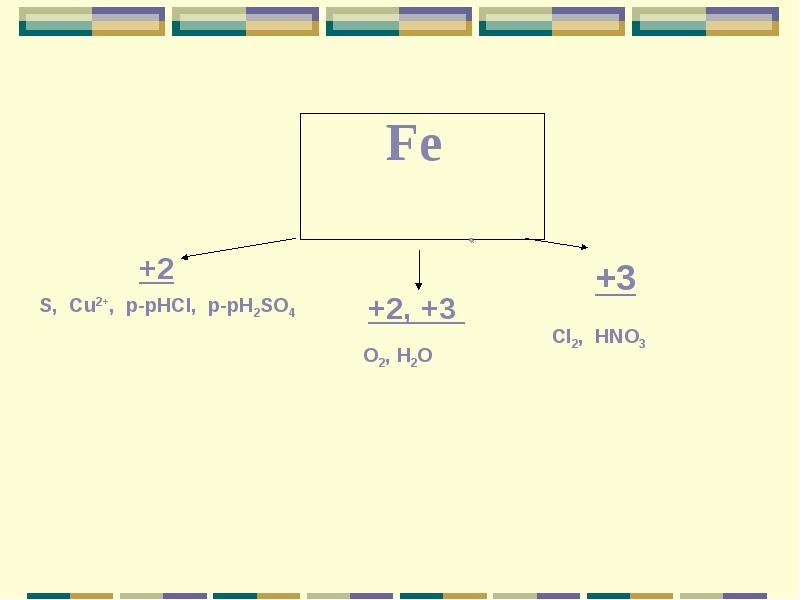
- 7. Для железа характерны две основные степени окисления: +2, +3. Fe0
- 8. Задание: Рассмотрите образец металла (№ 131836). Опишите физические свойства металла (№
- 9. Выберите и запишите цифры только тех свойств, которые не относятся к
- 13. : Какие из реакций соответствуют схеме Fe+2 Fe+3 FeCI2 +
- 14. Задание: Расставить коэффициенты в уравнениях 1 и 3 методом электронного баланса,
- 15. Нахождение в природе В земной коре 5,1% железа, 4 место
- 19. ПРИМЕНЕНИЕ(№ 207382)
- 20. Домашнее задание § 14, с. 76 -78 № 5 с.
- 21. Используемая литература: 1. Горковенко М. Ю. Химия. 9 класс. Поурочные
- 22. Видеофрагменты: Видеофрагменты: железа с хлором Видеофрагмент (№ 54490)). свойства железа(N 131824)
- 23. Скачать презентацию



















Слайды и текст этой презентации
Презентация на тему Железо и его соединения (9 класс) доступна для скачивания ниже:
Похожие презентации





























