Производство серной кислоты
Содержание
- 2. Серная кислота H2SO4 cуществует в природе как самостоятельное химическое соединение, представляет
- 3. История развития производства VIII век – арабский алхимик Аджабир ибн
- 4. Исходное сырье Сырьё – исходный материал для производства промышленных продуктов. В
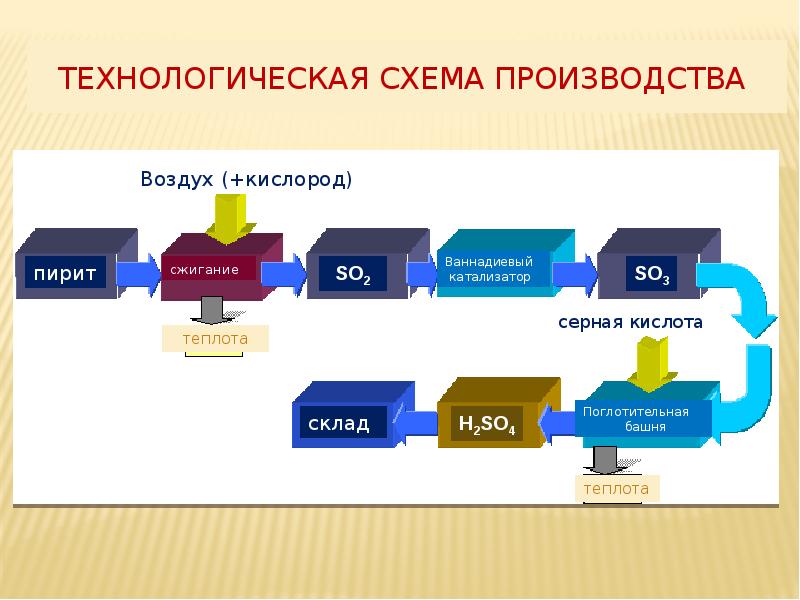
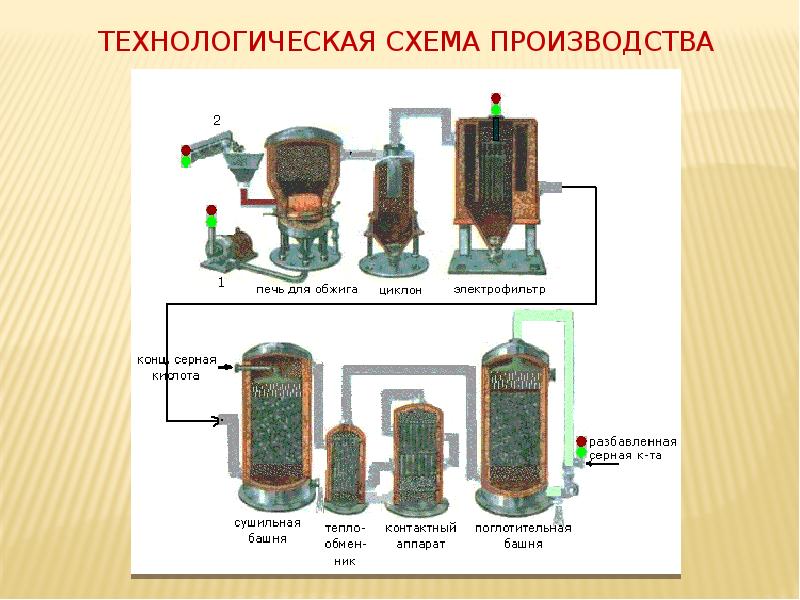
- 5. Технологическая схема производства
- 6. Технология – наука о наиболее экологичных способах и процессах получения сырья,
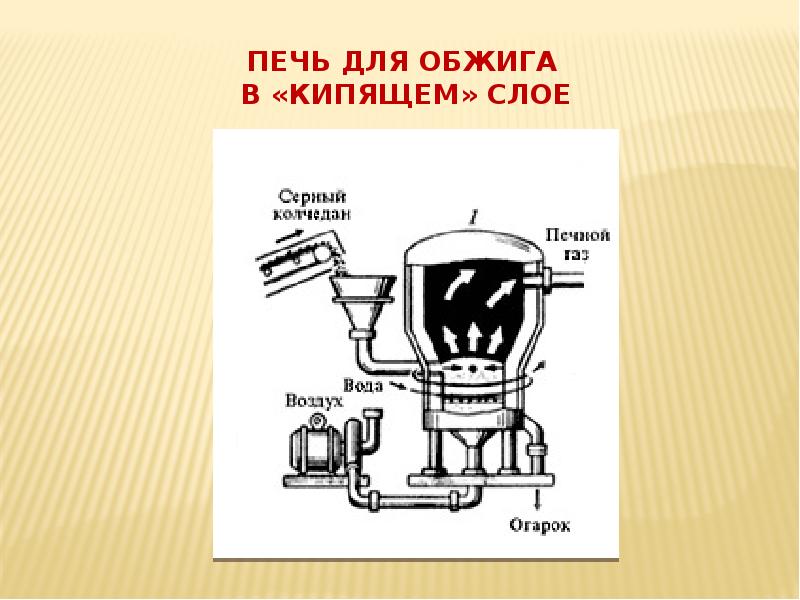
- 7. Печь для обжига в «кипящем» слое
- 8. Оптимальные условия I стадии Воздух, обогащенный кислородом. t=8000 , теплота
- 9. Принципы производства I стадии (печь для обжига с «кипящим» слоем) 1.
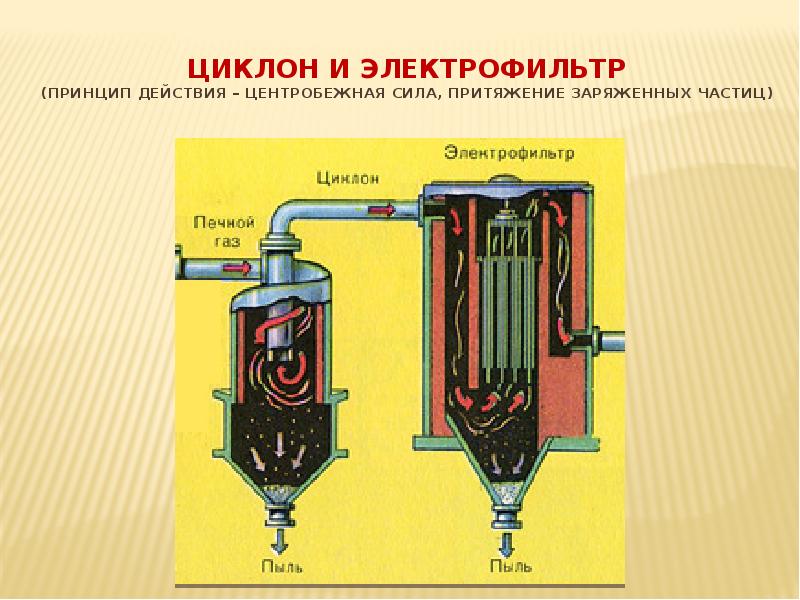
- 10. Подготовка сырья для II стадии (циклон, электрофильтр, сушильная башня)
- 11. Циклон и электрофильтр (принцип действия – центробежная сила, притяжение заряженных частиц)
- 12. Сушильная башня (принцип действия – поглощение воды концентрированной серной кислотой)
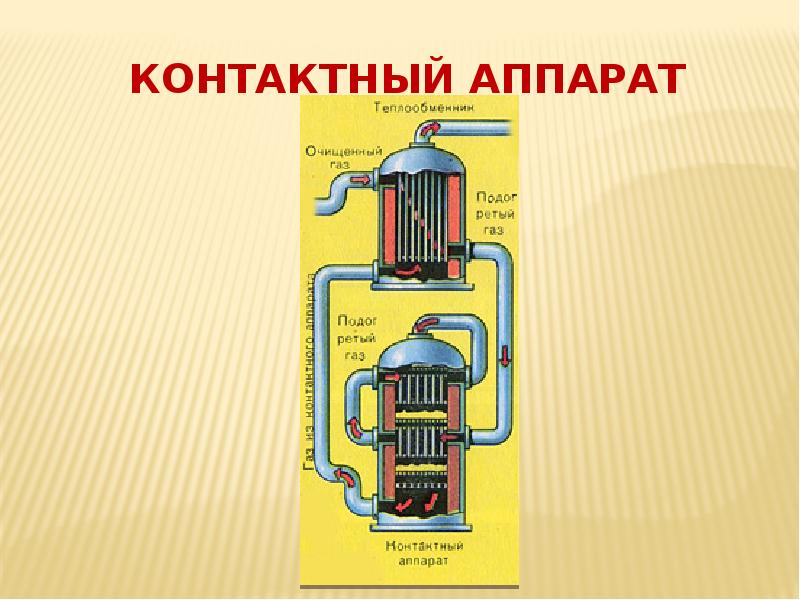
- 13. Принципы II стадии (контактный аппарат) 2 SO2 + O2 ↔
- 14. Контактный аппарат
- 15. III Стадия (поглотительная башня) SO3+H2O=H2SO4+Q (до 3000C) Увеличивают площадь соприкосновения (керамические
- 16. Поглотительная башня
- 17. Технологическая схема производства
- 18. Транспортировка и хранение серной кислоты Транспортируют в железнодорожных и автоцистернах из
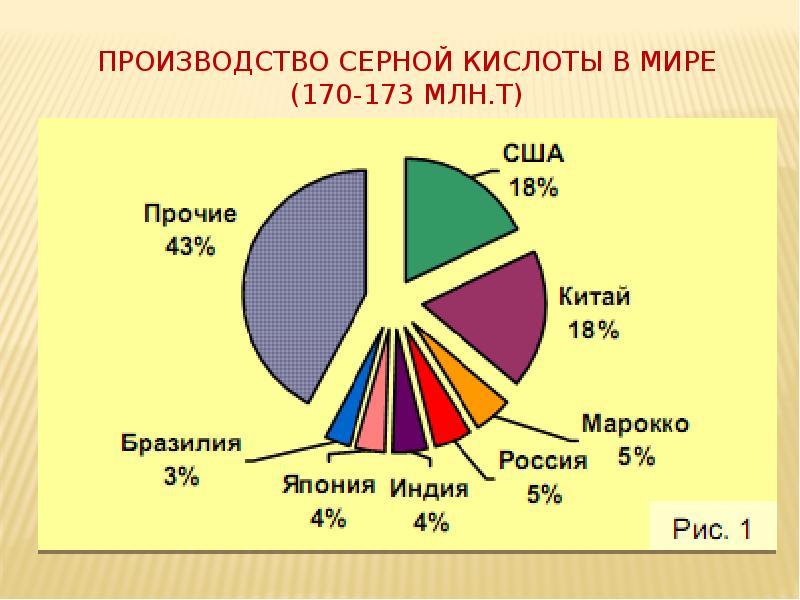
- 19. ПРОизводство серной кислоты в мире (170-173 млн.т)
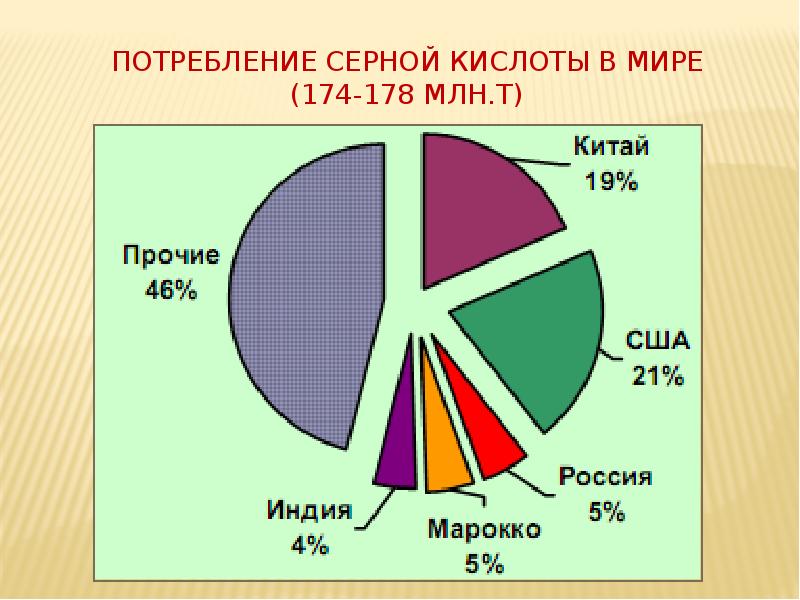
- 20. Потребление серной кислоты в мире (174-178 млн.т)
- 21. потребление серной кислоты 1. Производство минеральных удобрений. 2. Производство сульфатов (солей
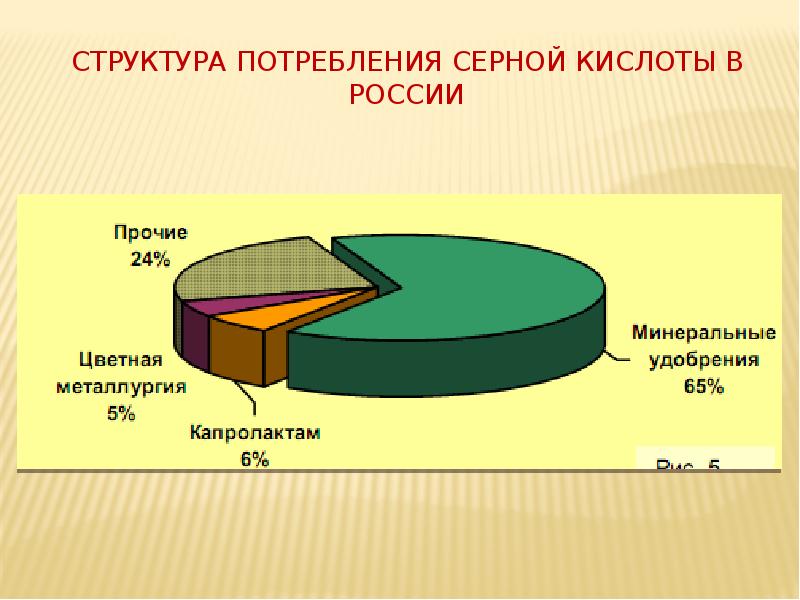
- 22. Структура потребления серной кислоты в России
- 23. Экологический ущерб производства При аварийных выбросах в атмосферу попадают соединения серы:
- 24. Скачать презентацию















Слайды и текст этой презентации
Презентация на тему Производство серной кислоты доступна для скачивания ниже:
Похожие презентации





























