Общая характеристика металлов главных подгрупп I-III
Содержание
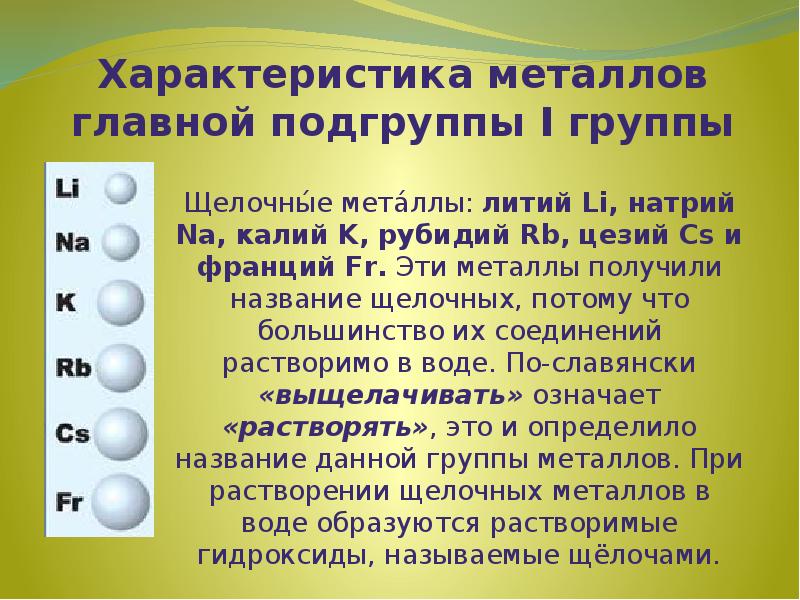
- 2. Характеристика металлов главной подгруппы I группы Щелочны́е мета́ллы: литий Li, натрий
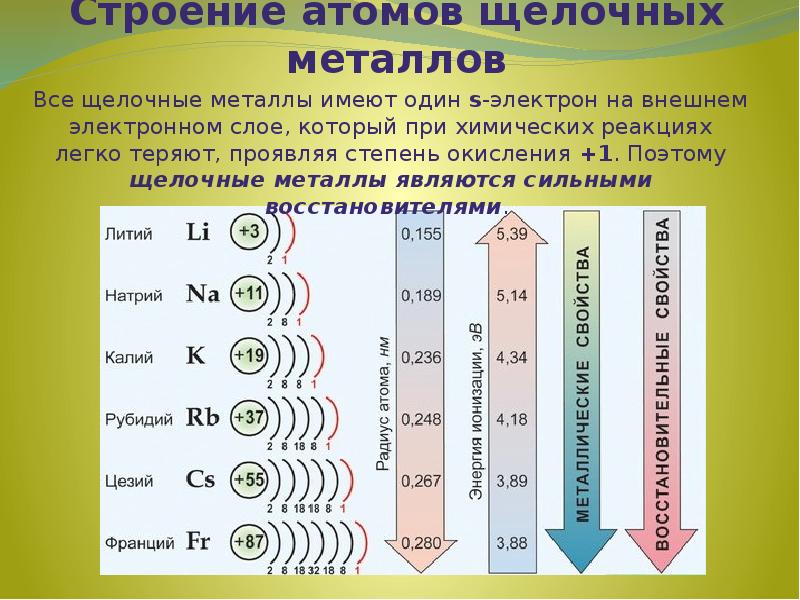
- 3. Строение атомов щелочных металлов
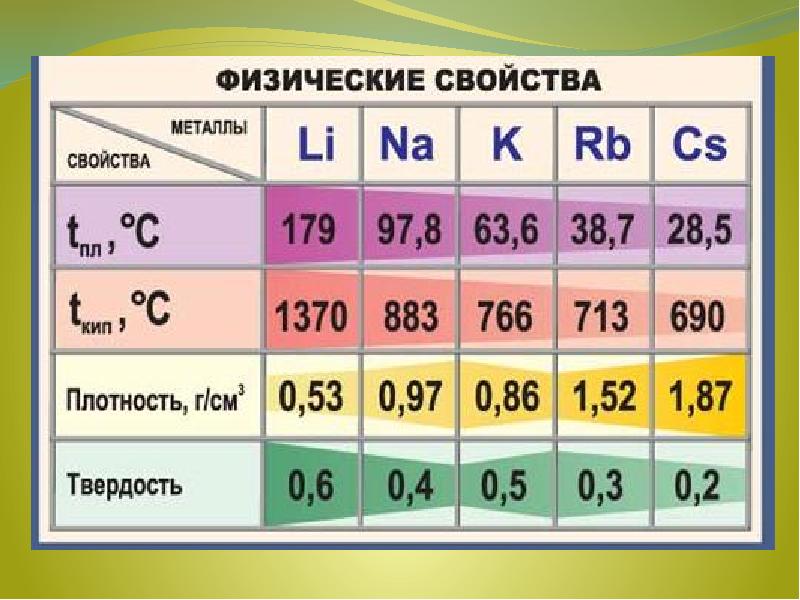
- 4. Физические свойства Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого
- 6. Получение щелочных металлов 1. Для получения щелочных металлов используют в основном
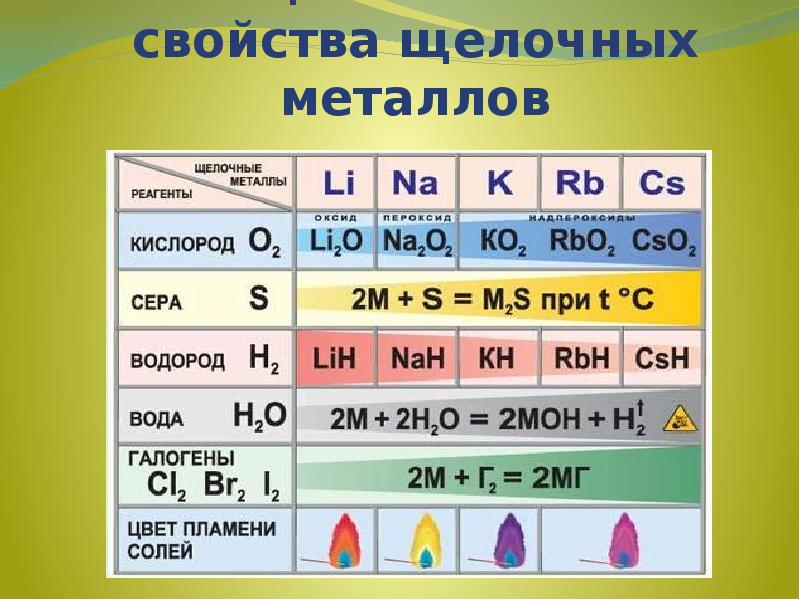
- 7. Химические свойства Реакции с неметаллами (образуются бинарные соединения): 4Li
- 8. Активно взаимодействуют с водой:
- 9. Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие
- 10. Обобщим химические свойства щелочных металлов
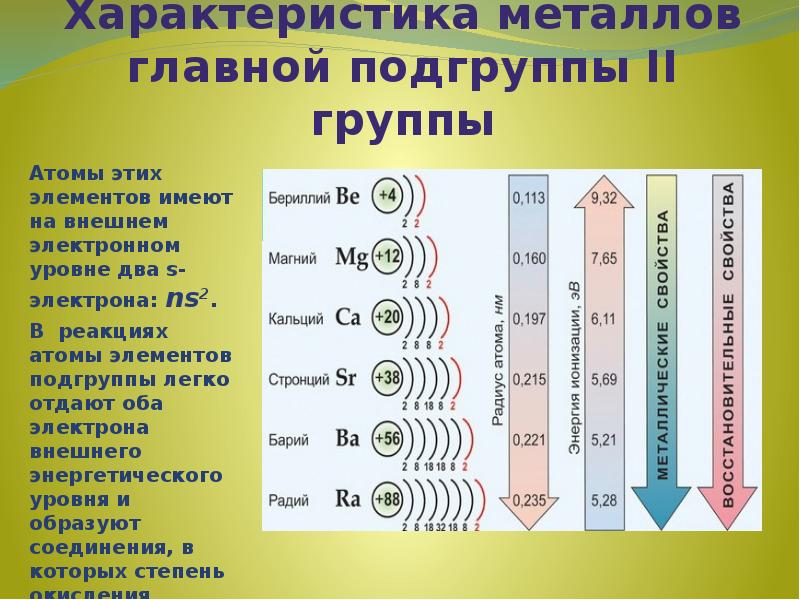
- 11. Характеристика металлов главной подгруппы II группы Атомы этих элементов имеют на
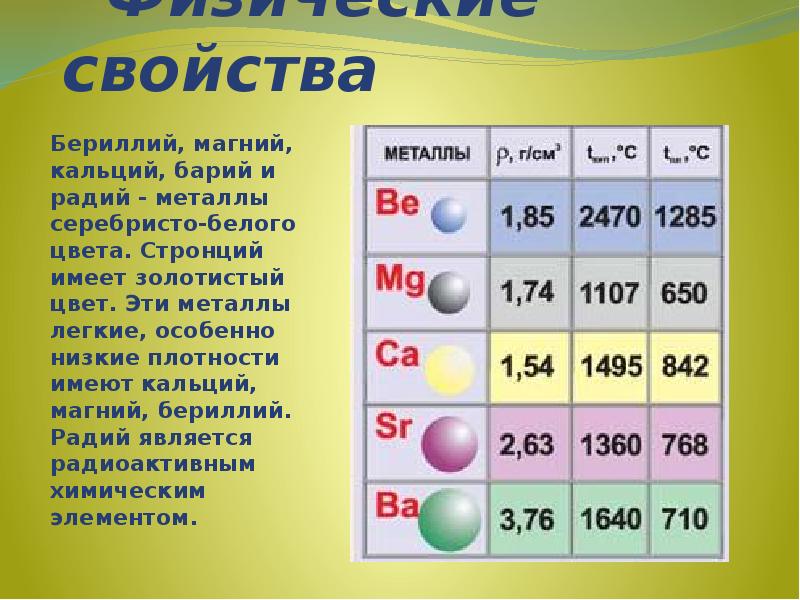
- 12. Физические свойства Бериллий, магний, кальций, барий и радий - металлы серебристо-белого
- 13. Получение щелочноземельных металлов Электролизом расплавов их хлоридов или термическим восстановлением их
- 14. Химические свойства Щелочноземельные элементы - химически активные металлы. Они являются сильными
- 15. Взаимодействие с простыми веществами Все легко взаимодействуют с кислородом и
- 16. Взаимодействие с кислотами Все взаимодействуют с хлороводородной и разбавленной серной
- 17. Взаимодействие со щелочами Бериллий взаимодействует с водными растворами щелочей с
- 18. Алюминий 13Al [Ne] 3s23p1 Алюминий находится в главной п/группе III
- 19. Физические свойства Металл серебристо-белого цвета, легкий, плотность 2,7 г/см³, температура плавления
- 20. Химические свойства С простыми веществами: 1) С кислородом: 4Al0 + 3O2
- 21. Со сложными веществами: Со сложными веществами: 4) С водой (после удаления
- 22. Получение алюминия
- 23. Применение алюминия — в электротехнике — для производства легких сплавов (дюралюмин,
- 24. Задания для закрепления знаний: Осуществить цепочку превращений: Аl → АlСl3 →
- 25. Найди соответствие 1. Активные металлы 2. Металлы средней активности 3. Благородные
- 26. Вставьте пропущенное слово: Наиболее выраженные металлические свойства проявляет: ? алюминий ? натрий
- 27. Калий взаимодействует с водой с образованием.... и .... Калий взаимодействует с
- 28. Решите задачи: Задача № 1 При обработке 8г смеси магния и
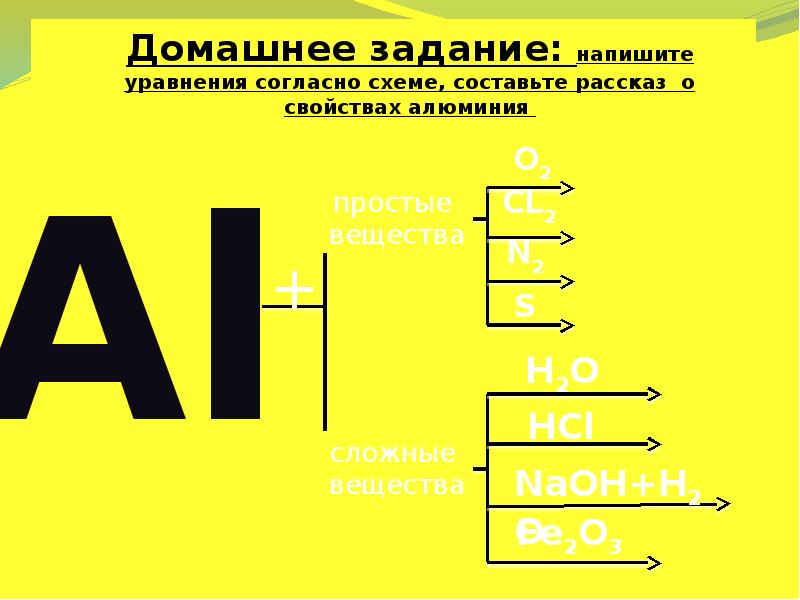
- 29. Домашнее задание: напишите уравнения согласно схеме, составьте рассказ о свойствах алюминия
- 30. Схема ответа:
- 31. Скачать презентацию











![Алюминий
13Al [Ne] 3s23p1
Алюминий находится в главной Алюминий
13Al [Ne] 3s23p1
Алюминий находится в главной](/documents_2/87bbd94fb473db46047a2aeff606c132/img17.jpg)










Слайды и текст этой презентации
Презентация на тему Общая характеристика металлов главных подгрупп I-III доступна для скачивания ниже:
Похожие презентации