Основные понятия и законы химии презентация
Содержание
- 3. Химия – это наука о составе, строении, свойствах и превращениях веществ.
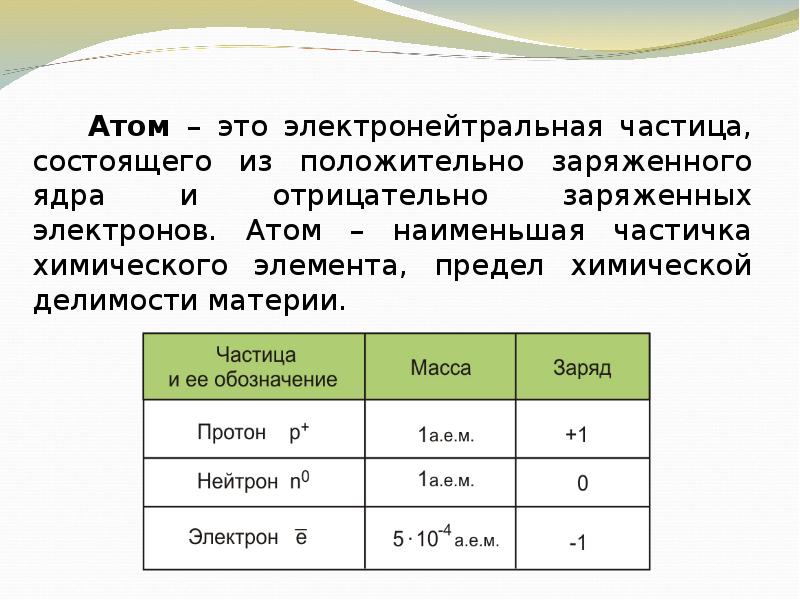
- 4. Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и
- 5. Молекула – это отдельная электронейтральная частица, образующаяся при возникновении ковалентных связей
- 6. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Вещества,
- 8. Простые вещества – это вещества, образованные одним химическим элементом. Простые вещества
- 9. Различают в качественный и количественный состав веществ. Качественный состав – это
- 10. Состав веществ отображают посредством химической символики. Состав веществ отображают посредством химической
- 11. Химический знак (символ) – несет значительную информацию. Он обозначает название элемента,
- 12. Химическая формула – это способ отображения химического состава вещества. Она обозначает
- 13. Формулы вещества составляют на основании еще одного важнейшего понятия в химии
- 14. Относительная атомная масса ( ) химического элемента – это величина, показывающая
- 15. Относительная атомная масса – одна из основных характеристик химического элемента. Относительная
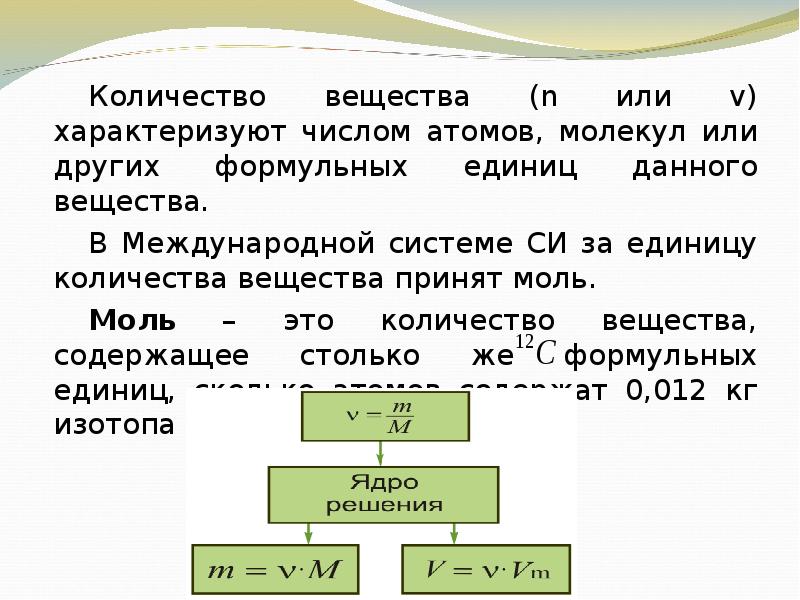
- 16. Количество вещества (n или v) характеризуют числом атомов, молекул или других
- 18. Массу одного моля называют молярной массой и обозначают буквой М:
- 19. Из этого выражения можно определить число молекул или атомов, содержащихся в
- 21. Закон сохранения массы. Закон сохранения массы. Был открыт М. В. Ломоносовым
- 22. Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные соотношения
- 23. Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в 1799 г.: Всякое
- 24. Современная формулировка закона постоянства состава вещества таков: Состав соединений молекулярной структуры
- 25. Закон Авогадро. Сформулирован А. Авогадро в результате проведения многочисленных экспериментов: В
- 26. Из закона Авогадро вытекают 2 следствия: Из закона Авогадро вытекают
- 27. Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся
- 28. Найдите относительные молекулярные массы веществ, состав которых описывается формулами: Найдите относительные
- 29. Сколько молекул содержится в 32 г сернистого газа Сколько молекул
- 30. Список использованной литературы Габриелян О.С. Химия для профессий и специальностей технического
- 31. Скачать презентацию




























Слайды и текст этой презентации
Похожие презентации





























