Классификация химических элементов
Содержание
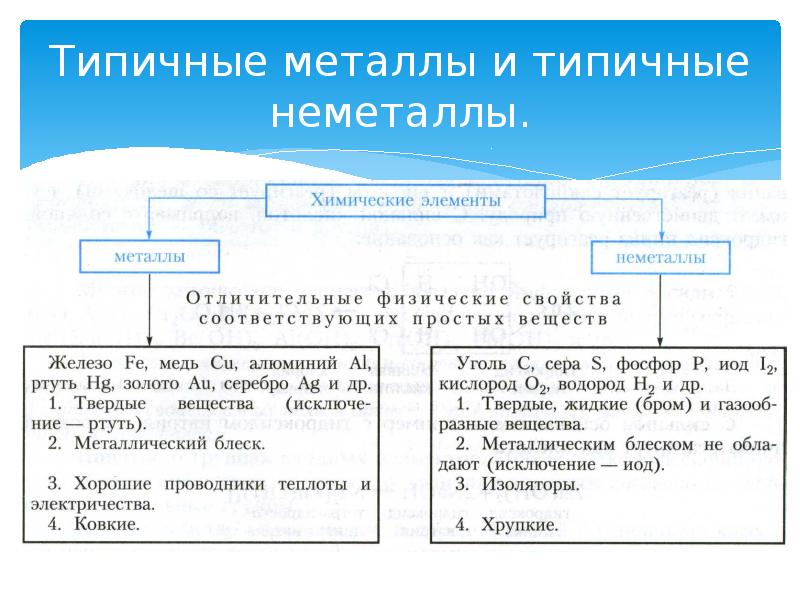
- 3. Типичные металлы и типичные неметаллы.
- 5. Найди соответствие, для этого выбери каждому номеру букву верного утверждения:
- 6. Верный ответ: 1- Б, В, Ж. 2 – А, Д.
- 7. Классификация химических элементов на металлы и неметаллы оказалась неполной Есть элементы,
- 8. 1.Амфотерные свойства оксида и гидроксида цинка. Оксид цинка взаимодействует с кислотами
- 9. 2.Амфотерные свойства оксида и гидроксида цинка Оксид и гидроксид цинка взаимодействуют
- 10. Составьте уравнения реакций, доказывающих амфотерный характер оксида и гидроксида алюминия
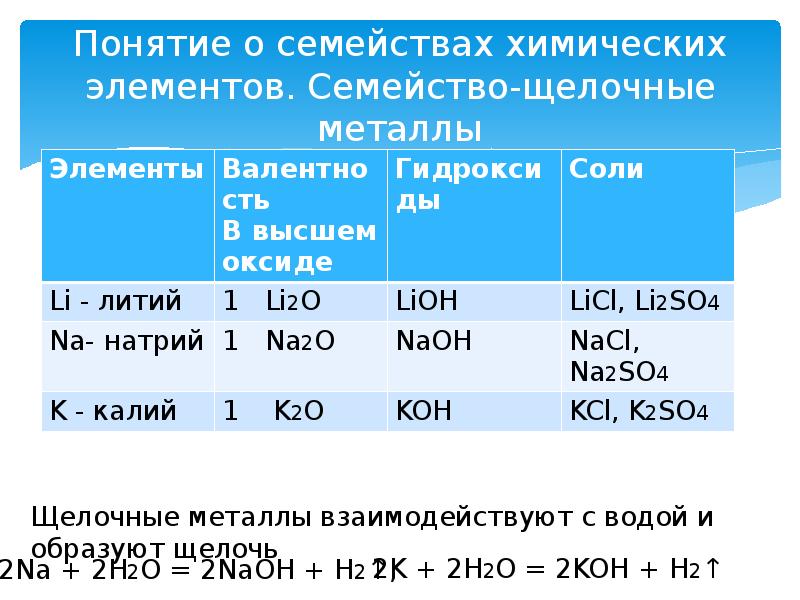
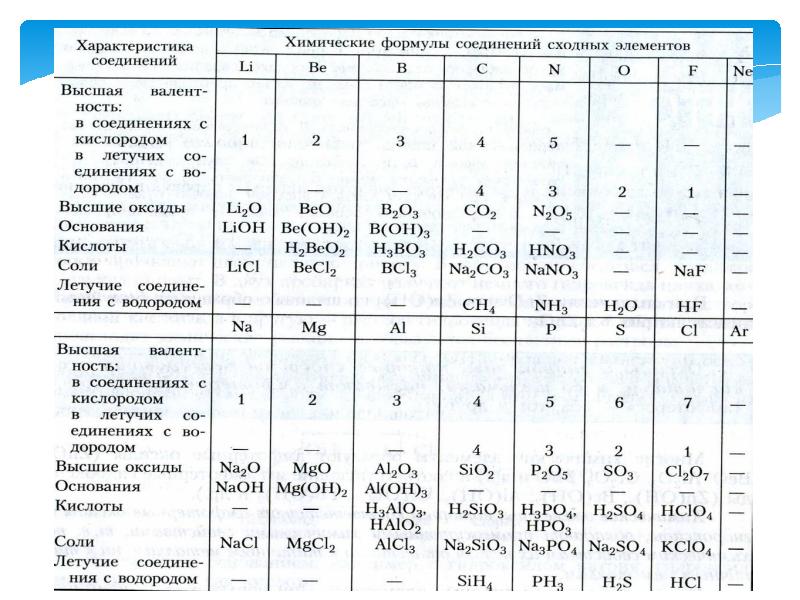
- 11. Понятие о семействах химических элементов. Семейство-щелочные металлы
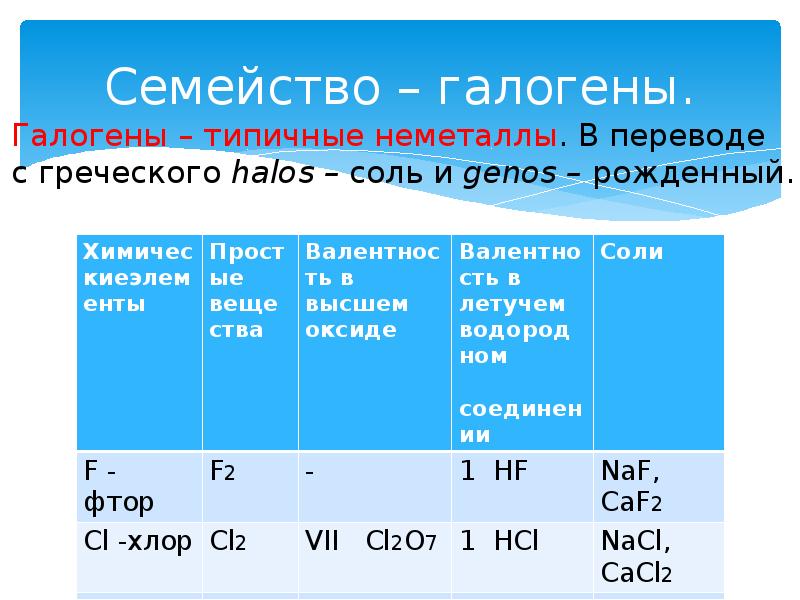
- 12. Семейство – галогены.
- 13. Открытие периодического закона Многие химики: немецкие ученые И. Деберейнер и Л.
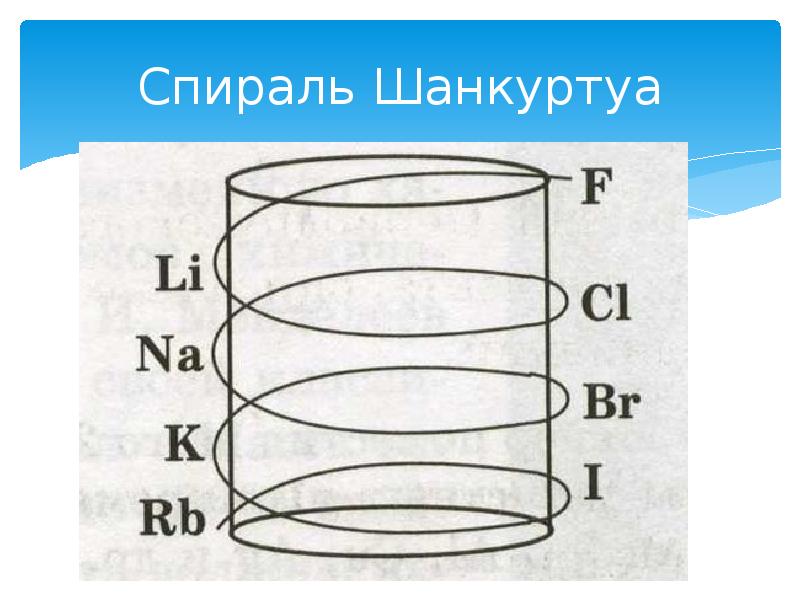
- 14. Спираль Шанкуртуа
- 15. Закон октав Дж. Ньюлендса
- 16. Триады Дёберейнера
- 17. Таблица химических элементов Л. Мейера
- 21. В основу периодического закона Д. И. Менделеев взял коренное свойство химического
- 22. Д. И. Менделеев сформулировал периодический закон так: Свойства простых тел, а
- 23. Возникают вопросы: Почему свойства химических элементов, расположенных в порядке возрастания относительных
- 24. Спасибо за сотрудничество! Спасибо за сотрудничество!
- 25. Скачать презентацию



















Слайды и текст этой презентации
Презентация на тему Классификация химических элементов доступна для скачивания ниже:
Похожие презентации





























