Реакции ионного обмена презентация
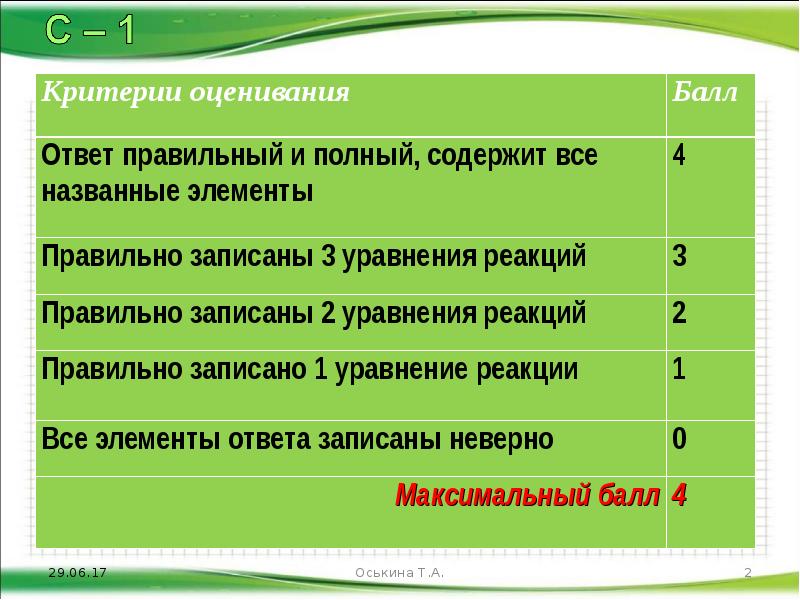
Содержание
- 3. Даны схемы превращений. Напишите молекулярные уравнения реакций, с помощью которых можно
- 4. Даны схемы превращений. Напишите молекулярные уравнения реакций, с помощью которых можно
- 5. Даны схемы превращений. Напишите молекулярные уравнения реакций, с помощью которых можно
- 6. Даны схемы превращений. Напишите молекулярные уравнения реакций, с помощью которых можно
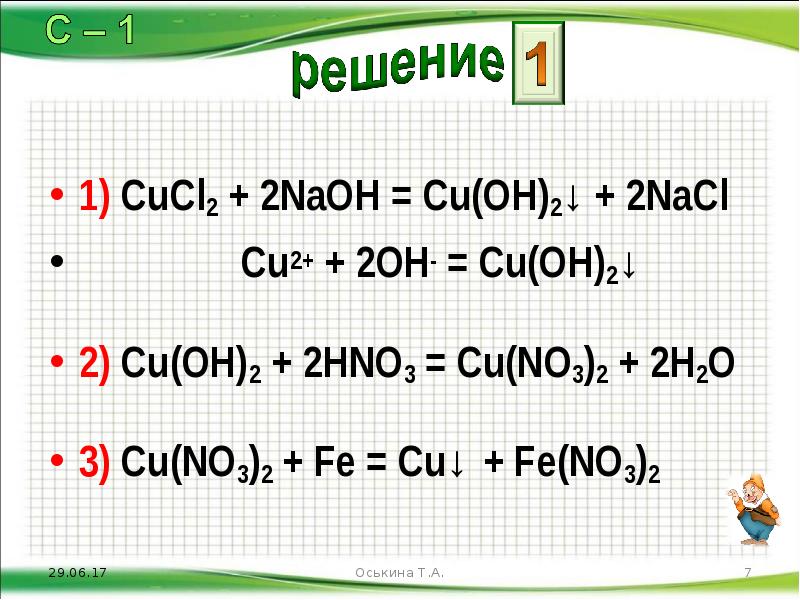
- 7. 1) CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
- 8. 1) Fe2(SO4)3 +6NaOH =2Fe(OH)3↓+ 3Na2SO4 Fe3+ +
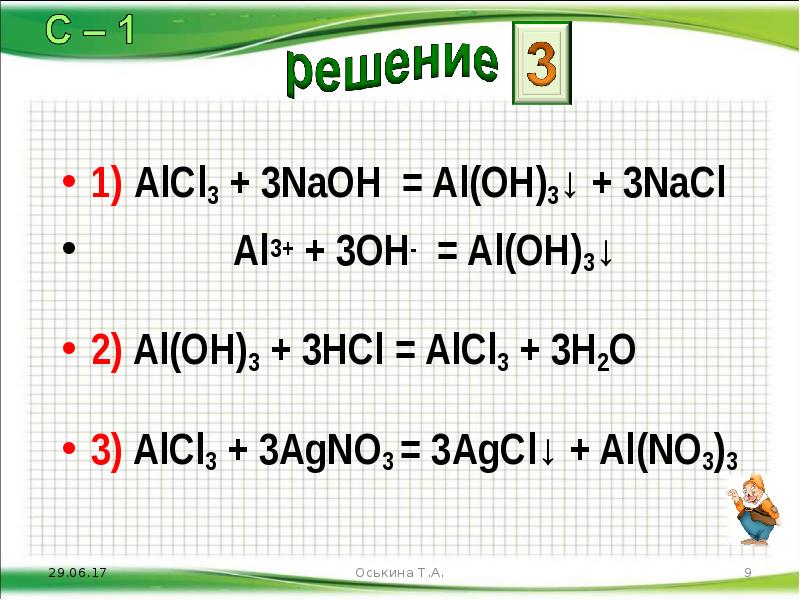
- 9. 1) AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
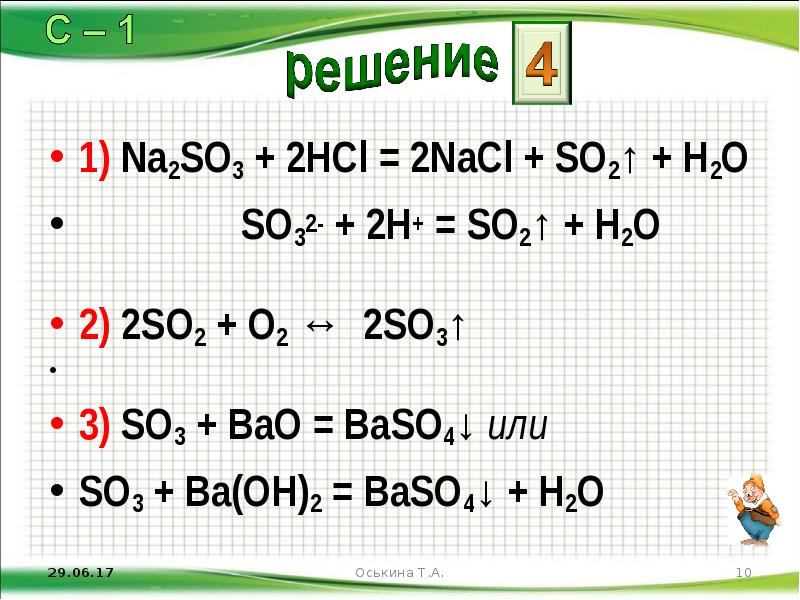
- 10. 1) Na2SO3 + 2HCl = 2NaCl + SO2↑ + H2O
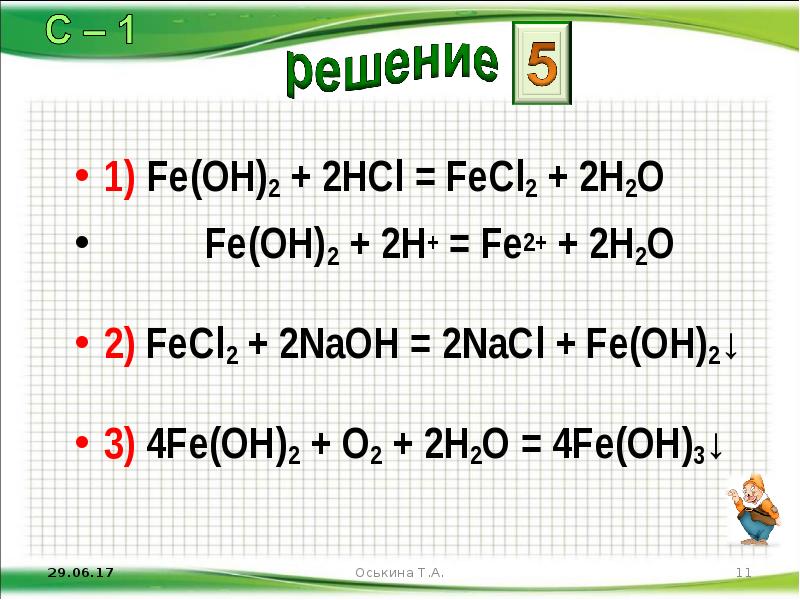
- 11. 1) Fe(OH)2 + 2HCl = FeCl2 + 2H2O
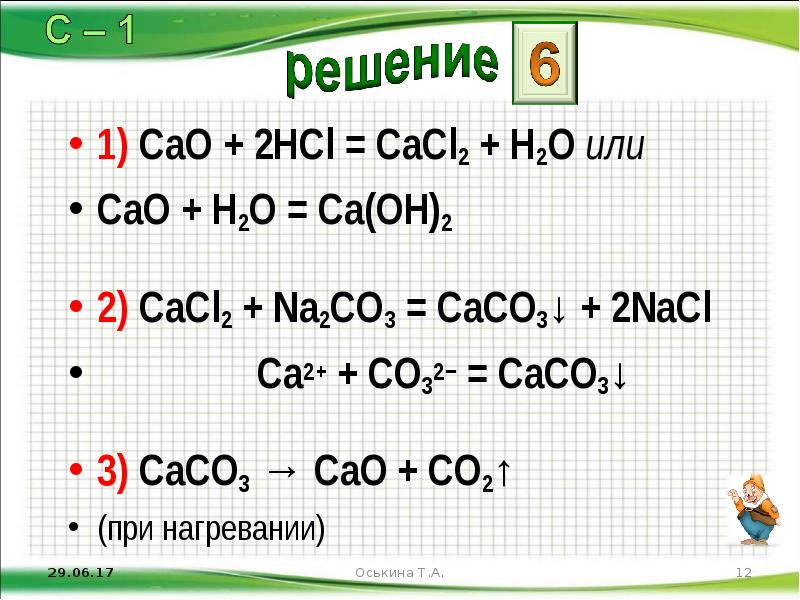
- 12. 1) CaO + 2HCl = CaCl2 + H2O или CaO +
- 13. 1) Zn + 2HCl = ZnCl2 + H2↑ 2) ZnCl2
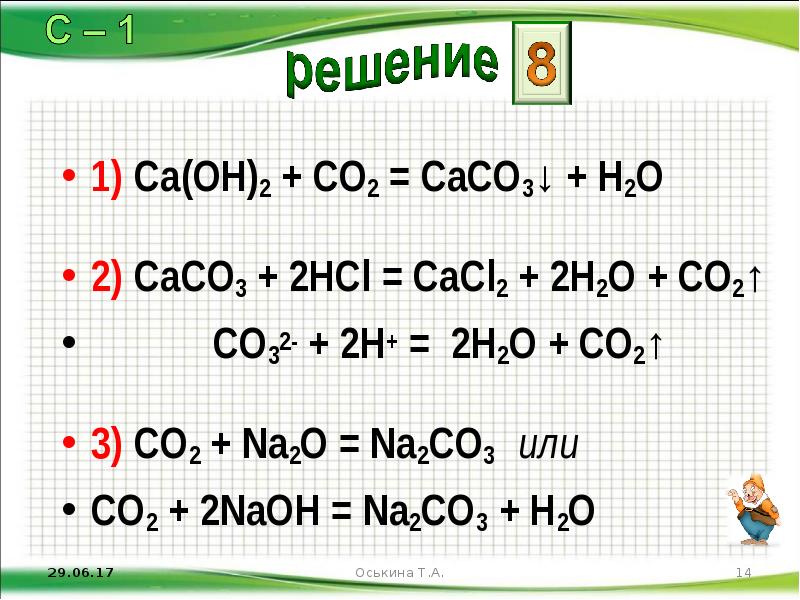
- 14. 1) Ca(OH)2 + CO2 = CaCO3↓ + H2O 2) CaCO3
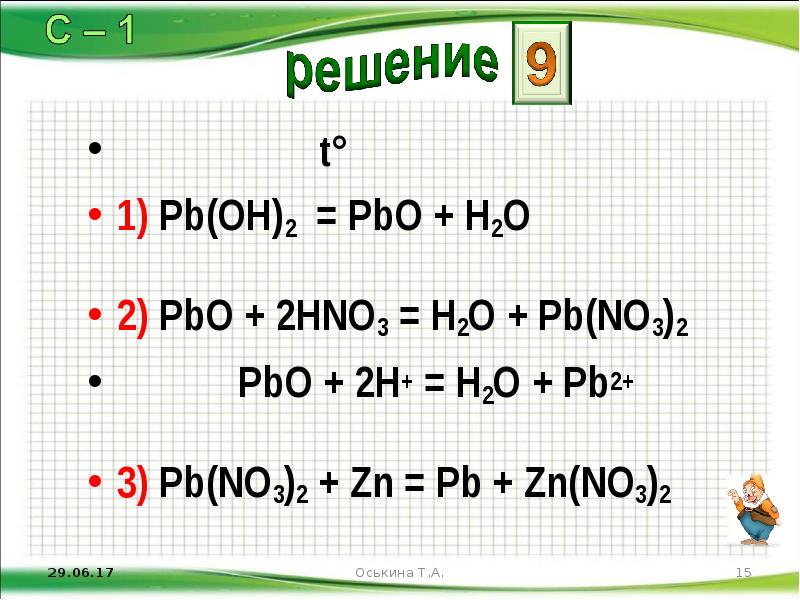
- 15. t° 1) Pb(OH)2 = PbО + H2O 2) PbО +
- 16. 1) 2Na + 2H2O = 2NaOH + H2↑ 2) 2NaOH
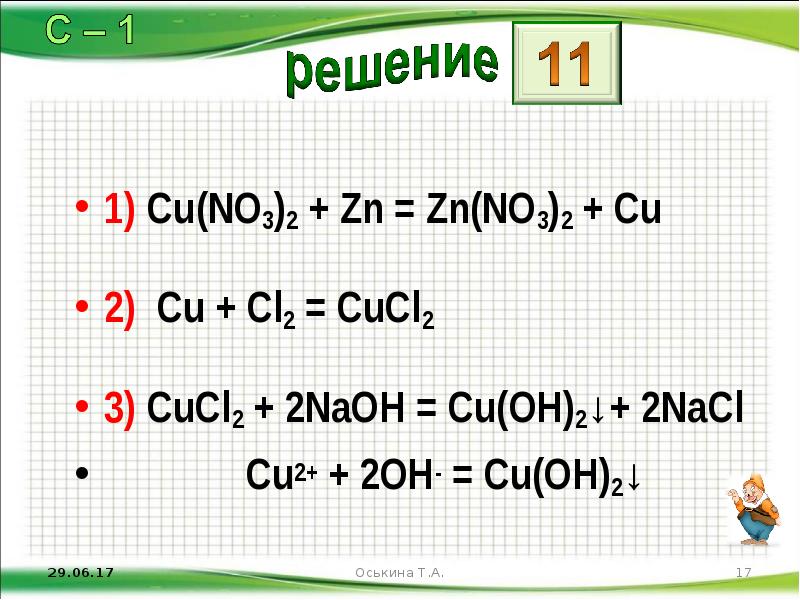
- 17. 1) Cu(NО3)2 + Zn = Zn(NО3)2 + Сu 2) Сu
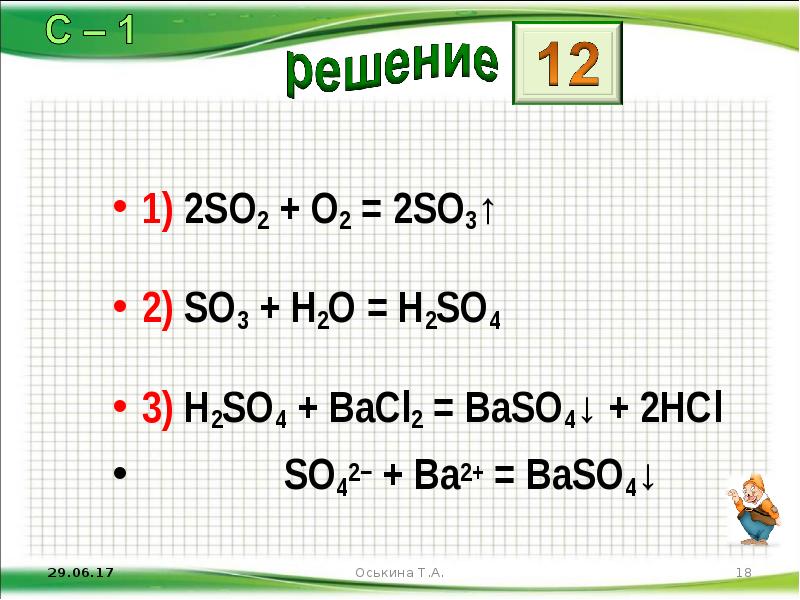
- 18. 1) 2SO2 + O2 = 2SO3↑ 2) SO3 + H2O
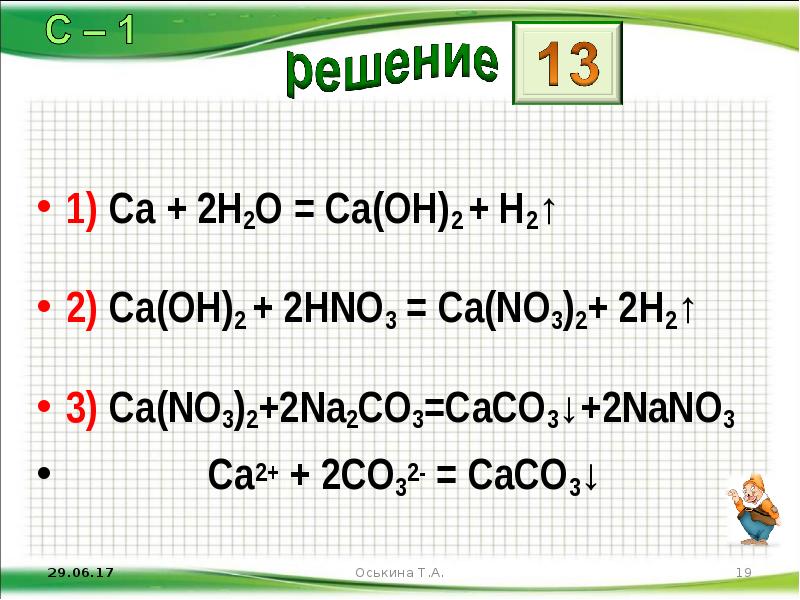
- 19. 1) Ca + 2H2O = Ca(OH)2 + H2↑ 2) Ca(OH)2
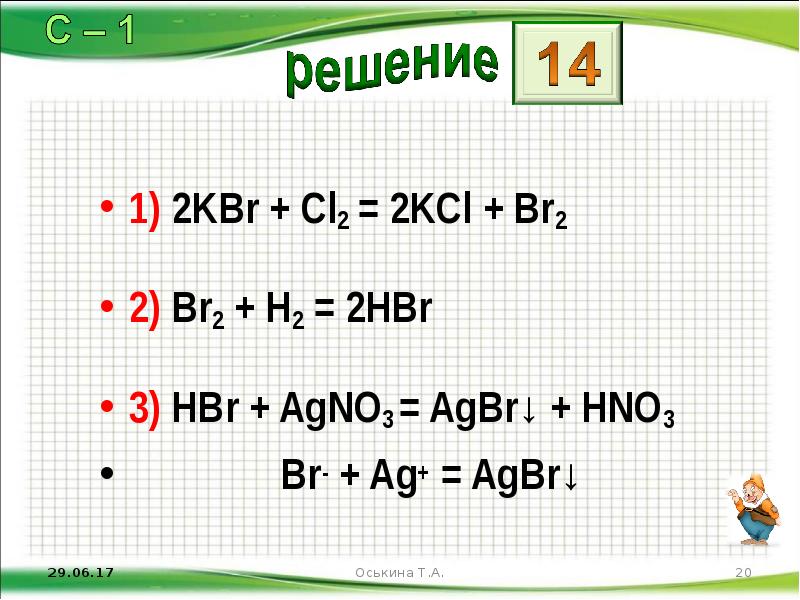
- 20. 1) 2KBr + Cl2 = 2KCl + Br2 2) Br2
- 21. 1) 2H2S + 3O2 = 2SO2↑ +2H2O 2) 2SO2 +
- 22. 1) CuSO4 + Fe = Cu↓ + FeSO4 (вместо железа можно
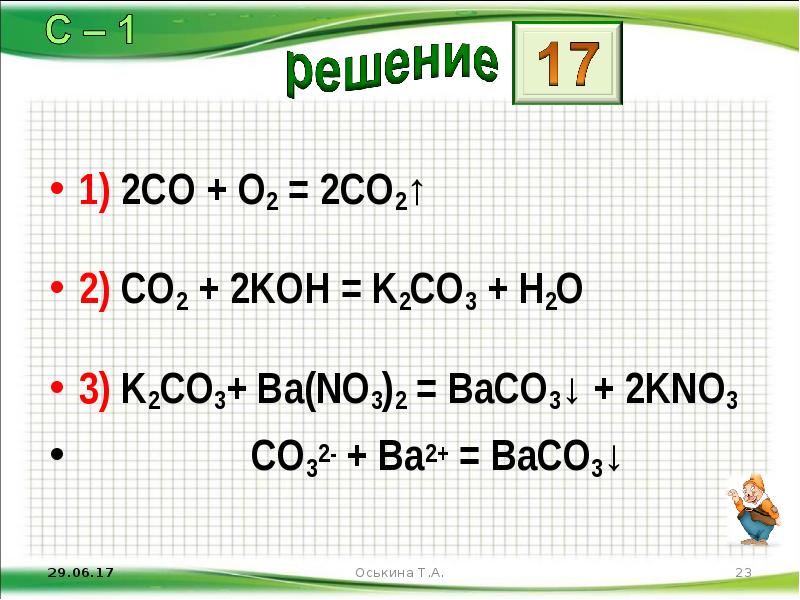
- 23. 1) 2CO + O2 = 2CO2↑ 2) CO2 + 2KOH
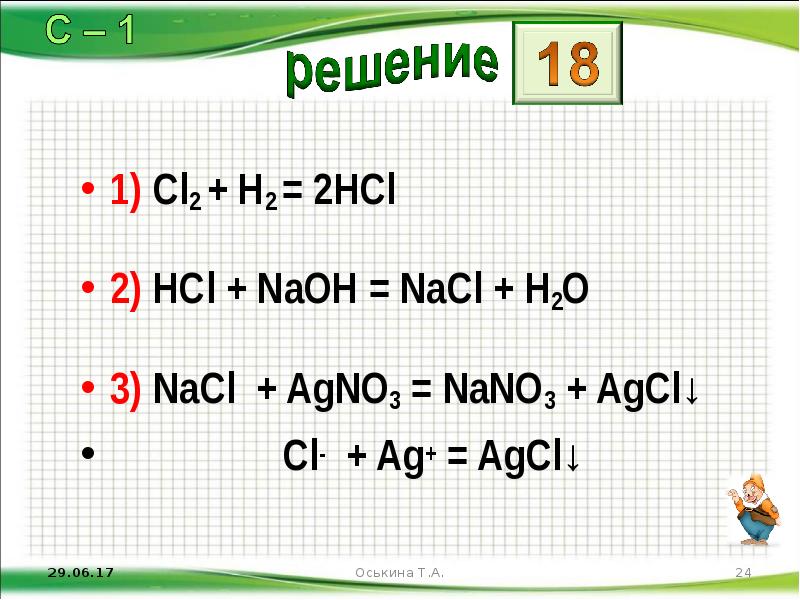
- 24. 1) Cl2 + H2 = 2HCl 2) HCl + NaOH
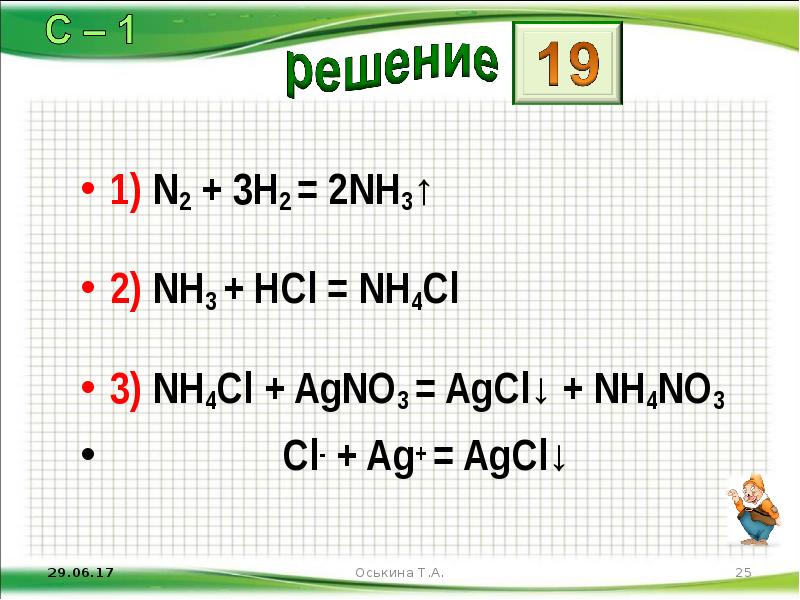
- 25. 1) N2 + 3H2 = 2NH3↑ 2) NH3 + HCl
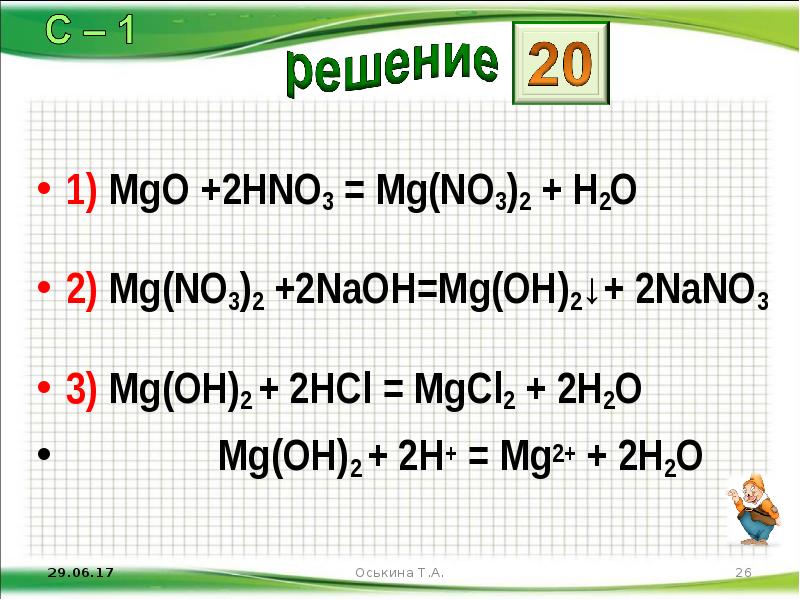
- 26. 1) MgO +2HNO3 = Mg(NO3)2 + H2O 2) Mg(NO3)2 +2NaOH=Mg(OH)2↓+
- 27. Демонстрационные варианты ГИА 2010-2013 гг. Тренировочные варианты экзаменационных работ для проведения
- 28. Скачать презентацию











Слайды и текст этой презентации
Похожие презентации





























