Щелочные и щелочноземельные металлы
Содержание
- 2. Щелочные металлы – элементы IA группы Перечислите известные вам щелочные металлы.
- 3. Из истории открытия элементов 19 ноября 1907 года в Лондоне на
- 5. 3 января 1959 года В небе появилась комета. Необычная комета
- 6. Физические свойства Какое строение характерно для кристаллов щелочных металлов? Как изменяются
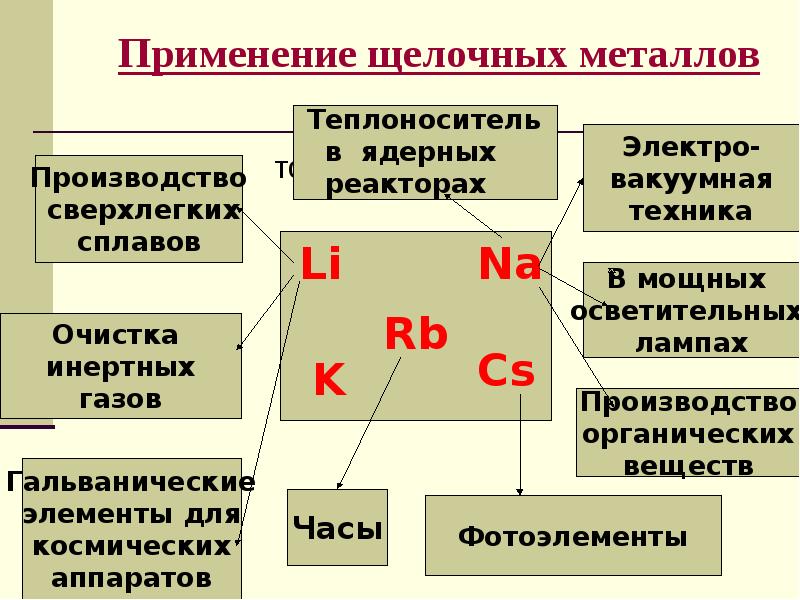
- 7. Применение щелочных металлов тото
- 8. Соединения щелочных металлов В ветхом завете упоминается некое вещество «нетер». Это
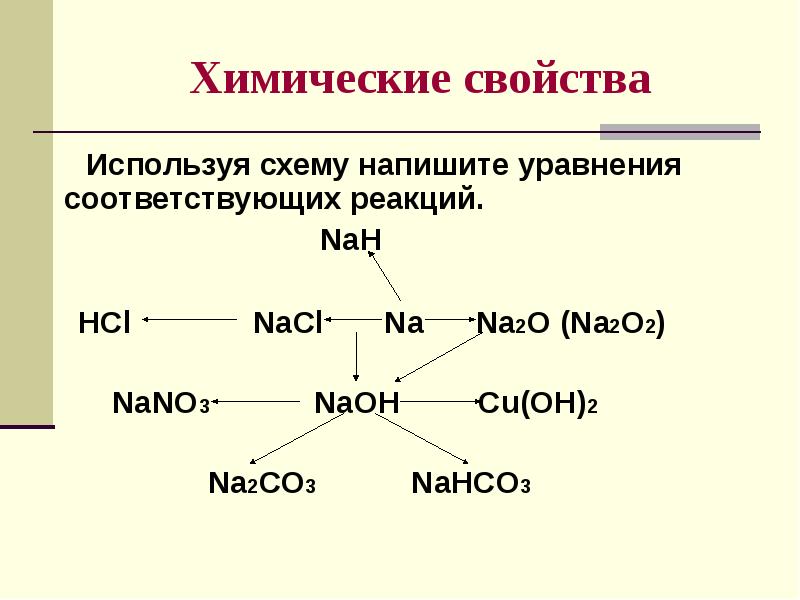
- 9. Химические свойства Используя схему напишите уравнения соответствующих реакций.
- 10. Щелочноземельные металлы-элементы IIA группы Щелочноземельными являются не все элементы IIА группы,
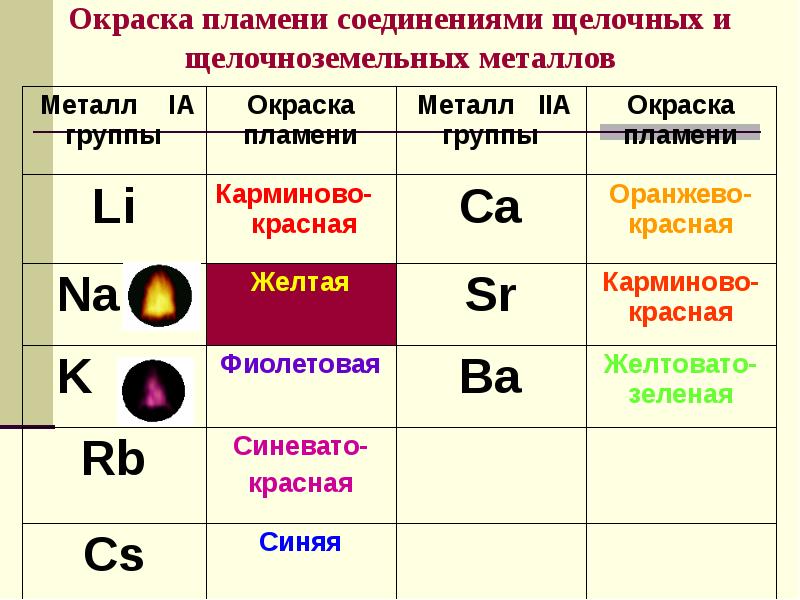
- 11. Окраска пламени соединениями щелочных и щелочноземельных металлов
- 12. Кальций –типичный представитель щелочноземельных металлов Дайте названия соединениям кальция: CaO
- 13. Жесткость воды
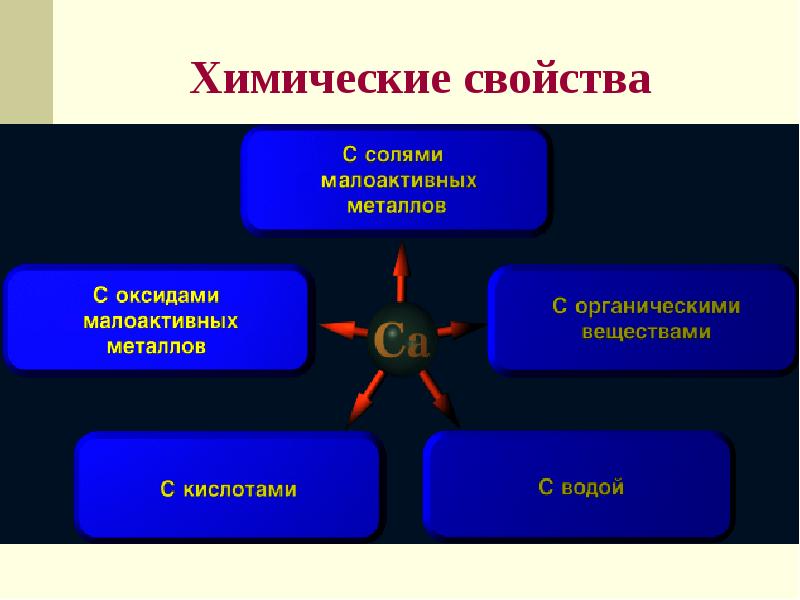
- 14. Химические свойства
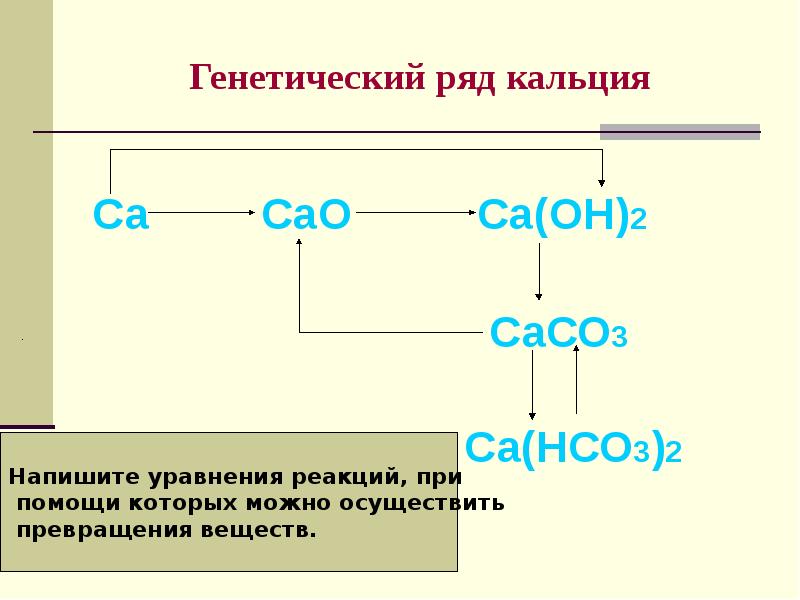
- 15. Генетический ряд кальция Са СаО Са(ОН)2
- 16. Кальций в природе Кальциевые горные породы – известняк, мрамор, мел.
- 17. Мел, известняк, мрамор не растворяются в чистой воде, но растворимы в
- 18. Как называются отложения, свисающие в виде гигантских сосулек со свода пещеры?
- 19. При воздействии кислотных дождей строения разрушаются.
- 20. ? ? ? Каково значение щелочных и щелочно-земельных металлов в жизни
- 21. Спасибо за работу!
- 22. Скачать презентацию















Слайды и текст этой презентации
Презентация на тему Щелочные и щелочноземельные металлы доступна для скачивания ниже:
Похожие презентации





























