Актиноиды и их применение презентация
Содержание
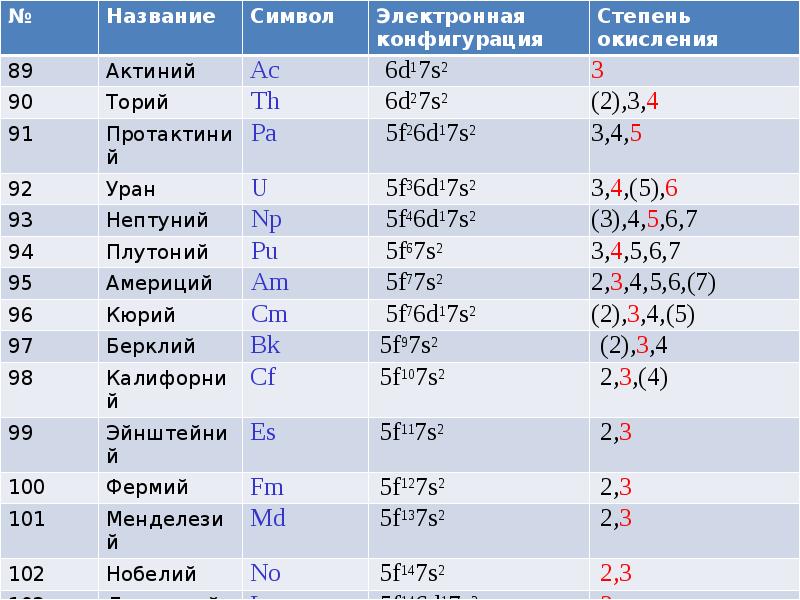
- 2. f-металлы Актиниды: химически очень разнообразны, с.о. от +2 до +7 Все
- 3. Заполняется f-подуровень 5-го периода Заполняется f-подуровень 5-го периода Близость 5f и
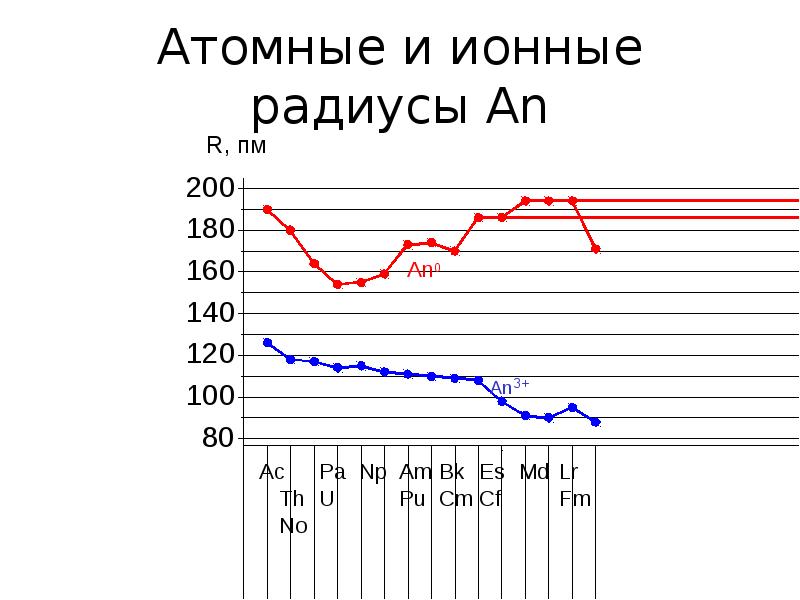
- 5. Атомные и ионные радиусы An
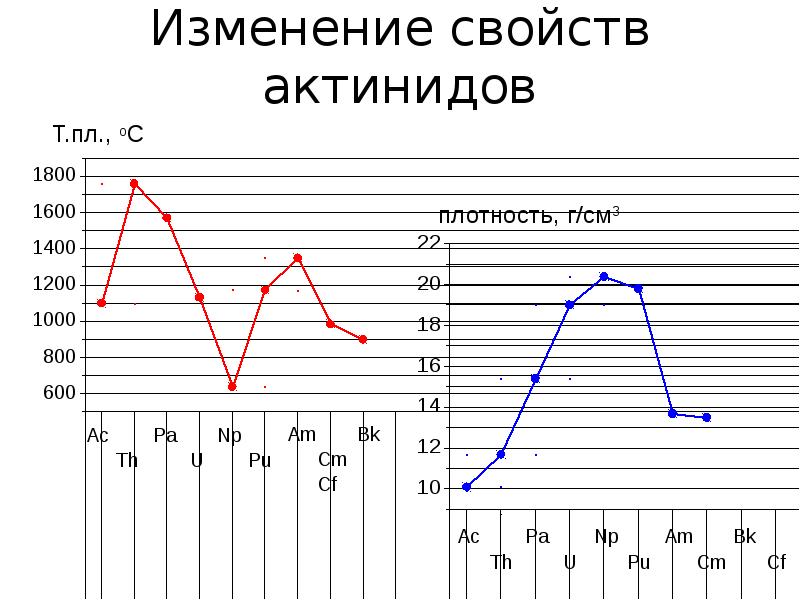
- 6. Физические свойства Все они мягкие, серебристого цвета, темнеют на воздухе, обладают
- 7. Изменение свойств актинидов
- 8. Химические свойства Все металлы растворяются в кислотах. Только актиний растворяется
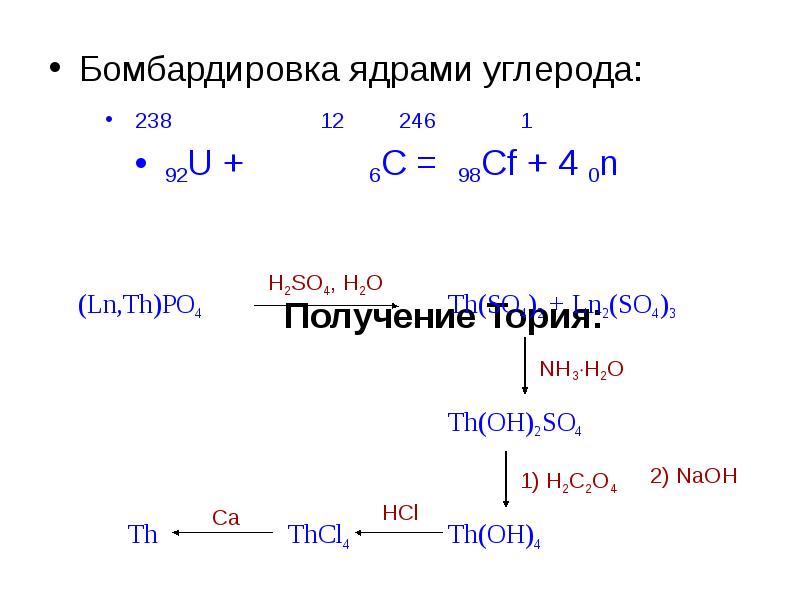
- 9. Получение актинидов Только Th и U получают химическими методами Остальные элементы
- 10. Бомбардировка ядрами углерода: Бомбардировка ядрами углерода: 238 12 246 1 92U + 6C = 98Cf +
- 11. Получение Урана Получение Урана
- 12. Основные минералы карнотит K2O2UO3V2O53H2O урановая смолка U3O8 монацит (Ln,Th)PO4
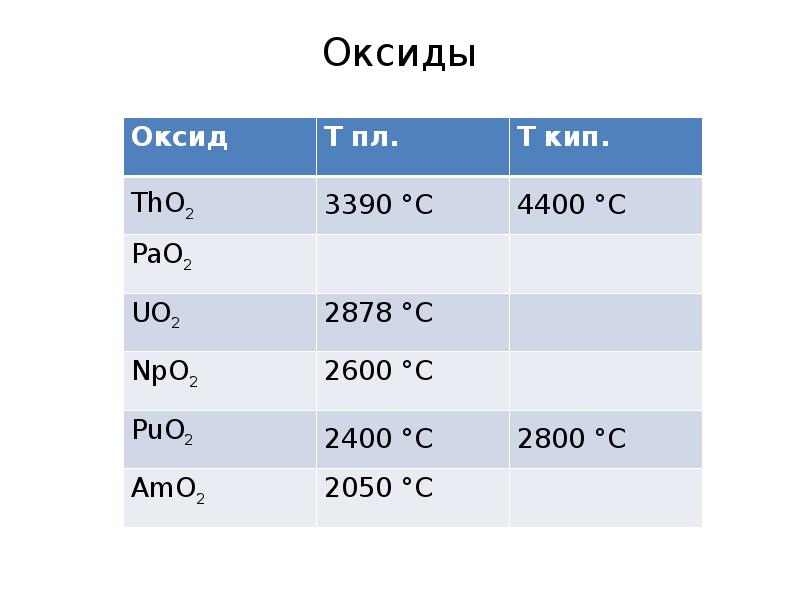
- 13. Оксиды
- 14. Получение оксидов Th(OH)4 = ThO2 + 2H2O 3U + 4O2 =
- 15. Гидроксиды Th(OH)4 = ThO2 + 2H2O ThCl4 + 4NH3·H2O = Th(OH)4↓
- 16. Химия тория
- 18. Химия урана
- 19. Различия лантанидов и актинидов Актиниды не имеют стабильных изотопов 4f-орбитали не
- 20. Применение приборостроение (датчики дыма) космические технологии создание ядерного оружия применение
- 21. Скачать презентацию















Слайды и текст этой презентации
Похожие презентации





























