Ароматические амины презентация
Содержание
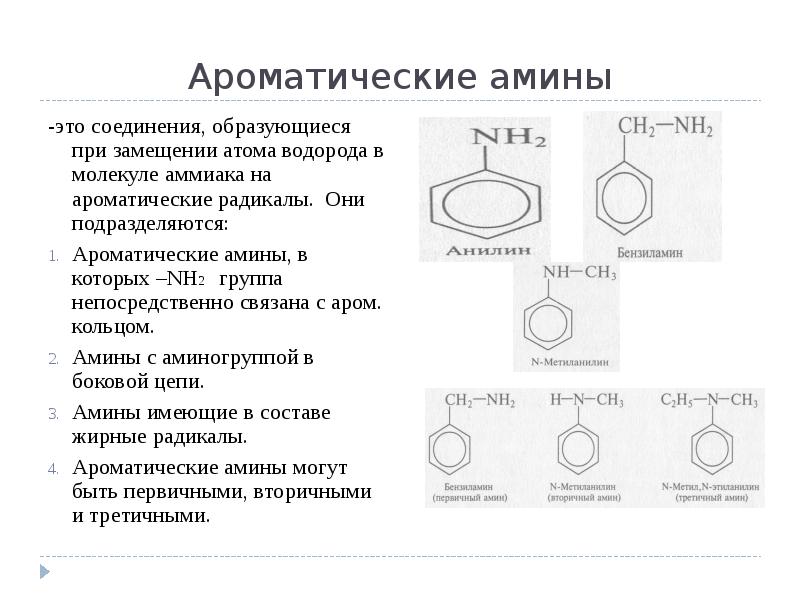
- 2. Ароматические амины -это соединения, образующиеся при замещении атома водорода в молекуле
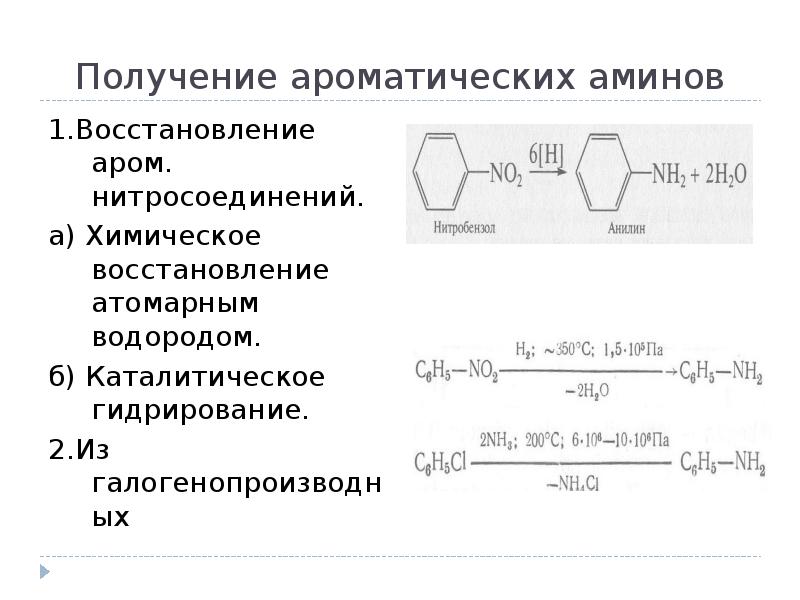
- 3. Получение ароматических аминов 1.Восстановление аром. нитросоединений. а) Химическое восстановление атомарным водородом.
- 4. Получение вторичных и третичных аминов Ar2NH – чисто ароматические вторичные амины
- 5. Физические свойства Ароматические амины – жидкости или твердые вещества
- 6. Химические свойства Кислотные свойства
- 7. Химические свойства Основность аминов
- 8. Алкилирование (реакция Гофмана) Получение алкильных производных аминов замещением водородных атомов аминогруппы
- 9. Взаимодействие аминов с азотной кислотой Азотистая кислота не существует в свободном
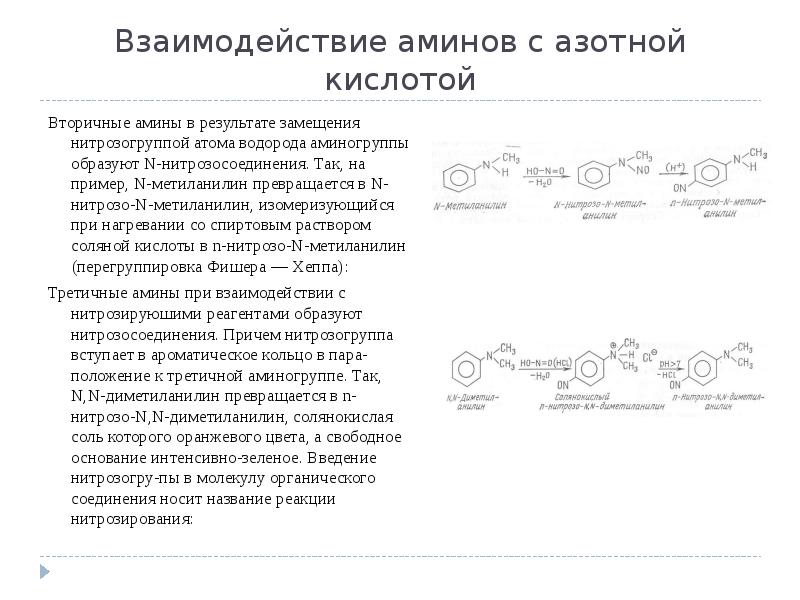
- 10. Взаимодействие аминов с азотной кислотой Вторичные амины в результате замещения нитрозогруппой
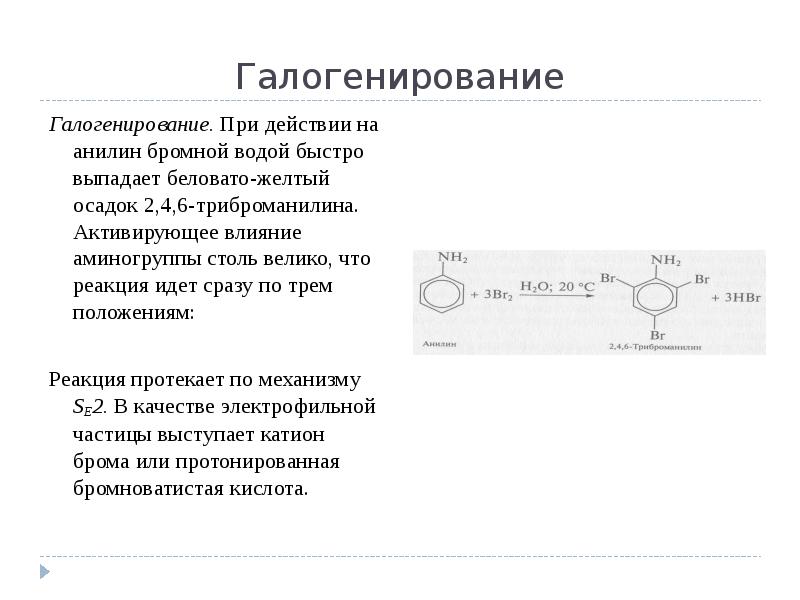
- 11. Галогенирование Галогенирование. При действии на анилин бромной водой быстро выпадает беловато-желтый
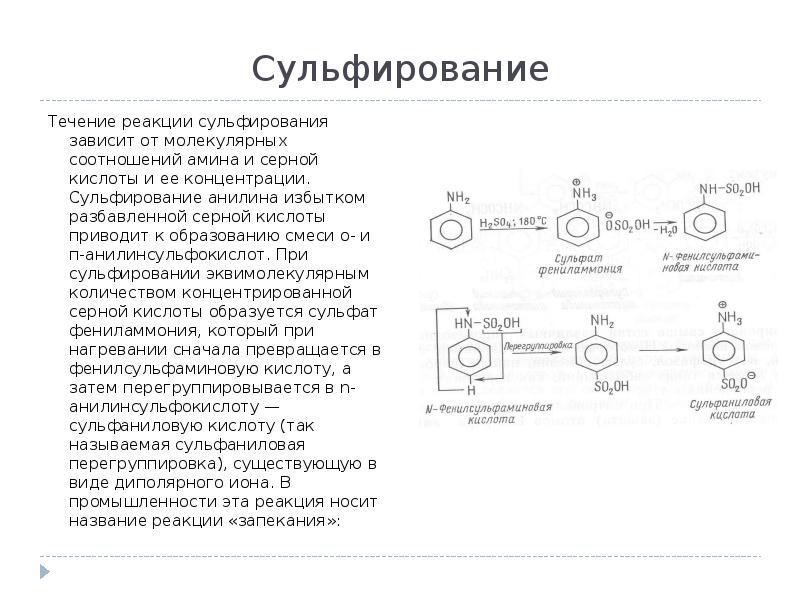
- 12. Сульфирование Течение реакции сульфирования зависит от молекулярных соотношений амина и серной
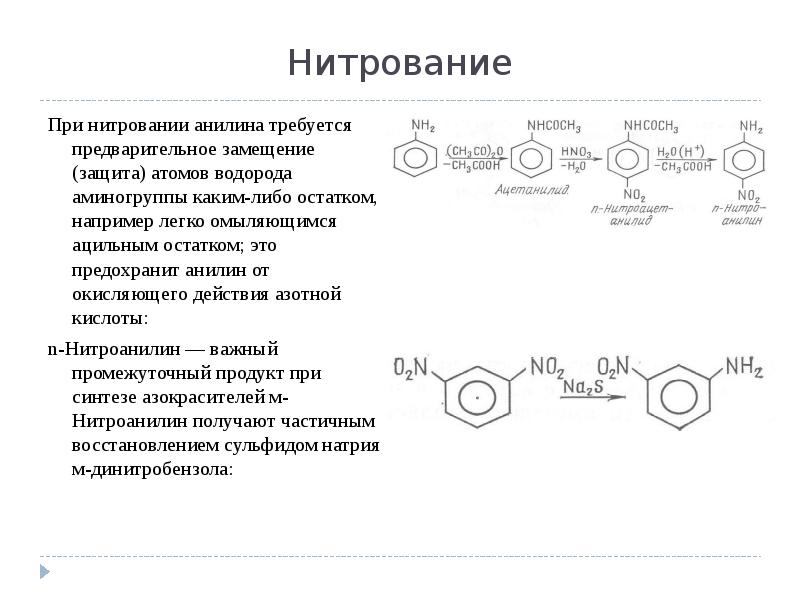
- 13. Нитрование При нитровании анилина требуется предварительное замещение (защита) атомов водорода аминогруппы
- 14. Спасибо за внимание
- 15. Скачать презентацию








Слайды и текст этой презентации
Похожие презентации





























