Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы презентация
Содержание
- 2. Предмет электрохимии Превращение химической энергии в электрическую Особенности свойств растворов электролитов
- 3. Электропроводность растворов Удельная электропроводимость Молярная электрическая проводимость Закон Кольрауша Кондуктометрическое титрование
- 4. Проводники электрического тока Первого рода: все металлы, их сплавы, графит Электронная
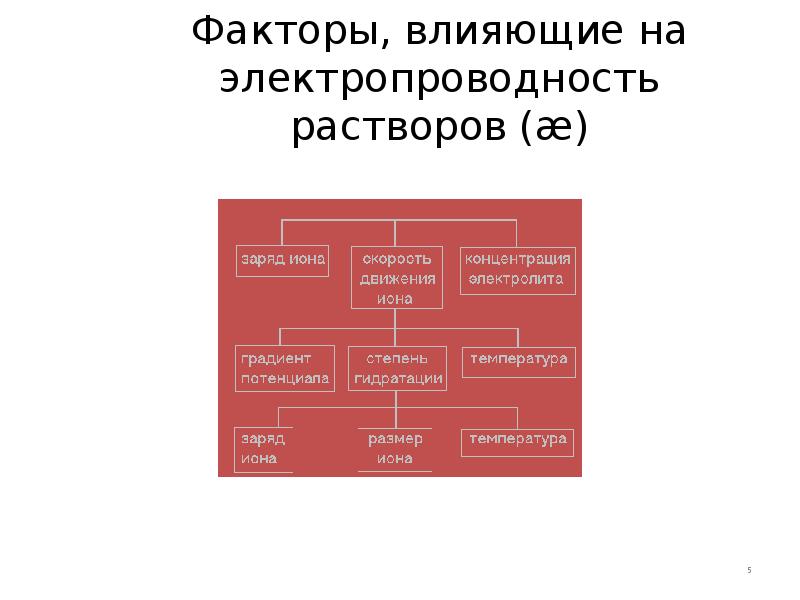
- 5. Факторы, влияющие на электропроводность растворов (æ)
- 6. Заряд иона Чем больше заряд иона и чем больше скорость его
- 7. Градиент потенциала (напряженность, Е) При небольшой напряженности электрического поля æ постоянна
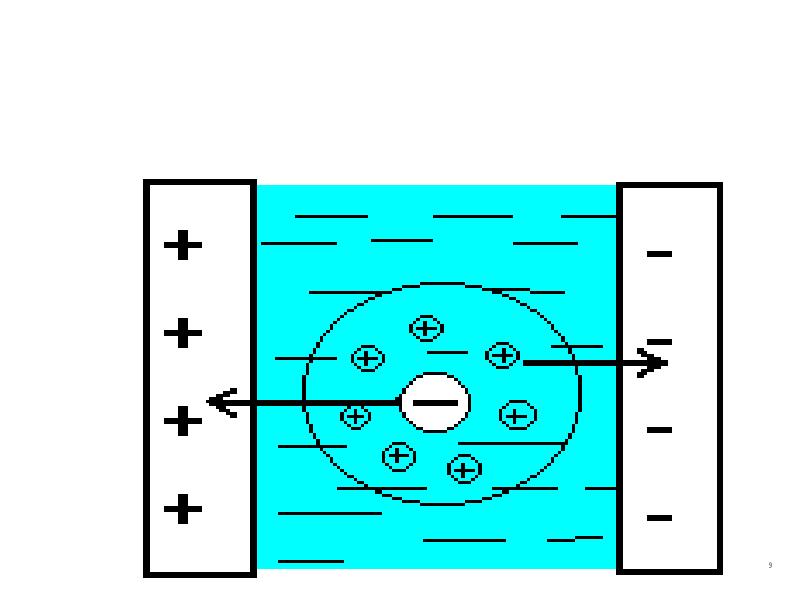
- 8. Электрофоретический эффект Торможение носителей поля за счет того, что ионы противоположного
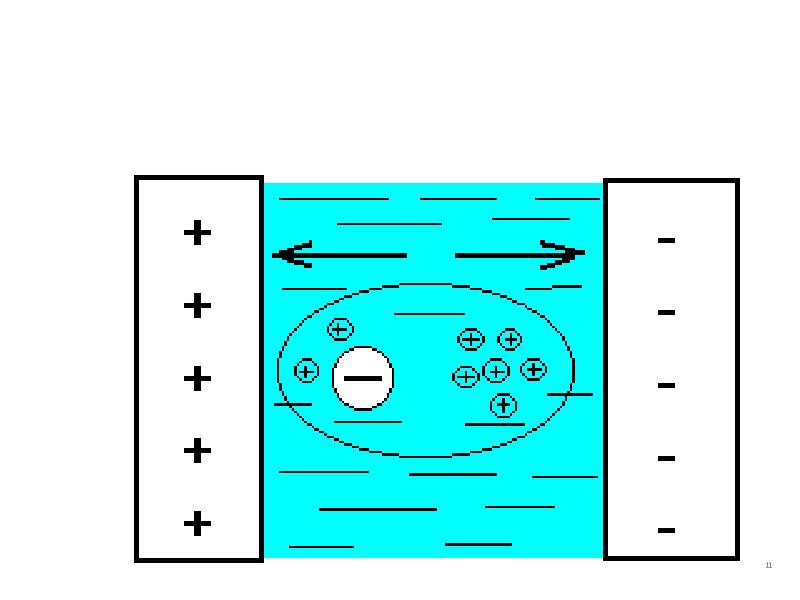
- 10. Релаксационный эффект Торможение носителей в связи с тем, что ионы при
- 12. Температура При увеличении температуры скорость движения ионов возрастает Температура усиливает тепловое
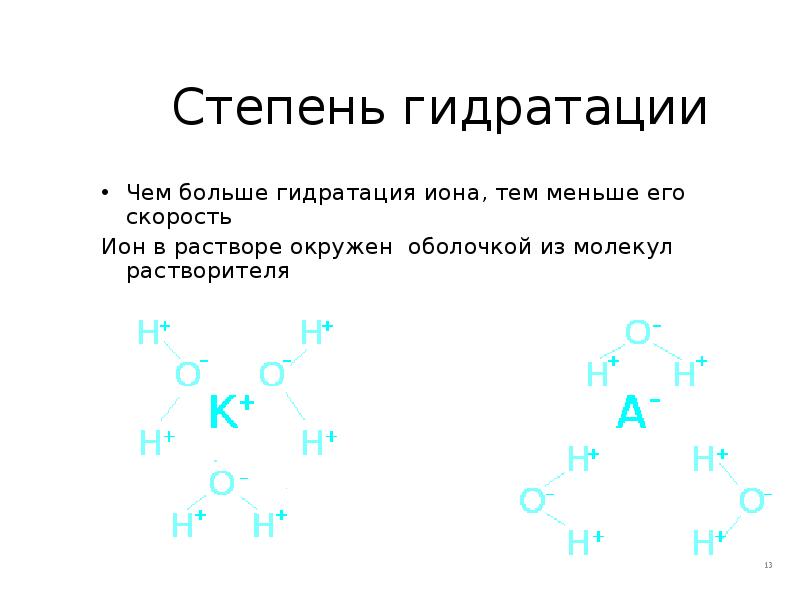
- 13. Степень гидратации Чем больше гидратация иона, тем меньше его скорость Ион
- 14. Заряд и размер иона Чем больше заряд иона, тем больше степень
- 15. Температура Чем выше температура, тем меньше степень гидратации Частичная дегидратация ионов
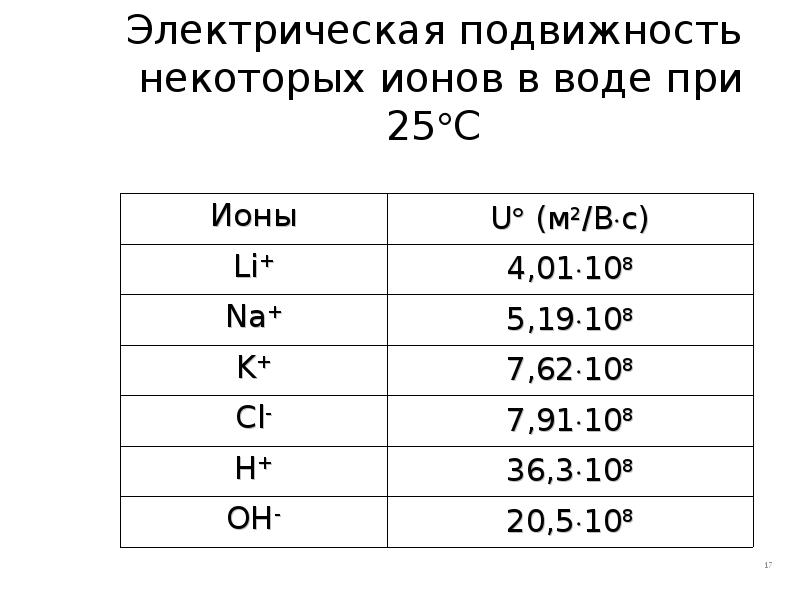
- 16. Электрическая подвижность (U) Скорость движения иона в растворе при бесконечном разведении
- 17. Электрическая подвижность некоторых ионов в воде при 25С
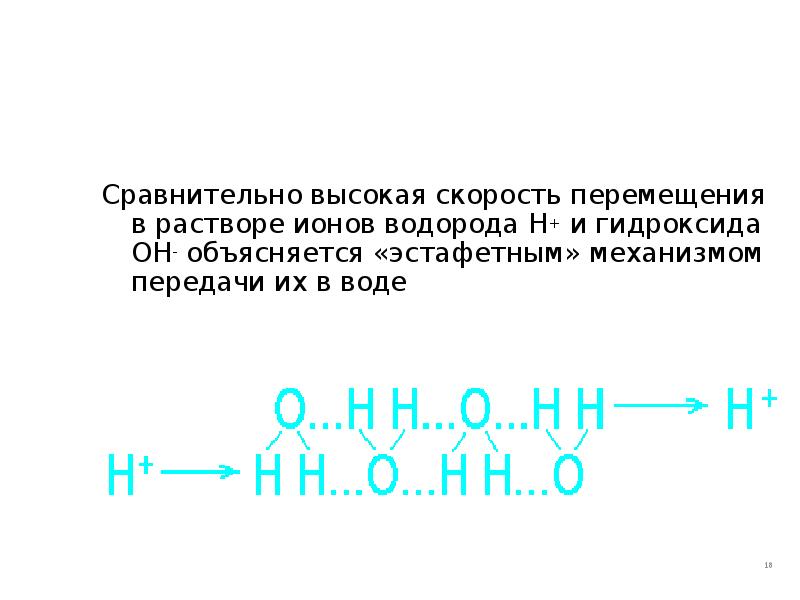
- 18. Сравнительно высокая скорость перемещения в растворе ионов водорода H+ и гидроксида
- 19. Электропроводность Величина обратная сопротивлению проводника тока 1 L = ------- (Ом-1)
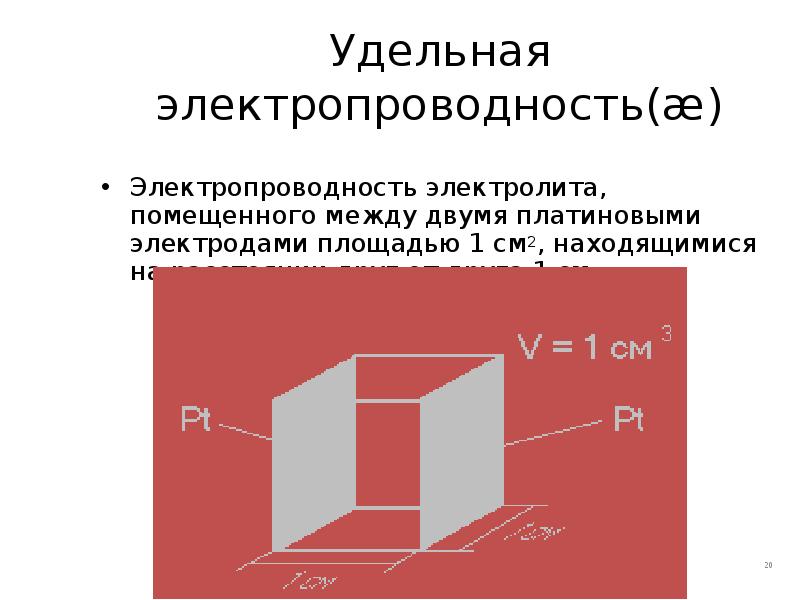
- 20. Удельная электропроводность(æ) Электропроводность электролита, помещенного между двумя платиновыми электродами площадью 1
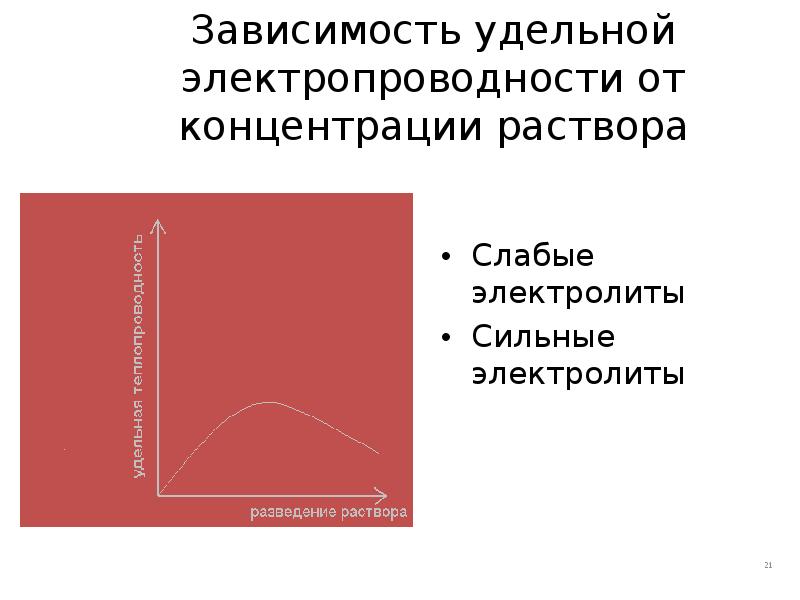
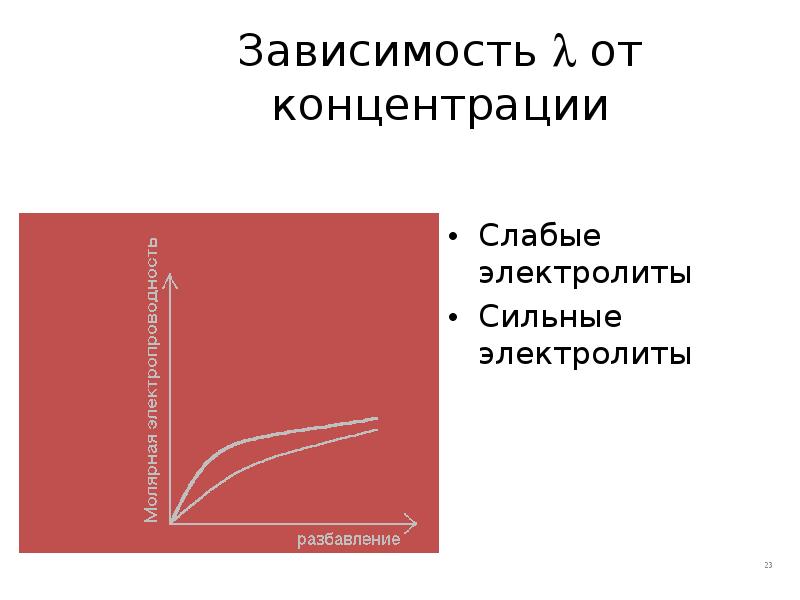
- 21. Зависимость удельной электропроводности от концентрации раствора Слабые электролиты Сильные электролиты
- 22. Молярная электропроводность () Электропроводность раствора электролита, содержащего 1 моль эквивалента электролита,
- 23. Зависимость от концентрации Слабые электролиты Сильные электролиты
- 24. Связь удельной и молярной электропроводности 1000æ = æ1000V(л)
- 25. Закон Кольрауша При бесконечном разведении раствора электролита катионы и анионы проводят
- 26. Математическое выражение закона = lК + lА , где lК
- 27. Практическое значение электропроводности Кондуктометрия – метод анализа, основанный на определении электропроводности
- 28. Кондуктометрия = = -----
- 29. Ионное произведение воды [H+] = C 1000 C =
- 30. Кондуктометрическое титрование Метод анализа, в котором точка эквивалентности определяется по изменению
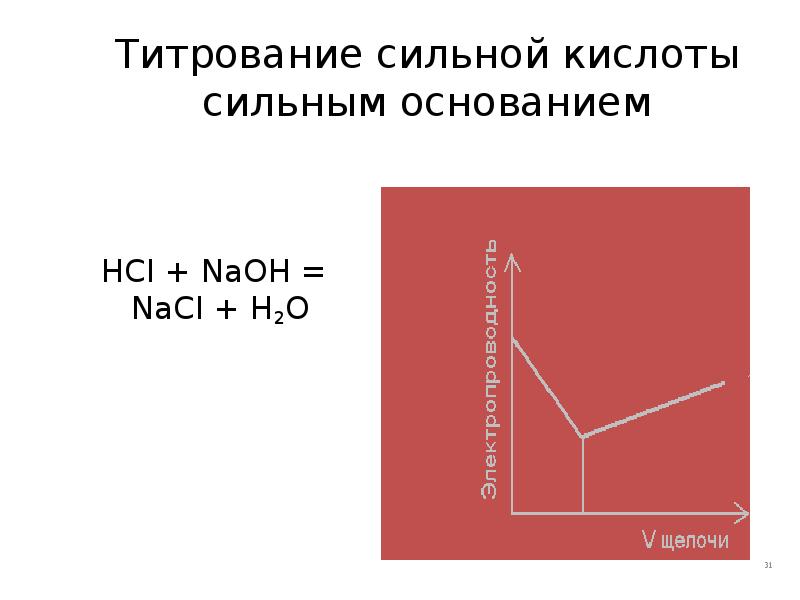
- 31. Титрование сильной кислоты сильным основанием HCI + NaOH = NaCI +
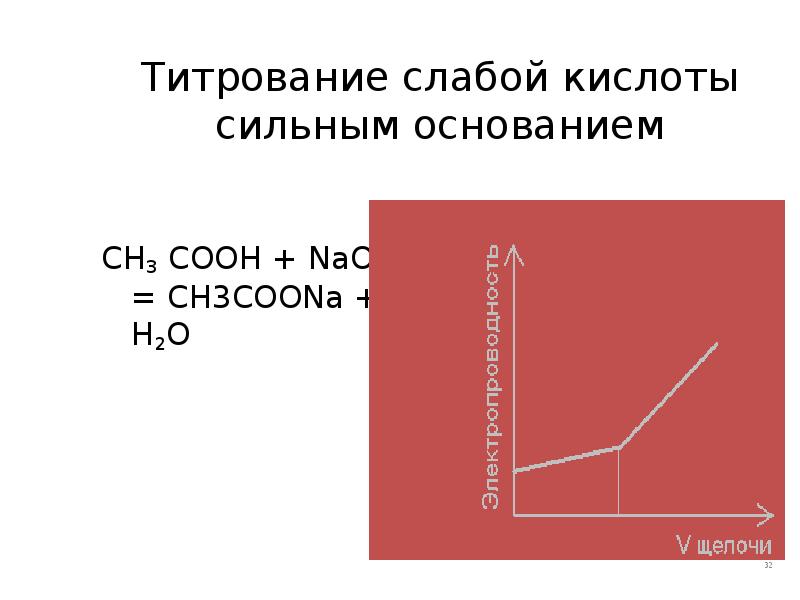
- 32. Титрование слабой кислоты сильным основанием CH3 COOH + NaOH = CH3COONa
- 33. Зависимость L тканей от частоты переменного тока В норме: С увеличением
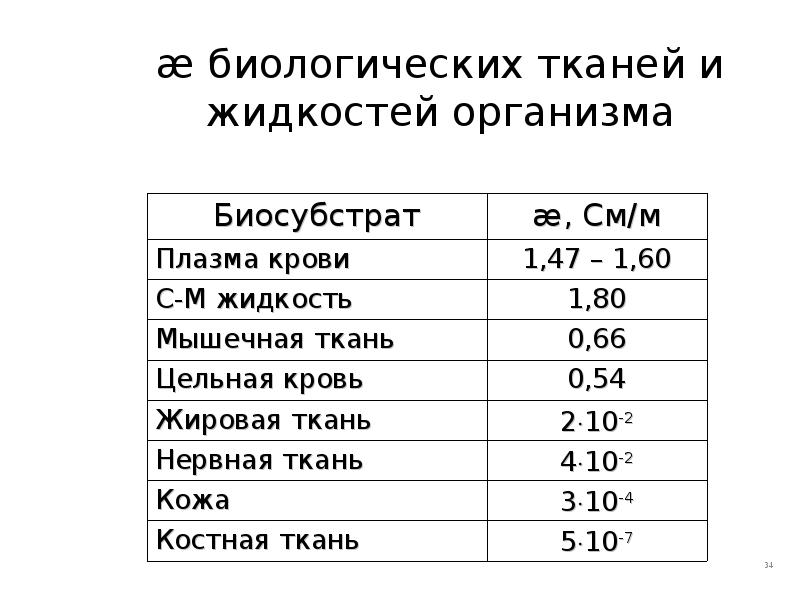
- 34. æ биологических тканей и жидкостей организма
- 35. Значение электропроводности в медицине Использование в диагностике: Реография Рефлексология (определение акупунктурных
- 36. Скачать презентацию



















![Ионное произведение воды
[H+] = C
1000
C = Ионное произведение воды
[H+] = C
1000
C =](/documents_3/069beafe715bccb76ffed3e7b67de6ee/img28.jpg)



Слайды и текст этой презентации
Скачать презентацию на тему Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы можно ниже:
Похожие презентации





























