Элементы побочной подгруппы IV презентация
Содержание
- 2. Элементы побочной подгруппы IV группы образуют подгруппу титана.
- 3. Электронное строение +22 Ti …3S23p63d24S2 +40 Zr ...4S24p64d24f05S2 +72 Hf ...5S25p65d25f05g06S2
- 4. Титан
- 5. Цирконий
- 6. Гафний Гафний (лат. Hafnium), Hf , химический элемент с атомным номером
- 7. Резерфордий Резерфордий (лат. Rutherfordium, Rf, до 1997 года также Курчатовий, Ku) —
- 8. Титан. История открытия. Открытие TiO2 сделали практически одновременно и независимо
- 9. История и происхождение названия циркония Цирко́ний в виде двуокиси впервые был
- 10. История открытия гафния Существование гафния было предсказано Д. И. Менделеевым в
- 11. Открытие резерфордия Впервые сто четвёртый элемент периодической системы
- 12. Нахождение в природе Титан В свободном виде не встречается. Важнейшие
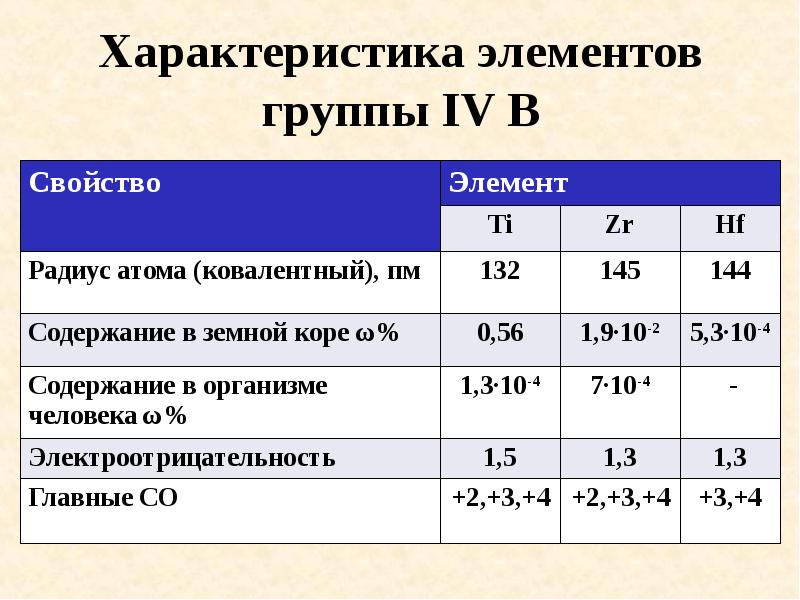
- 13. Характеристика элементов группы IV B
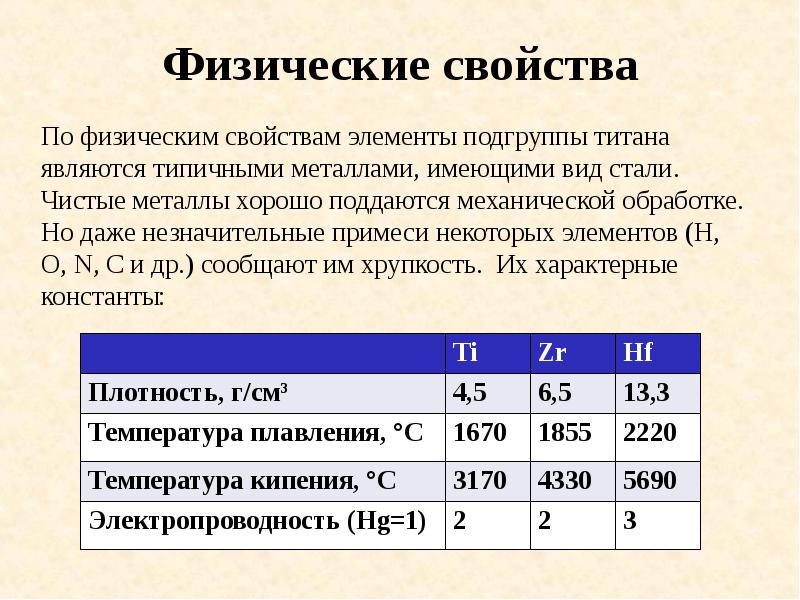
- 14. Физические свойства
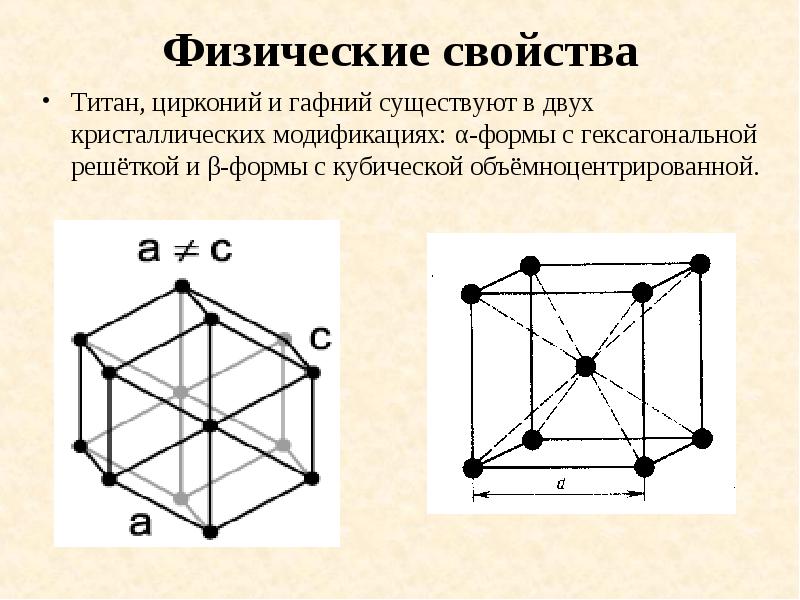
- 15. Физические свойства Титан, цирконий и гафний существуют в двух кристаллических модификациях:
- 16. Получение Титана Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке.
- 17. Получение циркония Обогащенную циркониевую руду спекают при 600—700°C с фторсиликатом калия
- 18. Получение гафния Получают попутно с цирконием. Отделить гафний от всегда сопутствующего
- 19. Химические свойства титана При нагревании на воздухе до 1200°C Ti загорается
- 20. Химические свойства титана Диоксид титана амфотерен, то есть проявляет как осно́вные,
- 21. Химические свойства титана C перекисью водорода даёт ортотитановую кислоту:
- 22. Химические свойства циркония Цирконий выше 800 °С энергично взаимодействует с кислородом
- 23. Химические свойства циркония Цирконий взаимодействует с кислотами, если возможно образование его
- 24. Химические свойства гафния По химическим свойствам гафний подобен цирконию. При
- 25. Химические свойства гафния В смеси азотной и плавиковой кислот и в
- 26. Применение титана В виде сплавов Металл применяется в химической
- 27. Применение циркония Металлический цирконий, не содержащий гафния, и его сплавы
- 28. Применение гафния Основная часть производимого гафния в виде HfO2 применяется для
- 29. Спасибо за внимание. Спасибо за внимание.
- 30. Скачать презентацию


























Слайды и текст этой презентации
Похожие презентации





























